TGase催化玉米醇溶蛋白糖基化改性
周利敏,刘晓兰,刘 玥,郑喜群
(齐齐哈尔大学食品与生物工程学院,农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔 161006)
TGase催化玉米醇溶蛋白糖基化改性
周利敏,刘晓兰,刘 玥,郑喜群*
(齐齐哈尔大学食品与生物工程学院,农产品加工黑龙江省普通高校重点实验室,黑龙江 齐齐哈尔 161006)
利用转谷氨酰胺酶(transglutaminase,TGase)催化玉米醇溶蛋白与氨基葡萄糖盐酸盐(glucosamine hydrochloride,GAH)发生交联反应。通过SDS-聚丙烯酰胺凝胶电泳确认玉米醇溶蛋白与GAH发生交联反应。以玉米醇溶蛋白糖基化修饰产物中GAH导入量为指标,优化糖基化反应条件,并对玉米醇溶蛋白糖基化修饰样品的溶解性进行了表征。结果表明,最适的糖基化反应条件为底物质量浓度5 g/100 mL、TGase添加量50 U/g(以玉米醇溶蛋白计)、玉米醇溶蛋白中酰基供体与GAH中的酰基受体物质的量比1∶6、初始pH 8.0、反应温度44 ℃、反应时间7 h;此反应条件下,玉米醇溶蛋白中GAH的最大导入量为(11.34±0.21) mg/g(以玉米醇溶蛋白计)。与玉米醇溶蛋白相比,玉米醇溶蛋白交联样品与糖基化修饰样品的溶解性均得到提高,玉米醇溶蛋白糖基化修饰样品的溶解性最高。
玉米醇溶蛋白;转谷氨酰胺酶;糖基化;蛋白质改性
玉米醇溶蛋白是玉米蛋白质的主要成分,约占玉米蛋白含量的68%~72%。玉米醇溶蛋白中主要的氨基酸为谷氨酸(含谷氨酰胺)(约为21%~26%)、亮氨酸(约为20%)、脯氨酸(约为10%)、丙氨酸(约为10%)[1]。其中,谷氨酰胺为TGase催化蛋白质与糖共价交联的作用位点。非极性氨基酸含量高,碱性和酸性氨基酸缺乏,且赖氨酸和色氨酸含量极低,对机体来说,玉米醇溶蛋白是不完全蛋白质。特殊的氨基酸组成造成玉米醇溶蛋白不溶于水,易溶于乙醇溶液、十二烷基硫酸钠、高浓度尿素等有机溶剂的特性,限制了其在食品工业中的实际应用。
20世纪80年代已有糖与蛋白之间共价结合作用的相关报道。基于这一结合特性,蛋白质糖基化改性方面的研究逐渐得到展开[2]。已有研究表明:蛋白质多肽链中糖链的引入,使得蛋白质的功能性,如溶解性、热稳定性、乳化性、起泡性、凝胶性等得到显著改善,甚至增加某些蛋白质的抗氧化性、抑菌性和降低免疫原性[3]。
目前,酶法糖基化反应主要是用糖基转移酶[4]、糖苷酶[5]或转谷氨酰胺酶(transglutaminase,TGase)[6-7]催化糖基连接到受体分子上。由于底物的高度专一性,糖基转移酶很难在体外直接催化蛋白质与糖类物质发生糖基化反应。糖苷酶专一性较低,合成的糖基化产物很少。微生物TGase因来源广泛、价格低廉、安全性高而被广泛关注。Villalonga等[8]研究了TGase催化胰蛋白酶与β-环糊精衍生物交联反应条件,表征了修饰产物的热稳定性;Jiang Shujuan等[9-10]研究了TGase催化大豆分离蛋白或酪蛋白与氨基葡萄糖盐酸盐(glucosamine hydrochloride,GAH)交联反应条件,表征了修饰产物的溶解性、乳化性、起泡性等功能性质,均得到不同程度的改善。
玉米醇溶蛋白的改性大多利用化学方法,包括磷酸化[11]、酰化[12]、去酰胺[13]与交联剂共价交联[14]、美拉德糖基化[15]、成脂和成氢键改性[16]等。采用TGase催化玉米醇溶蛋白糖基化反应尚无报道。与化学方法相比,TGase催化玉米醇溶蛋白糖基化反应具有特异性强、反应条件温和、速率高、周期短、无毒副作用等优点。本实验利用TGase催化GAH接枝到玉米醇溶蛋白分子上,优化了糖基化反应条件,以期为玉米醇溶蛋白在食品工业的研究及应用提供基础方法。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉 中粮生化能源(龙江)有限公司;TGase(固体) 泰兴市一鸣生物制品有限公司;D-GAH、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate, sodium salt-polyacrylamide gelelectrophoresis,SDS-PAGE)标准蛋白 上海生工生物工程有限公司。其他试剂均为分析纯。
1.2 方法
1.2.1 玉米醇溶蛋白的提取
采用60%~95%乙醇萃取法[17]。
1.2.2 原料理化指标测定
玉米醇溶蛋白中总蛋白采用微量凯氏定氮法测定,参照GB 5009.5—1985《食品中蛋白质的测定方法》;GAH中糖含量采用斐林试剂热滴定法测定;玉米醇溶蛋白、GAH中水分含量采用恒重法测定,参照GB 5497—1985《粮食、油料检测水分测定法》;TGase采用氧肟酸法测定,参照转谷氨酰胺酶活测定方法[18]。
1.2.3 TGase催化玉米醇溶蛋白糖基化反应
将玉米醇溶蛋白(蛋白干基)按照一定底物质量浓度配制成悬浮液,以反应体系中酰基供体与酰基受体物质的量比1∶6添加GAH,用2 mol/L NaOH溶液调整初始pH值至7.5。TGase添加量为50 U/g(以玉米醇溶蛋白计,下同),混匀,于37 ℃恒温水浴振荡中反应8 h。反应结束后样品于85 ℃沸水中灭酶5 min,冷却。4 ℃透析48 h除去未交联的GAH,样品冻干备用。
1.2.4 样品中氨基葡萄糖含量的测定
酸水解后的样品过滤后,用6 mol/L NaOH溶液调节pH值至偏碱性,取1.5 mL,加入1.5 mL DNS试剂,沸水中反应5 min,冷却后补加1.0 mL蒸馏水,测定540 nm波长处的吸光度。代入标准曲线(y=0.003x-0.101 3, R2=0.998)中,计算糖含量。重复3 次测定,结果表示为平均值±标准偏差。
1.2.5 SDS-PAGE确认玉米醇溶蛋白与氨基葡萄糖发生交联反应
SDS-PAGE和考马斯亮蓝蛋白质染色参照郭尧君[19]、Laemmli[20]等的方法。糖蛋白染色和脱色参照Zacharius等[21]的方法。标准蛋白如下:磷酸酶b(97.4 kD)、牛血清白蛋白(66.2 kD)、卵白蛋白(43.0 kD)、碳酸苷酶(31.0 kD)、胰蛋白酶抑制剂(20.1 kD)、溶菌酶(14.4 kD)。辣根过氧化物酶(糖蛋白)作为阳性对照,玉米醇溶蛋白作为阴性对照。通过考马斯亮蓝蛋白染色显示玉米醇溶蛋白与GAH发生糖基化反应后分子质量变化情况;通过PAS染色法,即过碘酸雪夫染色法检测玉米醇溶蛋白糖基化修饰产物中糖基的存在,以辣根过氧化物酶为阳性对照品,确认糖蛋白。
1.2.5.1 电泳实验
配制3 g/L的蛋白溶液,取100 μL于1.0 mL离心管中,与样品缓冲溶液1∶1混合,10 000 r/min离心5 min,取上清液沸水浴中煮沸5 min后冷却备用。进样量每孔10 μL。分离胶和浓缩胶质量分数分别为12%和3%,并分别设定电压为120 V和80 V时进行电泳。
1.2.5.2 蛋白质染色和脱色
用蛋白质固定液(甲醇、冰乙酸、水体积比为2∶1∶7)固定胶片1 h后,将胶片放入蛋白质染色液中(含0.25%考马斯亮蓝R-250、45%甲醇、10%冰乙酸)染色6 h左右,然后用脱色液(甲醇、冰乙酸、水体积比为1∶1∶8)进行脱色,更换脱色液直至条带清晰、背景颜色完全褪去为止。
1.2.5.3 糖蛋白染色和脱色
用糖蛋白固定液(12.5%三氯乙酸)固定胶片15 min,双蒸水洗2 次。1%高碘酸处理15 min,振荡水洗5 min,3 次。胶片浸于希夫试剂(Schiff试剂),室温避光染色30 min。染色结束倒去染色液,用0.5%偏重亚硫酸钠洗脱液振荡水洗5 min,5 次。利用凝胶成像系统分析蛋白质染色成像和糖染色成像。在两块胶中对应位置同时被染色的物质就是糖蛋白。
1.2.6 样品溶解性的测定
1.2.6.1 样品制备
按照1.2.3节所示方法,最适条件制备玉米醇溶蛋白修饰样品,透析后调pH值为7.0,样品冻干,备用。不加GAH,其他条件相同,制备对照品1:玉米醇溶蛋白交联样品。对照品2:玉米醇溶蛋白,复溶后,调pH 7.0,冻干备用。
1.2.6.2 溶解性测定
准确称量0.060 0g(蛋白干基)样品及对照品,加入10 mL pH 2~12的缓冲溶液,漩涡混匀30 s,置于4 ℃过夜使其充分水合,8 000×g、4 ℃离心10 min,转出上清液,利用紫外分光光度计测定其上清液在280 nm波长处的吸光度(水调零)。
2 结果与分析
2.1 理化指标测定结果
经测定,玉米醇溶蛋白中总蛋白含量为90.41%;GAH中糖含量为96.28%;玉米醇溶蛋白、GAH中水分含量分别为5.13%、0.18%;TGase比活力为1.05×103U/g。
2.2 底物质量浓度对玉米醇溶蛋白糖基化反应的影响
在TGase添加量60 U/g、酰基供受体物质的量比1∶6添加GAH、初始pH 7.5、温度37 ℃、反应时间8 h条件下,探索不同的底物质量浓度3、4、5、6 g/100 mL对玉米醇溶蛋白与GAH糖基化反应的影响,结果如图1所示。
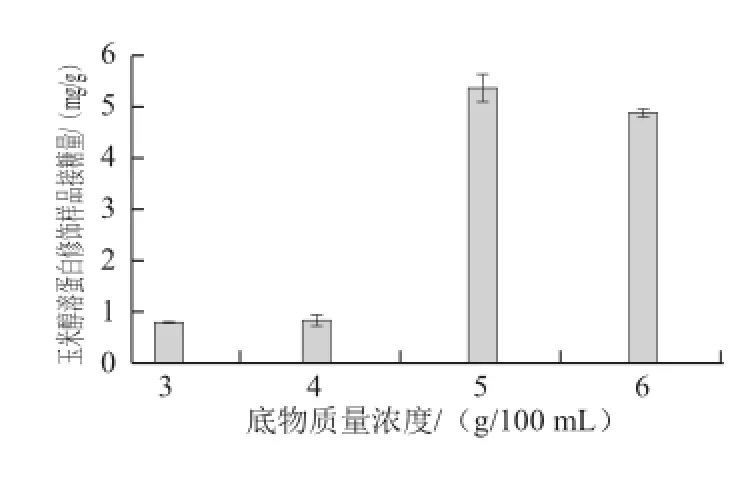
图1 玉米醇溶蛋白修饰样品接糖量随底物质量浓度变化情况Fig.1 Relationship between the amount of GAH conjugated onto zein and substrate concentration
由图1可见,随底物质量浓度升高,玉米醇溶蛋白中糖基导入量呈现先增加后减少的趋势,5 g/100 mL时达到最大值,为5.37 mg/g。可能的原因为,相同反应体系下,一定程度内底物质量浓度越高,TGase的作用位点越多,催化速率加快,玉米醇溶蛋白中GAH导入量越大。TGase还可以催化蛋白质形成自交联,底物质量浓度过高时,玉米醇溶蛋白分子自交联的程度也增大,所产生的空间位阻较大,阻碍了糖基的导入。Yan[22]等报道了大分子的寡糖糖基导入蛋白分子中会影响相邻位点上糖基的导入,这与分子的空间位阻增大有关。
2.3 TGase添加量对玉米醇溶蛋白糖基化反应的影响
底物质量浓度5 g/100 mL时,探索不同的TGase添加量(40、50、60、70 U/g)对玉米醇溶蛋白与GAH糖基化反应的影响,结果如图2所示。

图2 玉米醇溶蛋白修饰样品接糖量随TGase添加量变化情况Fig.2 Relationship between the amounts of GAH conjugated onto zein and TGase dosage
由图2可见,随TGase添加量升高,玉米醇溶蛋白中糖基导入量呈现先增加后减少的趋势,50 U/g时达到最大值,为5.48 mg/g。根据酶促反应动力学相关知识,当反应体系中底物质量浓度足够大时,最大反应速度与酶浓度成正比。由米氏方程可知,当底物质量浓度一定时,酶促反应速度正比于最大反应速率。因此,底物质量浓度一定时,酶促反应速率与酶浓度成正比。但当TGase添加量过高时,加大了玉米醇溶蛋白分子自交联的程度,较大的空间位阻阻碍糖基的导入。因此,TGase的浓度不宜过高。
2.4 GAH添加量对玉米醇溶蛋白糖基化反应的影响
TGase添加量50 U/g时,探索不同的GAH添加量(酰基供受体物质的量比1∶5、1∶6、1∶7)对玉米醇溶蛋白与GAH糖基化反应的影响,结果如图3所示。

图3 玉米醇溶蛋白修饰样品接糖量随酰基供受体物质的量比变化情况Fig.3 Relationship between the amount of GAH conjugated onto zein and GAH concentration
由图3可见,随GAH添加量升高,玉米醇溶蛋白中糖基导入量呈现先增加后减少的趋势,当酰基供受体物质的量比1∶6时达到最大值,为9.17 mg/g。可能的原因为,当GAH添加量较少时,玉米醇溶蛋白与GAH分子间有效碰撞几率较小,导致糖基化反应发生的几率较小。但GAH添加量过高易形成高黏度的糖溶液,阻碍体系中分子的扩散,不利于反应的进行。李志锐等[23]等研究了不同浓度的葡萄糖溶液对玉米醇溶蛋白黏度的影响,发现葡萄糖浓度越高,玉米醇溶蛋白的黏度越大。
2.5 初始pH值对玉米醇溶蛋白糖基化反应的影响
酰基供受体物质的量比1∶6时,探索不同的初始pH值(6.5、7.0、7.5、8.0、8.5)对玉米醇溶蛋白与GAH糖基化反应的影响,结果如图4所示。

图4 玉米醇溶蛋白修饰样品接糖量随初始pH值变化情况Fig.4 Relationship between the amount of GAH conjugated onto zein and initial reaction pH
由图4可见,随初始pH值升高,玉米醇溶蛋白中糖基导入量呈现先增加后减少的趋势,当初始pH值为8.0时达到最大值,为10.58 mg/g。可能的原因为,玉米醇溶蛋白的等电点为pH 6.0左右,在pH6.5~8.5范围内,玉米醇溶蛋白的溶解性随pH值增大而增大,体系中可溶性玉米醇溶蛋白的浓度升高,GAH可接触的谷氨酰胺位点增多,使得玉米醇溶蛋白中糖基的导入量增加。反应pH值是影响酶活力的一个重要因素,TGase最适pH值为6.0,在pH 5.0~8.0之间也有较高的活性。但pH 6.0为玉米醇溶蛋白的等电点,不利于反应进行。pH 6.5~8.0时,TGase的比活力相对较稳定,pH 8.0时为1006 U/g,稍低于pH 6.0。当反应初始pH值为8.5时,TGase的活性降低为988 U/g。从而,相同的反应时间内,TGase催化玉米醇溶蛋白中GAH的导入量减少。
2.6 反应温度对玉米醇溶蛋白糖基化反应的影响
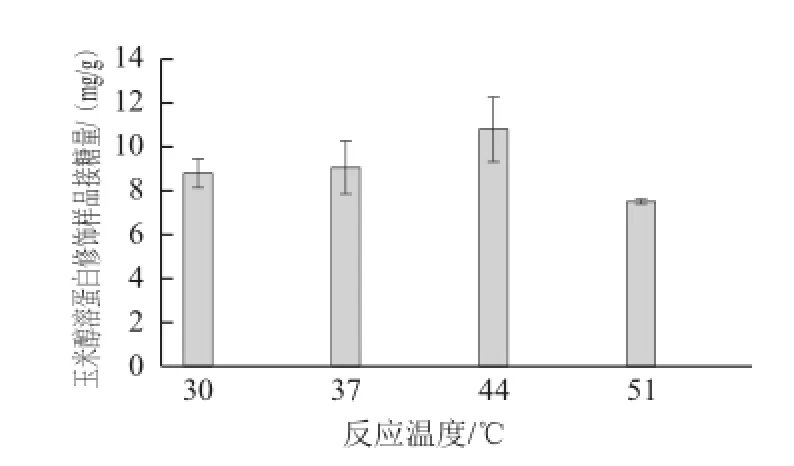
图5 玉米醇溶蛋白修饰样品接糖量随反应温度变化情况Fig.5 Relationship between the amount of GAH conjugated onto zein and reaction temperature
当初始pH值8.0时,探索不同的反应温度(30、37、44、51 ℃)对玉米醇溶蛋白与GAH糖基化反应的影响,结果如图5所示。由图5可见,随着反应温度升高,玉米醇溶蛋白中糖基导入量呈现先增加后减少的趋势,当反应温度为44 ℃时达到最大值,为10.79 mg/g。TGase的最适反应温度为50 ℃左右,在40~55 ℃范围内都有较高活性。一定范围内,随着反应温度的升高,TGase活性增强,有利于糖基化反应进行,同时,TGase催化的糖基化反应的竞争性反应脱酰胺作用也加剧。所以,反应温度不宜过高。
2.7 反应时间对玉米醇溶蛋白糖基化反应的影响

图6 玉米醇溶蛋白修饰样品接糖量随反应时间变化关系Fig.6 Relationship between the amount of GAH conjugated onto zein and reaction time
当反应温度44 ℃时,探索不同的反应时间(5、6、7、8 h)对玉米醇溶蛋白与氨基葡萄糖糖基化反应的影响,结果如图6所示。
由图6可见,随着反应时间延长,玉米醇溶蛋白中糖基导入量呈现先增加后减少的趋势,当反应时间为7 h时达到最大值,为11.34 mg/g。5~7 h期间,反应时间延长,玉米醇溶蛋白中GAH的导入量逐渐增多;反应时间继续延长到8 h,GAH的导入量下降。可能的原因为,在当前弱碱性反应条件下,生成的玉米醇溶蛋白糖基化修饰产物可能不稳定降解。同时,延长反应时间,TGase催化的玉米醇溶蛋白分子中谷氨酰胺残基的γ-酰胺基和自身或相邻玉米醇溶蛋白分子中的赖氨酸的ε-氨基发生酰基转移反应,形成ε-(γ-谷酰胺)-赖氨酸的异肽键,生成蛋白-蛋白交联的大分子,此蛋白大分子空间位阻增大,不利于糖基的导入。
2.8 玉米醇溶蛋白与GAH糖基化反应产物的SDS-PAGE
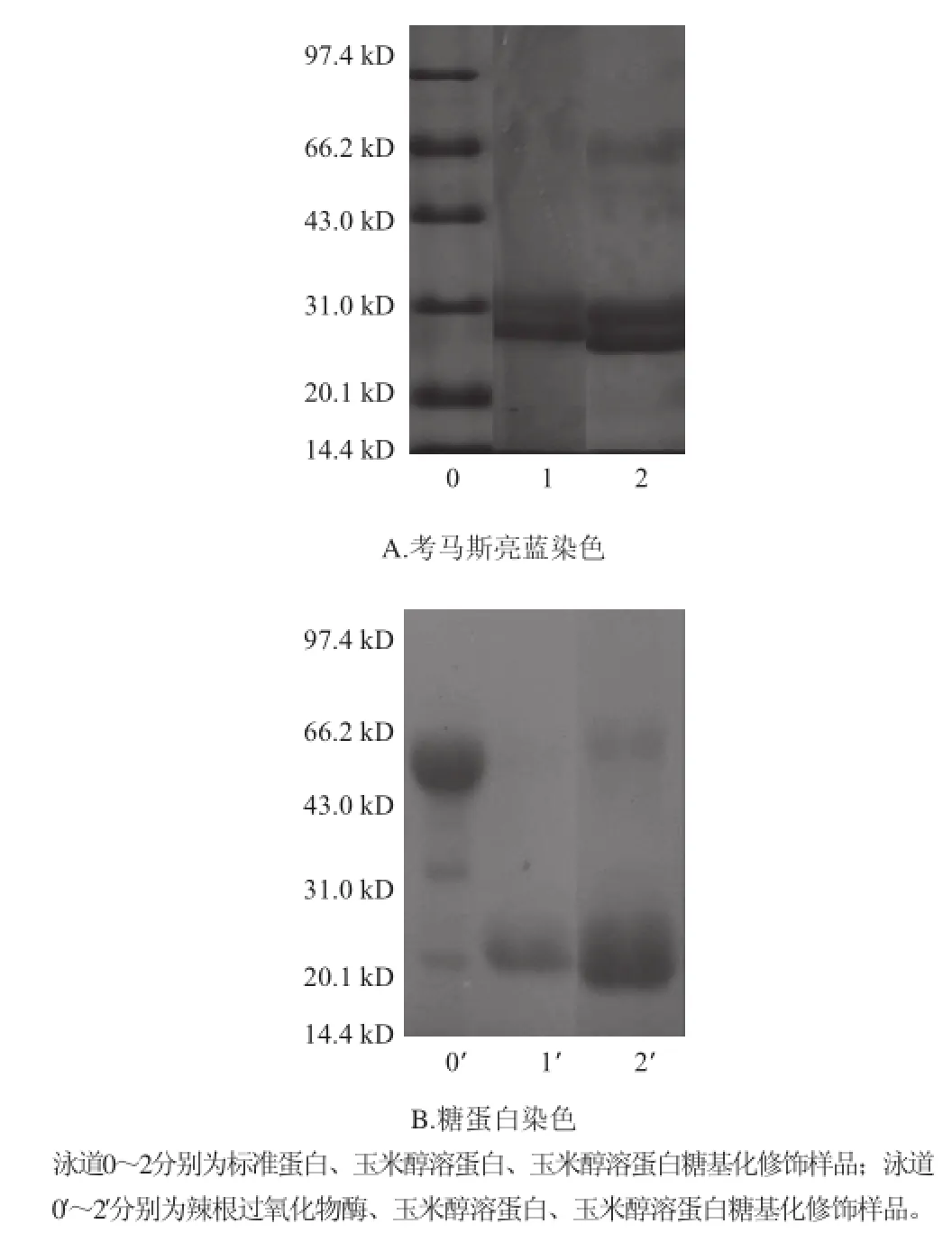
图7 玉米醇溶蛋白糖基化修饰样品的SDS-PAGE电泳图谱Fig.7 Electrophoretic profiles of modified zein
如图7所示,蛋白染色与玉米醇溶蛋白(泳道1)相比,糖基化的玉米醇溶蛋白(泳道2)中分子质量60 kD左右多了条带,这可能是由于GAH接枝到玉米醇溶蛋白分子中而形成的大分子。经糖蛋白染色(PAS法)后确定此条带处含有糖基。与玉米醇溶蛋白相比,糖基化修饰后的玉米醇溶蛋白的两个亚基发生明显的变化:蛋白染色中亚基颜色加深(A图中泳道2),这可能是由于糖基的导入,使得玉米醇溶蛋白的溶解性增加;糖蛋白染色中亚基颜色加深(B图中泳道2’),证明玉米醇溶蛋白的两个亚基中也含有糖基,再一次证实了GAH导入了玉米醇溶蛋白分子中。
2.9 糖基化玉米醇溶蛋白的溶解性

图8 玉米醇溶蛋白样品的溶解性Fig.8 Solubility of zein samples
由图8可以看出,与玉米醇溶蛋白相比,玉米醇溶蛋白交联样品和糖基化修饰样品的溶解性均升高。在测定的所有pH值范围内,玉米醇溶蛋白修饰样品的溶解性均最高,等电点处改善的最明显。可能是因为亲水性极强的糖基的导入,玉米醇溶蛋白的分子结构发生改变,增强了玉米醇溶蛋白与水分子之间的相互作用。这与姜淑娟等[24]的研究结果相一致。
TGase催化玉米醇溶蛋白交联后,等电点向酸性pH值偏移。可能的原因为,相比于玉米醇溶蛋白自身交联,TGase催化的另一种作用机制更为突出——脱氨作用、脱胺作用使得玉米醇溶蛋白中的谷氨酰胺残基与水分子结合,生成谷氨酸,暴露出羧基,放出NH3,使等电点改变,溶解度升高,这与Babiker[25]的研究结果一致。此外,玉米醇溶蛋白中赖氨酸含量极低,在TGase催化作用下,玉米醇溶蛋白分子内或间发生交联作用较弱。
3 结 论
SDS-PAGE法证实了GAH接枝到了玉米醇溶蛋白分子中。确定的玉米醇溶蛋白与GAH最适糖基化反应条件为:底物质量浓度5 g/100 mL、TGase添加量50 U/g、玉米醇溶蛋白中酰基供体与GAH中酰基受体物质的量比1∶6、初始pH 8.0、反应温度44 ℃、反应时间7 h。该条件下,玉米醇溶蛋白中GAH最大接入量为(11.34±0.21)mg/g。
与玉米醇溶蛋白相比,TGase催化玉米醇溶蛋白交联样品及玉米醇溶蛋白糖基化修饰样品的溶解性均得到较大提高;且在所有pH值范围内,玉米醇溶蛋白糖基化修饰样品的溶解性最高。
[1] POMES A F. Zein[J]. Encyclopedia of Polymer Science and Technology, 1971, 15: 125-132.
[2] 周菲菲, 肖更生, 唐道邦, 等. 食品加工中蛋白质的糖基化改性[J].食品工业科技, 2013, 34(21): 390-393.
[3] 卢家成, 孙泽威, 李婷琳. 糖基化反应改善大豆抗原蛋白功能特性的研究进展[J]. 大豆科学, 2012(3): 483-486.
[4] 王军, 侯丙凯. 植物小分子化合物的糖基化与糖基转移酶[J]. 植物生理学通讯, 2008, 44(5): 997-1003.
[5] 冯世江, 李春, 曹竹安. 糖苷酶及其在糖基化合物改性中的研究[J].生物加工过程, 2006, 4(3): 16-21.
[6] GOTTARDI D, HONG P K, NDAGIJIMANA M, et al. Conjugation of gluten hydrolysates with glucosamine at mild temperatures enhances antioxidant and antimicrobial properties[J]. LWT-Food Science and Technology, 2014, 57(1): 181-187.
[7] HRYNETS Y, NDAGIJIMANA M, BETTI M. Transglutaminasecatalyzed glycosylation of natural actomyosin (NAM) using glucosamine as amine donor: functionality and gel microstructure[J]. Food Hydrocolloids, 2014, 36: 26-36.
[8] VILLALONGA R, FERNÁNDEZ M, FRAGOSO A, et al. Transglutaminase-catalyzed synthesis of trypsin-cyclodextrin conjugates: kinetics and stability properties[J]. Biotechnology and Bioengineering, 2003, 81(6): 732-737.
[9] JIANG Shujuan, ZHAO Xinhuai. Transglutaminase-induced crosslinking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products[J]. European Food Research and Technology, 2010, 231(5): 679-689.
[10] JIANG Shujuan, ZHAO Xinhuai. Transglutaminase-induced crosslinking and glucosamine conjugation of casein and some functional properties of the modified product[J]. International Dairy Journal, 2011, 21(4): 198-205.
[11] 袁怀波, 刘国庆, 陈宗道. 磷酸化改性玉米蛋白的性质[J]. 食品科学, 2007, 28(10): 50-52.
[12] 赵国华, 王光慈, 陈宗道, 等. 改性对玉米蛋白功能性质及结构的影响(Ⅱ)酰化[J]. 中国粮油学报, 2000, 15(4): 14-17.
[13] ZHANG B, LUO Y C, WANG Q. Effect of acid base treatments on structural rheological, and antioxidant properties of α-zein[J]. Food Chemistry, 2011, 124: 210-220.
[14] ISKENDER A, AHMET Y. Incorporating phenolic compounds opens a new perspective to zein films as flexible bioactive packaging materials[J]. Food Research International, 2011, 44: 550-556.
[15] GHANBARZADEH B, OROMIEHIE A R, MUSAVI M. Effect of plasticizing sugars on rheologocal and thermal properties of zein resins and mechanical properties of zein films[J]. Food Research International, 2006, 39(8): 882-890.
[16] 尹天罡, 何余堂, 解玉梅, 等. 玉米醇溶蛋白改性及食品中应用研究进展[J]. 食品工业科技, 2014, 35(9): 377-380.
[17] 郑喜群. 玉米黄粉的酶解工艺与抗氧化活性肽的制备[D]. 北京: 中国农业大学, 2006.
[18] FOLK J E, COLE P W. Structural requirements of specific substrates for guinea pig liver transglutaminase[J]. The Journal of Biological Chemistry, 1965, 240: 2951-2960.
[19] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 1999.
[20] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophageT4[J]. Nature, 1970, 227: 680-685.
[21] ZACHARIUS R M, ZELL T E, MORRISON J H, et al. Glycoprotein staining following electrophoresis on acrylamide gels[J]. Analytical Biochemistry, 1969, 30(1): 148-152.
[22] YAN S C B, WOLD F. Neoglycoproteins: in vitro introduction of glycosyl units at glutamines in β-casein using transglutaminase[J]. Biochemistry, 1984, 23(16): 3759-3765.
[23] 李志锐, 刘波, 张兰, 等. 玉米醇溶蛋白功能性质的研究[J]. 中国酿造, 2009, 27(5): 28-31.
[24] 姜淑娟, 赵新淮. 酪蛋白的转谷氨酰胺酶氨基葡萄糖修饰与功能性变化[J]. 中国乳品工业, 2010, 38(9): 8-11.
[25] BABIKER E E. Effect of transglutaminase treatment on the functional properties of native and chymotrypsin-digested soy protein[J]. Food Chemistry, 2000, 70(2): 139-145.
TGase-Catalyzed Glycosylation of Zein
ZHOU Li-min, LIU Xiao-lan, LIU Yue, ZHENG Xi-qun*
(Key Constructive Laboratory of Processing Agricultural Products of Heilongjiang Province Normal University, College of Food and Biological Engineering, Qiqihar University, Qiqihar 161006, China)
In the present work, transglutaminase (TGase) was used to catalyze covalent cross-linking reaction between zein and glucosamine hydrochloride (GAH). The cross-linking reaction was identified by SDS-PAGE. The reaction conditions were optimized based on the amount of GAH conjugated onto zein. Meanwhile, the solubility of zein modified by glycosylation was characterized. The results showed that the optimized reaction conditions for TGase/zein concentration, zein ratio molar ratio of acyl donor to acceptor, initial reaction pH, temperature and reaction time were 5 g/100 mL, 50 U/g, 1:6, 8.0, 44 ℃ and 7 h respectively. Under these conditions, the amount of GAH conjugated onto zein was (11.34 ± 0.21) mg/g zein. Compared with intact zein, the solubility of both cross-linked zein and glycosylated zein was improved, and glycosylation resulted in the highest solubility.
zein; transglutaminase (TGase); glycosylation; protein modification
Q814.9
A
1002-6630(2014)24-0015-05
10.7506/spkx1002-6630-201424003
2014-08-18
国家自然科学基金面上项目(31371726)
周利敏(1989—),女,硕士研究生,研究方向为玉米综合加工技术与转化。E-mail:zhoulimin19890111@163.com*
郑喜群(1963—),男,教授,博士,研究方向为玉米综合加工技术与转化。E-mail:zhengxiqun@126.com

