不同树种纯林对土壤生物学特性的影响1)
康 颖 李 聪 王秋玉
(东北林业大学,哈尔滨,150040)
无论是自然生态系统还是森林生态系统,土壤生态系统都是其重要组成部分。在土壤生态系统中微生物通过分解动植物残体为土壤生态系统提供养分[1-4],参与森林生态系统的物质循环和能量流动。作为土壤中生物活性的体现[5-6],土壤微生物能灵敏的反应出土壤质量变化。在土壤有机质的积累、转化以及土壤养分循环过程中[7],土壤酶也同样发挥着重要作用。因此,土壤微生物数量和土壤酶活性常作为评价森林生态系统土壤肥力和熟化程度的重要指标。郑诗樟等[8]研究表明,在丘陵红壤植被恢复过程中,植树造林可增加土壤微生物类群和土壤酶活性,改善土壤理化性质,从而进一步改善土壤肥力;梅杰等[9]研究发现,不同林龄马尾松(Pinus massoniana)林根际和非根际土壤酶活性,随着林龄的增加呈现“低—高—低”的变化趋势,而土壤微生物数量则呈现相反的趋势;杨鲁等[10]研究表明,采伐干扰残留物可增加巨桉(Eucalyptus grandis)人工林的土壤微生物数量,增强土壤酶活性,加速养分循环,改善林地水热条件;胡婵娟等[11]研究发现,黄土丘陵沟壑地区的刺槐(Robinia pseudoacacia)、沙棘(Hippophae reamnoides)、杏树(Prunus armeniaca)人工林恢复初期林下土壤微生物比土壤理化性质变化敏感,且不同树种间存在显著差异。
本研究以黑龙江省东北林业大学哈尔滨实验林场中的7 个树种的人工纯林为研究对象。通过对各人工林下土壤微生物数量、土壤酶活性、土壤酸碱度以及相对含水量进行检测,探讨不同纯林下土壤质量的差异。为今后在城市有限的土地上构建一个植物群落比例合理、生态功能完备、收益显著的城市森林生态系统提供基础数据。
1 研究地概况
本研究地点为东北林业大学哈尔滨实验林场,位于黑龙江省南部的哈尔滨市中心(44°04' ~46°40'N,125°42' ~130°10'E),地处哈尔滨市的松花江三级阶地的第二阶地上,地势略有起伏,海拔136 ~140 m,区域面积48.83 hm2,土壤类型为黑土[12],土层深厚,土质肥沃。该地属中温带大陆性季风气候,冬长夏短,四季分明,雨水充沛。年平均气温3.6℃,年平均降水量569.1 mm。春季气温回升快而且变化无常,气温月际变化强烈。夏季气候温热湿润多雨,气温月际差异很小,7月份最高气温达38 ℃,平均降水量占全年的60% ~70%。秋季降雨明显减少,昼夜温差变幅较大。冬季漫长而寒冷干燥,1月最低气温曾达-37.7 ℃。
该林场始建于20 世纪50年代,种植了东北林区十几个主要造林树种,包括兴安落叶松(Larix gmelinii(Rupr.)Rupr.)、樟子松(Pinus sylvestris var.mongolica Litv.)、黑皮油松(Pinus tabulaeformis var.mukdensis)、白桦(Betula platyphylla Suk.)、胡桃楸(Juglans mandshurica Maxim.)、水曲柳(Fraxinus mandshurica Rupr.)、黄檗(Phellodendron amurense Rupr.)等,每个样地面积为0.5 hm2,现树龄均在50 ~60 a,树高10.5 ~20.6 m,胸径17.1 ~32.1 cm,林分密度在720 ~1 470 株·hm-2,活立木蓄积量在94.1 ~158.4 m3·hm-2[13]。目前为止林地常规的管护经营良好,林木茂盛,已具备森林景观特征。
2 研究方法
2.1 土样采集
2012年8月在东北林业大学实验林场选取7块人工纯林样地,即:兴安落叶松林、樟子松林、黑皮油松林、白桦林、胡桃楸林、水曲柳林、黄檗林。每块样地随机设置3 个5 m×5 m 样方,每个样方按对角线法取5 个样点,采集0 ~20 cm 土层的土样。将每块样地采集15 个样点,每5 个样点的土壤混合均匀得到3 个平行样,过2 mm 筛。样品带回实验室后,进行风干处理的用于转化酶、脲酶、多酚氧化酶活性以及土壤pH 值的测定,4 ℃保存的土样用于土壤相对含水量、磷酸酶活性、FDA 水解酶活性测定以及微生物分离计数。土样编号XAL、ZZS、HP、BH、HTQ、SQL、HB 分别代表兴安落叶松林、樟子松林、黑皮油松林、白桦林、胡桃楸林、水曲柳林以及黄檗林。
2.2 土壤相对含水量、pH 值、酶活性的测定
土壤相对含水量采用称重法,pH 值采用电位法测定[14]。转化酶(又称蔗糖酶)活性采用3,5-二硝基水杨酸比色法,脲酶活性采用苯酚-次氯酸钠比色法,磷酸酶活性性采用磷酸苯二钠比色法,多酚氧化酶活性性采用邻苯三酚比色法,FDA 水解酶活性采用荧光素二乙酸比色法测定[15]。
2.3 土壤微生物的分离计数
土壤微生物的分离计数采用稀释平板计数法[16]。细菌用牛肉膏蛋白胨培养基,接种时选用0.1 mL 10-4~10-6稀释度的土壤悬液,37 ℃培养观察2 ~4 d。真菌用改良马丁培养基进行选择培养,使用前每升培养基加入3 mL 质量浓度为10 g/L 链霉素,接种时选用0.2 mL 10-1~10-3稀释度的土壤悬液,28 ℃培养观察3 ~5 d。放线菌用高氏1 号培养基,使用前每升培养基加入3 mL 质量浓度为30 g/L 重铬酸钾,接种时选用0.2 mL 10-3~10-5稀释度的土壤悬液,28 ℃培养观察5 ~7 d。
2.4 数据处理
采用Microsoft Excel 2003 软件对数据进行处理和分析,用单因素方差分析和无重复双因素方差分析法评价差异显著性(α =0.05)。用SPSS 16.0 对数据进行LSD 差异显著性分析、皮尔森相关性分析、主成分分析以及系统聚类分析。
3 结果与分析
3.1 不同林型土壤酸碱度和相对含水量
研究发现不同人工林地土壤的酸碱度和相对含水量存在显著差异(表1)。供试土壤pH 值4.6 ~7.3,3 种针叶林的土壤pH 值4.6 ~5.8,4 种阔叶林的土壤pH 值5.0 ~7.3。除水曲柳林为中性土,胡桃楸林为碱性土外,其它均为酸性土壤。方差分析显示,7 种林型间土壤酸碱度差异极显著,F =4 695.04(P <0.001)。同时,针叶林间和阔叶林间差异均为极显著,F 值分别为1 494.46、6 258.42(P <0.001)。土壤相对含水量总体水平较低,范围在4.11% ~5.5%,这与试验地范围内市民活动较频繁,林地涵养水分能力降低,以及采样季节温度较高,降雨量小有关。不同林型间土壤相对含水量差异极显著,F =48.6(P <0.001)。针叶林间相对含水量差异不显著,F=1.108(P >0.05);阔叶林间土壤相对含水量差异极显著,F=96.02(P <0.001)。
3.2 不同林型间土壤酶活性
土壤转化酶、脲酶、磷酸酶以及FDA 水解酶均为土壤中的水解酶类,这些水解酶主要来自于微生物细胞,是土壤新陈代谢的重要物质。转化酶的活性强度表征了土壤的熟化程度和肥力水平;土壤脲酶的活性常用来表征土壤氮素情况;土壤磷酸酶活性可以表征土壤的磷素状况。这三种水解酶活性均能反映出土壤熟化程度和土壤肥力水平[17],且酶活性与土壤熟化程度、肥力水平呈正相关。方差分析表明,7 种纯林的土壤转化酶、脲酶和磷酸酶活性差异极显著(P <0.01);3 种酶不论在针叶林间,还是阔叶林间均存在极显著差异,(P <0.01)。与针叶树相比,阔叶树的影响更显著。
FDA 水解酶可以将来源于土壤微生物细胞的荧光素二乙酸水解,FDA 水解酶的活性越高表明土壤微生物总体活性越强。本研究中不同林型间FDA 水解酶的活性差异极显著,F =234.28(P <0.001)。阔叶林间差异极显著,F =690.74(P <0.001);针叶林间差异不及阔叶林显著,但也达到显著水平,F=6.24(P <0.05)。表明不同树种组成对土壤微生物活性产生了显著影响,且阔叶树种影响更显著。
土壤多酚氧化酶是一类分布最广的土壤氧化还原酶。在土壤中,芳香族有机化合物转化为腐殖质的过程中起着重要作用[15]。多酚氧化酶的活性与土壤腐殖化程度呈显著负相关,能在一定程度上反映出土壤腐殖化程度。研究表明,不同林种间土壤多酚氧化酶活性存在显著差异,F =205.26(P <0.001);针、阔叶林间存在显著差异(P <0.001),表明了不同树种的长期种植对其土壤腐殖化程度有显著影响(见表2)。
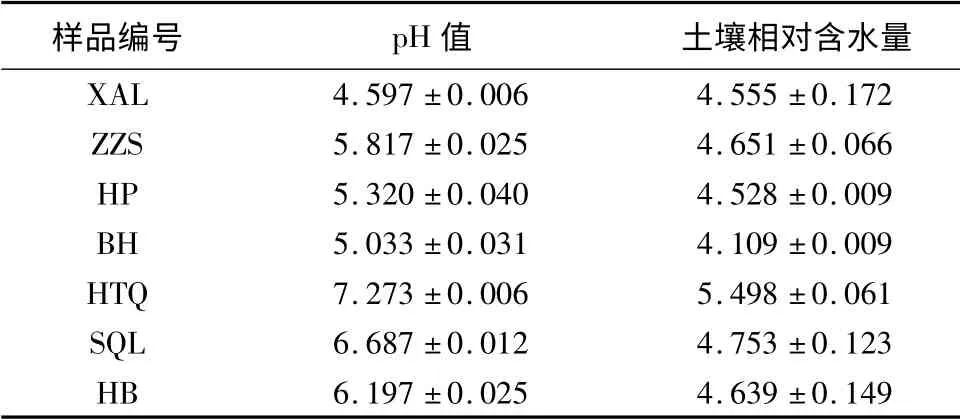
表1 不同人工林型下的土壤酸碱度和相对含水量
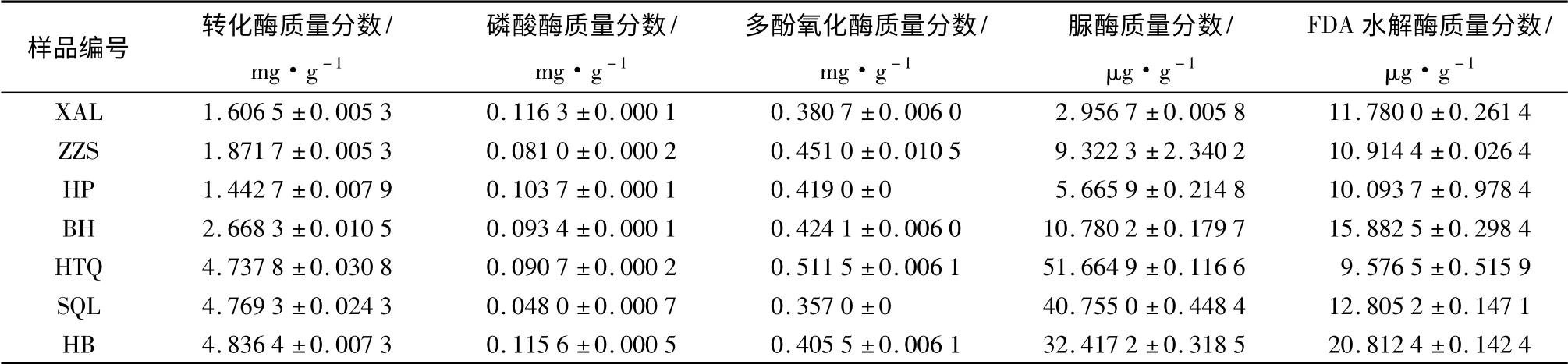
表2 不同人工林型下的土壤酶活性
3.3 不同林型间土壤微生物数量
由表3可见,3 种微生物数量中细菌数量显著高于放线菌和真菌,真菌数量最低。而7 种林型中,黄檗林放线菌和真菌数量最高,白桦林的细菌数量显著高于其它林型。方差分析显示,不同林型间土壤微生物数量差异极显著(P <0.01)。阔叶林间微生物数量差异显著,细菌、放线菌和真菌数量的F值分别20.39(P <0.001),9.95(P <0.01),5.94(P<0.05);而针叶林间仅放线菌数量差异达到极显著水平,F=37.14(P <0.001)。表明树种的选择对土壤微生物群落产生显著影响,并且阔叶林比针叶林对土壤微生物菌落的数量影响显著。
3.4 土壤生物因子间的相关性
本研究分别对针叶林和阔叶林进行了土壤生物学指标间的相关分析(表4)。结果表明:不同林型间微生物数量、土壤酶活性、土壤酸碱度以及相对含水量等影响因子间存在不同程度的相关性。放线菌数量与转化酶活性在针叶林和阔叶林中均存在显著正相关性;而细菌数量与转化酶活性、真菌数量与脲酶活性在针叶林中呈显著正相关,但在阔叶林中却表现为显著负相关;真菌数量与磷酸酶活性在针叶林中呈显著负相关,在阔叶林中表现为显著正相关。由此可见,针阔叶林的树种组成对其土壤微生物数量和土壤酶活性存在不同的影响。
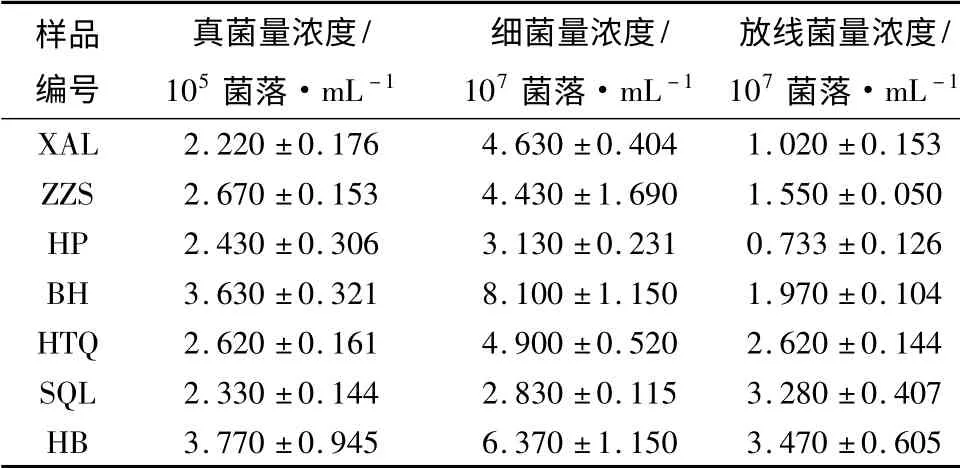
表3 不同人工林型下的土壤微生物数量
另外,不论是针叶林还是阔叶林,土壤酸碱度与土壤脲酶活性均呈现极显著正相关,但与土壤真菌数量却有着截然相反的显著影响。因此,土壤酸碱度不同,可直接影响土壤微生物种类和土壤酶活性。
针叶林中土壤pH 值、相对含水量和土壤真菌的数量与多酚氧化酶活性存在显著正相关。也就是说,土壤真菌数量越多,土壤多酚氧化酶活性越高,这也与较高的土壤酸碱度和相对含水量密切相关。
FDA 水解酶活性在针叶林中与土壤细菌数量极显著正相关,在阔叶林中与土壤真菌数量间呈极显著正相关性。由此可见,不同树种林型对土壤微生物的种类和活性呈现不同的影响。
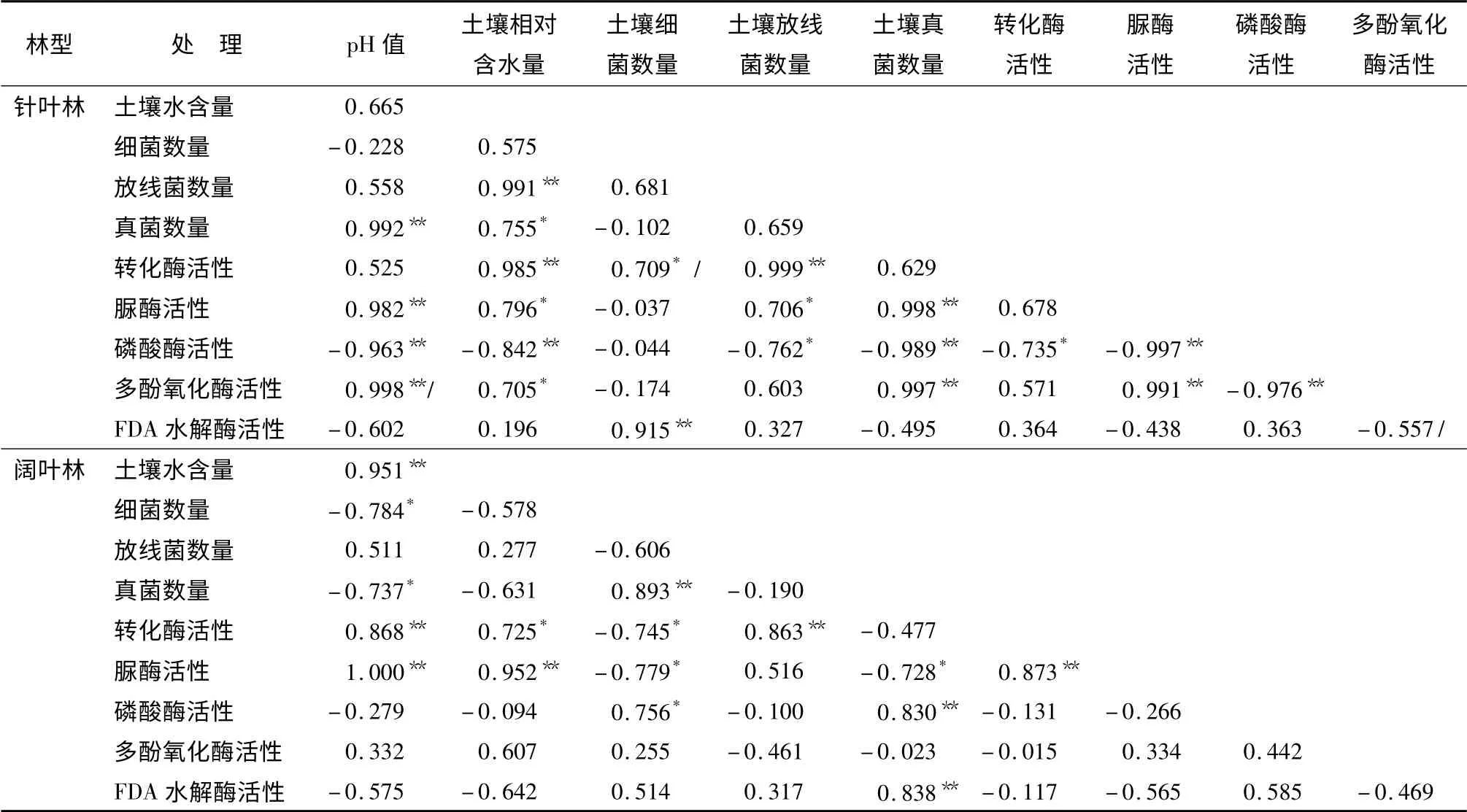
表4 针叶林/阔叶林土壤质量影响因子的皮尔森相关性
3.5 不同林型土壤生物因子的主分量与聚类分析
主分量分析表明,本研究中前3 个主分量贡献率分别为44.1%,31.9%,15.9%,累计贡献率已达到91.9%,表明前三个主分量在林地土壤质量评价中更具有代表性,因此,选取前3 个主分量作为评价不同林型对土壤质量影响的综合指标(表5)。结合表5可知,对第1 主分量影响较大的变量有转化酶、脲酶活性、放线菌数量和土壤酸碱度这4 个变量因素。其中,转化酶和脲酶活性的因子负荷量最大,它们能表征土壤熟化程度和土壤肥力水平,说明土壤熟化程度和土壤肥力水平在评价不同林型对土壤质量影响因素中占首要地位。在影响第2 主分量的变量中因子负荷量最大的是真菌数量和细菌数量,土壤微生物数量是土壤微生物活性指标之一,表明土壤微生物活性在评价不同林型对土壤质量影响因素中居第2 位。而在影响第3 主分量的变量中多酚氧化酶活性的因子负荷量最大,多酚氧化酶活性能在一定程度上反应出土壤腐殖化程度,说明土壤腐殖化程度在评价不同林型对林地土壤质量影响因素中居第3 位。
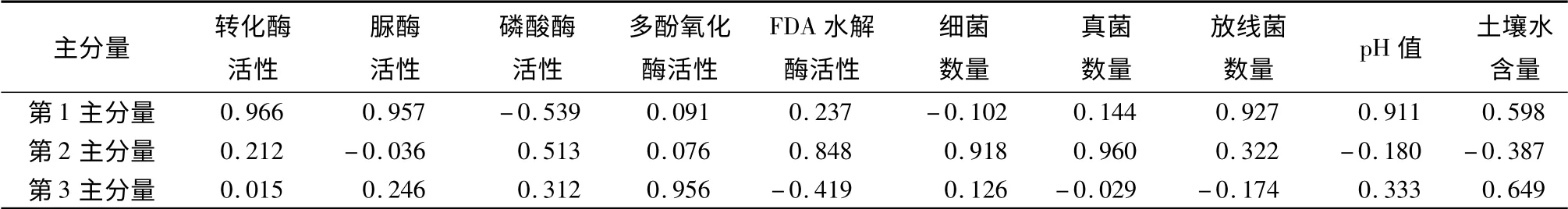
表5 前3 个主分量的负荷量
根据表5和图1可以看出,阔叶林整体土壤熟化程度和土壤肥力水平比针叶林高。7 种人工林中,胡桃楸林、水曲柳林因其较高的土壤水解酶活性表现出较好的土壤熟化程度和土壤肥力水平,兴安落叶松林、黑皮油松林的土壤熟化程度和土壤肥力水平较差;黄檗林和白桦林的土壤微生物活性较高,水曲柳林的土壤微生物活性最低;水曲柳林的土壤腐殖化程度最高,胡桃楸林的土壤腐殖化程度最低。系统聚类结果与主成分分析结果一致,由图1和图2可以看出7 种人工纯林明显聚为3 大类,针叶林先聚为一类,白桦林和黄檗林聚为一类,胡桃楸林和水曲柳林聚为一类。
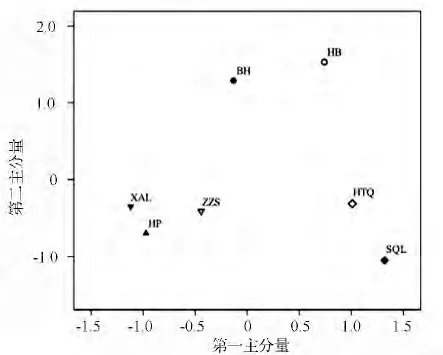
图1 第1、第2 主分量得分散点图

图2 不同人工林的系统聚类树状图
4 讨论
总体来看阔叶人工林的土壤转化酶与脲酶活性均大于针叶人工林,特别是三大硬阔(黄檗、胡桃楸和水曲柳)林下土壤转化酶和脲酶活性明显高于其它人工林,表明了阔叶林的土壤熟化程度和肥力水平比针叶林高。凋落物是森林生态系统的重要物质库,是土壤有机质的重要来源,在森林植被演替过程中土壤微生物将其分解,转化成土壤有机质。林波等[18]指出针叶林与阔叶林凋落量存在差异,针叶林凋落物分解速率比阔叶林快。但针叶林大多为常绿树种,每年的凋落物总量大大少于阔叶林,落叶松也不例外。另外,针叶林叶凋落物的化学组成会影响针叶凋落物的降解[19]。
FDA 水解酶活性也在一定程度上反应了土壤微生物总体活性,FDA 水解酶活性越高,土壤微生物总体活性越强。1982年Schnürer 和Rosswall[20]提出将FDA 水解酶活性作为一项生物学指标来评价土壤微生物的总体活性。黄檗林和白桦林的FDA 水解酶活性高于其它林型,与微生物分离计数的结果一致。谭周进等[21]研究表明人类活动会使土壤微生物强度和活度降低。由于本研究中所选取的白桦林和黄檗林人类活动不频繁、干扰程度较低,林下植被覆盖情况较好,所以林下土壤微生物总体活性相对较高。
与黄檗和白桦这两种阔叶林不同,水曲柳林和胡桃楸林林下植被覆盖情况较差,这可能与两个树种的生物学特性有关。林武星等[22]指出水曲柳和胡桃楸等树种具有他感作用。孙墨珑等[23]研究表明胡桃楸外果皮提取物对植物青菜等的萌发和生长有抑制作用。杨期和等[24]指出黑胡桃(Juglans nigra)林下土壤中的假单胞菌能将化感物质糖甙胡桃醌分解成有毒的胡桃醌,从而影响林下土壤微生物的繁殖。水曲柳和胡桃楸的这种化感作用可能导致林下植被覆盖少,土壤微生物总活性减弱。一般情况下,阔叶林的土壤腐殖化程度高于针叶林,但本研究中胡桃楸林的多酚氧化酶活性最高,多酚氧化酶活性高代表土壤腐殖化程度低,这可能与胡桃楸林下土壤中含有大量化感物质有关。
本研究在对城市森林土壤质量影响因子进行皮尔森相关性分析时,发现在针叶林中土壤细菌数量与转化酶活性、真菌数量与脲酶活性都呈显著正相关,在阔叶林中却表现为显著负相关;真菌数量与磷酸酶活性在针叶林中呈显著负相关,在阔叶林中表现为显著正相关,这可能与不同林型下土壤理化性质不同。但究竟是什么因素主导着针叶林和阔叶林的土壤微生物数量与土壤酶活性之间这种截然相反的相关性差异,这种差异是必然还是偶然的结果,还需要大量的实验验证和进一步的研究分析。
[1] 高永健,袁玉欣,刘四维,等.不同林龄杨树人工林对土壤微生物状况和酶活性的影响[J].中国农学通报,2007,23(7):185-189.
[2] 顾峰雪,文启凯,潘伯荣,等.塔克拉玛干沙漠腹地人工植被下土壤微生物的初步研究[J].生物多样性,2000,8(3):297-303.
[3] 胡海波,张金池,高智慧,等.岩质海岸防护林土壤微生物数量及其与酶活性和理化性质的关系[J].林业科学研究,2001,15(1):88-95.
[4] 薛立,邝立刚,陈红跃,等.不同林分土壤养分、微生物与酶活性的研究[J].土壤学报,2003,40(2):280 ~285.
[5] Pascual J A,Garcia C,Hernandez T,et al.Soil microbial activity as a biomarker of degradation and remediation processes[J].Soil Biol Biochem,2000,32(13):1877-1883.
[6] Meril P,Strmmer R S,Fritze H.Soil microbial activity and community structure along a primary succession transect on the land 2 uplift coast in western Finland[J].Soil Biol Biochem,2002,34(11):1647-1654.
[7] 胡亚林,汪思龙,颜绍馗.杉木人工林取代天然次生阔叶林对土壤生物活性的影响[J].应用生态学报,2005,16(8):1411-1416.
[8] 郑诗樟,肖青亮,吴蔚东,等.丘陵红壤不同人工林型土壤微生物类群、酶活性与土壤理化性状关系的研究[J].中国生态农业学报,2008,16(1):57-61.
[9] 梅杰,周国英.不同林龄马尾松林根际与非根际土壤微生、酶活性及养分特征[J].中南林业科技大学学报,2011,31(4):46-49.
[10] 杨鲁,张健,倪彬,等.采伐干扰对巨桉人工林土壤养分和土壤酶活性的影响[J].四川农业大学学报,2008,26(2):154-157.
[11] 胡婵娟,傅伯杰,刘国华,等.黄土丘陵沟壑区典型人工林下土壤微生物功能多样性[J].生态学报,2009,29(2):727-733.
[12] 苏平,牟长城,张彩虹.哈尔滨城市人工林木本植物的多样性[J].东北林业大学学报,2007,35(5):32-35.
[13] 孙慧珍,陈明月,蔡春菊,祝宁.不同类型城市森林对土壤肥力的影响[J].生态学报,2009,20(12):2871-2876.
[14] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学教育出版社,2006.
[15] 李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学教育出版社,2008.
[16] 蔡信之,黄君红.微生物学实验[M].北京:科学出版社,2010.
[17] Gianfreda L,Sannino F,Violante A.Pesticide effects on the activity of free,immobilized and soil invertase[J].Soil Biology and Biochemistry,1995,27(9):1201-1208.
[18] 林波,刘庆,吴彦,等.森林凋落物研究进展[J].生态学杂志,2004,23(1):60-64.
[19] He X B,Song F Q,Zhang P,et al.Variation in litter decomposition-temperature relationships between coniferous and broadleaf forests in Huangshan Mountain,China[J].Journal of Forestry Research,2007,18(4):291-297.
[20] Doran J V,Coleman D C.Defining Soil Quality for a Sustainable Environment[M].Wisconsin:Soil Seience Society of America,1994.
[21] 谭周进,肖启明,杨海君,等.旅游对张家界国家森林公园土壤酶及微生物作用强度的影响[J].自然资源学报,2006,21(1):133-138.
[22] 林武星,洪伟,郑郁善,等.森林植物他感作用研究进展[J].中国生态农业学报,2005,13(2):43-46.
[23] 孙墨珑,宋湛谦,方桂珍.核桃楸外果皮提取物的化感作用及成分分析[J].林产化学与工业,2008,28(3):45-49.
[24] 杨期和,叶万辉,廖富林,等.植物化感物质对种子萌发的影响[J].生态学杂志,2005,24(12):1459-1465.

