缬沙坦通过下调X-盒结合蛋白1表达抑制糖尿病心肌病大鼠心肌细胞凋亡
吴婷婷,魏庆庆,严宇鹏,孙颖颖,李莉,胡罗文,马瑞,李欧,王冀
缬沙坦通过下调X-盒结合蛋白1表达抑制糖尿病心肌病大鼠心肌细胞凋亡
吴婷婷,魏庆庆,严宇鹏,孙颖颖,李莉,胡罗文,马瑞,李欧,王冀
目的:研究糖尿病心肌病(DCM)模型大鼠心肌组织中X-盒结合蛋白1(XBP1)与心肌细胞凋亡之间的联系,以及明确缬沙坦抑制心肌细胞凋亡的作用机制。
糖尿病心肌病;心肌细胞凋亡;X-盒结合蛋白1;缬沙坦
(Chinese Circulation Journal, 2014,29:836.)
糖尿病心肌病(DCM)病程中存在着显著增加的心肌细胞凋亡。内质网应激介导的细胞凋亡是一种新发现的细胞凋亡通路,而X盒结合蛋白1(XBP1)作为内质网应激的关键信号因子在这一过程中发挥着重要的调控作用[1-2]。DCM病程中,高血糖、氧化应激、钙稳态失衡等因素均可诱发内质网应激,进而导致心肌细胞的凋亡,本研究拟通过建立DCM大鼠模型并采用缬沙坦干预DCM大鼠,观察XBP1对心肌细胞凋亡的影响以及缬沙坦与XBP1表达水平之间的联系。
1 材料与方法
DCM动物模型的构建:2012-01至2012-08本研究选用清洁级雄性8周龄Wistar大鼠50只(购自山东大学实验动物中心),体重260~280 g,平均体重(260±18.6 )g,平均心率 (325±18.0)beats/min,空腹血糖的平均值(4.2±0.9 )mmol/L,平均收缩压(125±3.6)mmHg(1mmHg=0.13Pka)。50只大鼠标准大鼠饲料适应性喂养一周后,随机分为两部分:腹腔注射65 mg/kg柠檬酸盐缓冲液(PH 4.5)的大鼠对照组(n=10); 腹腔注射链脲佐菌素65 mg/kg大鼠(n=40)注射7天后,收集大鼠尾静脉血测空腹血糖,其中37只连续2次空腹血糖≥16.7mmol/L(300mg/dl)为DCM大鼠建模成功(3只未达成模标准者予以剔除) ②将存留的37只DCM大鼠随机分为2组: DCM大鼠给予生理盐水灌胃为DCM组(n=20), DCM大鼠给予缬沙坦30mg/kg.d灌胃的为DCM+缬沙坦组(n=17)。3组大鼠均再继续喂养16周后处死取材,剩余心肌细胞-80℃保存。
实验大鼠基本指标的监测:实验过程中除常规每2周测1次体重和血压,每4周测1次空腹血糖外,分别于链脲佐菌素注射后7日及实验末抽取空腹尾静脉血测定空腹血糖水平。
超声心动图检测:分别于8周、16周对各组进行常规超声心动图检查,主要检测以下指标:心率、左心室舒张末期内径、左心室收缩末期内径、左心室射血分数、E波最大速度、A波最大速度、E/A比值、E波减速时间、舒张末期左心室后壁厚度、舒张末期室间隔厚度、短轴缩短率、等容舒张时间。
心肌组织病理学检测:16周后处死动物,进行常规苏木素伊红染色(H&E染色)、Masson三色染色以及天狼星红染色,观察心肌组织结构、细胞形态、胶原分布情况。
末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记测定法(TUNEL染色):使用TUNEL细胞凋亡原位检测试剂盒对石蜡切片进行荧光染色,在荧光显微镜下观察,细胞核呈现绿色荧光的心肌细胞即为凋亡细胞。
组织免疫荧光染色:取心肌组织石蜡切片,对内质网应激标志分子伴侣葡萄糖调节蛋白78(GRP78)进行免疫荧光染色以证实内质网应激的发生。
蛋白质印迹法(Western blot)检测:取-80℃保存的心肌组织,分别提取总蛋白和细胞核蛋白,通过10%~15%的SDS-聚丙烯酰胺凝胶电泳对等量的蛋白样品进行分离、转膜、封闭、一抗孵育、二抗标记、显色等,检测cytochrome c、cleaved caspase 3、GRP78和XBP1-s的表达。
半定量逆转录-聚合酶链反应(RT-PCR)和实时定量RT-PCR检测:Trizol法提取心肌组织总RNA,经逆转录获得cDNA,以β-肌动蛋白(β-actin)为参照,通过半定量RT-PCR技术检测XBP1-s 信使核糖核酸(mRNA)水平的表达,实时定量RT-PCR技术检测GRP78的 mRNA表达水平。
统计学分析:使用SPSS 17.0统计软件进行分析。数值变量资料数据以均数±标准差表示,两组间均数比较采用小样本t检验,多组间均数比较采用One-Way ANOVA方差分析,以P<0.05为差异有统计学意义。
2 结果
各组大鼠的基本指标监测:8周时,DCM组与对照组比较,体重下降,心率、空腹血糖和收缩压升高;DCM+缬沙坦组与DCM组比较,体重降低,心率、空腹血糖和收缩压降低。16周时,DCM组与对照组比较,体重和心率下降,空腹血糖和收缩压升高;DCM+缬沙坦组与DCM组比较,体重和心率增加,空腹血糖和收缩压降低。上述比较差异均有统计学意义(P<0.05)。表1
表1 三组大鼠8周和16周后体重、心率、空腹血糖及血压水平比较

表1 三组大鼠8周和16周后体重、心率、空腹血糖及血压水平比较
注: 本时间段对照组比较*P<0.05; 与DCM组比较△P<0.05。1 mmHg=0.133 Pka #:存活只数 DCM:糖尿病心肌病
收缩压(mmHg) 8周对照组 10 348±15.3 328±22 4.4±0.8 128±2.8 DCM组 20 272±14.8* 402±5* 19.3±2.0*144±6.4*DCM+缬沙坦组17 312±9.2△ 361±19△17.9±1.2△131±4.0△16周后对照组 10 452±19.0 341±38 4.41±0.5 134±3.0 DCM组# 15 290.3±20.7*308±20* 20.2±1.1*157±7.5*DCM+缬沙坦组 17 389.5±22.3△326±31△18.3±1.5△133±4.7△存活数(只)体重(g)心率(beats/min)空腹血糖(mmol/L)
三组大鼠16周后超声心动图检测指标比较:DCM组与对照组比较,二尖瓣E波最大速度、二尖瓣E波最大速度/A波最大速度左心室及射血分数均降低,其余均增加;DCM+缬沙坦组与DCM组比较,二尖瓣E波最大速度、二尖瓣E波最大速度/A波最大速度及左心室射血分数均升高,其余均降低。上述比较差异均有统计学意义(P<0.05)表2
心肌组织病理学检查的比较:① H&E三色染色:对照组心肌细胞排列整齐,大小均一,胞浆染色均匀;DCM组与对照组相比,心肌细胞肥大,形态不规则,排列紊乱;DCM+缬沙坦组与DCM组相比,细胞肥大减轻,排列较规则(图1A)。②Masson染色:对照组心肌胶原纤维排列整齐,心肌小动脉周围少量胶原沉积,心肌间质内少量胶原组织呈散在、长索条状分布;DCM组与对照组相比,心肌细胞肥大,排列紊乱,心肌内小血管周围胶原沉积明显增多,粗大胶原纤维交联成网格状;DCM+缬沙坦组与DCM组相比,心肌细胞排列较整齐,心肌间质内和小动脉周围胶原纤维显著减少(图1B)。③天狼星红染色:DCM组与对照组相比,Ⅰ型及Ⅲ型胶原显著增加;DCM+缬沙坦组与DCM组相比,胶原纤维含量有所下降(图1C)。
表2 三组大鼠16周后超声心动图检测指标比较
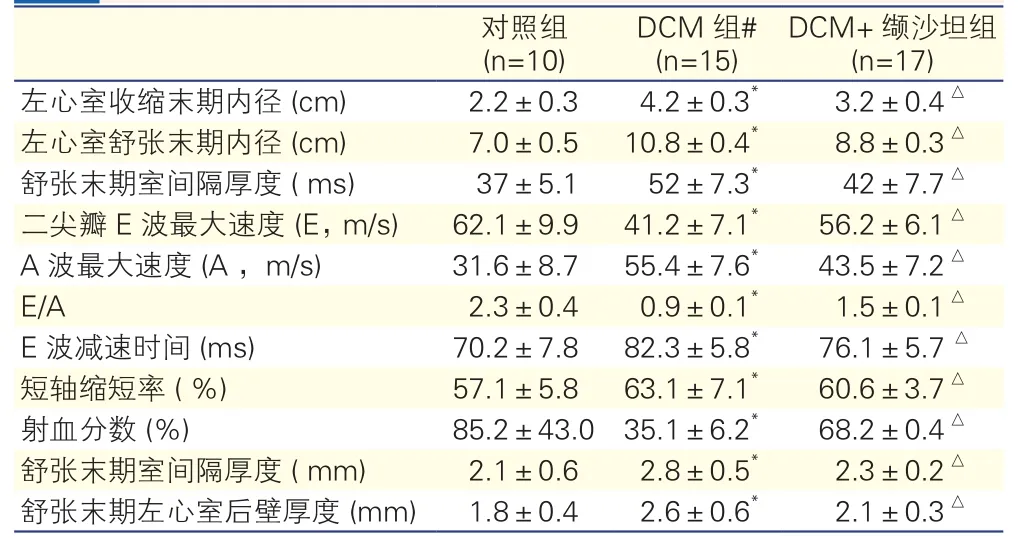
表2 三组大鼠16周后超声心动图检测指标比较
注:与对照组比较*P<0.05 与DCM组比较△P<0.05。 余注见表1
DCM组# (n=15)对照组(n=10) DCM+缬沙坦组(n=17)左心室收缩末期内径 (cm) 2.2±0.3 4.2±0.3* 3.2±0.4△左心室舒张末期内径 (cm) 7.0±0.5 10.8±0.4* 8.8±0.3△舒张末期室间隔厚度 ( ms) 37±5.1 52±7.3* 42±7.7△二尖瓣E波最大速度 (E, m/s) 62.1±9.9 41.2±7.1* 56.2±6.1△A波最大速度 (A ,m/s) 31.6±8.7 55.4±7.6* 43.5±7.2△E/A 2.3±0.4 0.9±0.1* 1.5±0.1△E波减速时间 (ms) 70.2±7.8 82.3±5.8* 76.1±5.7△短轴缩短率 ( %) 57.1±5.8 63.1±7.1* 60.6±3.7△射血分数 (%) 85.2±43.0 35.1±6.2* 68.2±0.4△舒张末期室间隔厚度 ( mm) 2.1±0.6 2.8±0.5* 2.3±0.2△舒张末期左心室后壁厚度 (mm) 1.8±0.4 2.6±0.6* 2.1±0.3△

图1 三组大鼠心肌组织苏木素伊红染色、Masson三色染色及天狼星红染色(20×)
三组大鼠TUNEL染色的结果比较:与对照组相比,DCM组大鼠心肌细胞凋亡显著增加(图2B);DCM+缬沙坦组与DCM组相比,心肌细胞凋亡明显减少,差异均有统计学意义(P<0.05)。 图2C
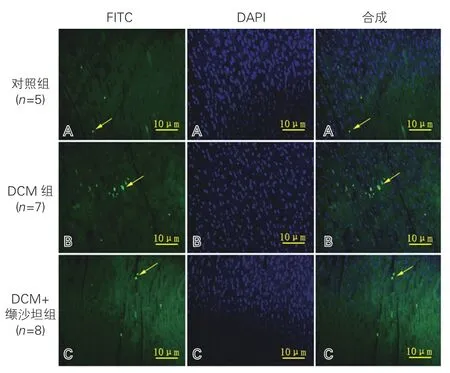
图2 三组大鼠心肌组织TUNEL染色(20×)及凋亡的心肌细胞计数(个)
Western blot检测在三组大鼠心肌组织中cleaved caspase 3、 cytochrome c蛋白相对表达水平的比较:DCM组大鼠心肌组织中cleaved caspase 3、cytochrome c的蛋白表达水平较对照组显著上调(P<0.05),而DCM+缬沙坦组较DCM组的表达水平有所下降(P<0.05),差异均有统计学意义。 图3
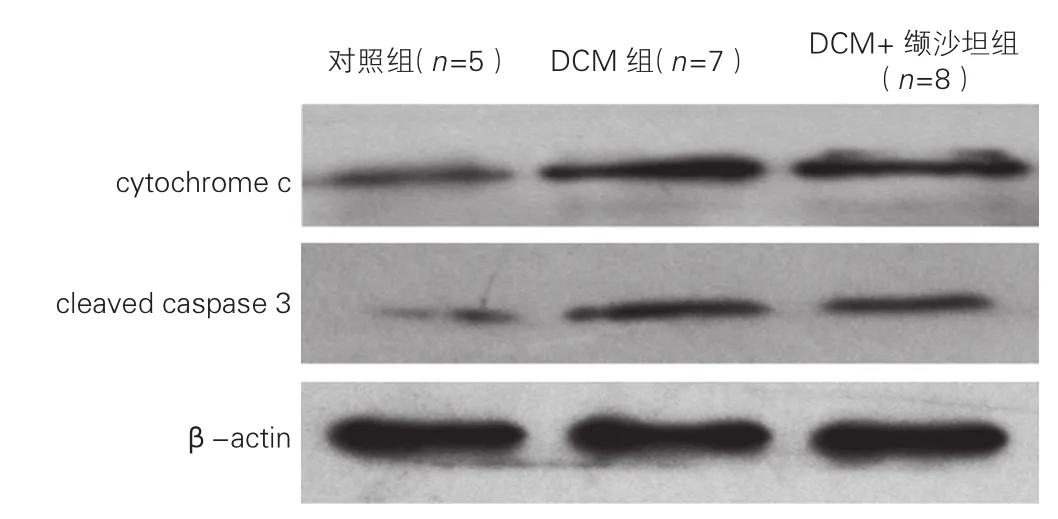
图3 三组大鼠心肌组织中cleaved caspase 3、 cytochrome c的蛋白表达水平
免疫荧光技术、实时定量RT- PCR和Western blot检测三组大鼠心肌组织中GRP78的mRNA及蛋白相对表达水平的比较:DCM组大鼠心肌组织中GRP78 mRNA及其蛋白表达水平较对照组显著上调(图4B,图5),DCM+缬沙坦组较DCM组的表达水平有所下降,差异均有统计学意义(P<0.05)。 图4C、图5

图5 实时定量RT- PCR 和Western blot 检测GRP78的mRNA及蛋白在三组大鼠心肌组织中的相对表达水平
半定量RT-PCR 和Western blot 检测XBP1-s mRNA及蛋白在三组大鼠心肌组织中的相对表达水平的比较:大鼠心肌组织中XBP1-s mRNA及其蛋白表达,DCM组与对照组相比,显著增加; DCM+缬沙坦组与DCM组相比有所下降。上述比较差异均有统计学意义(P<0.05)。 图6
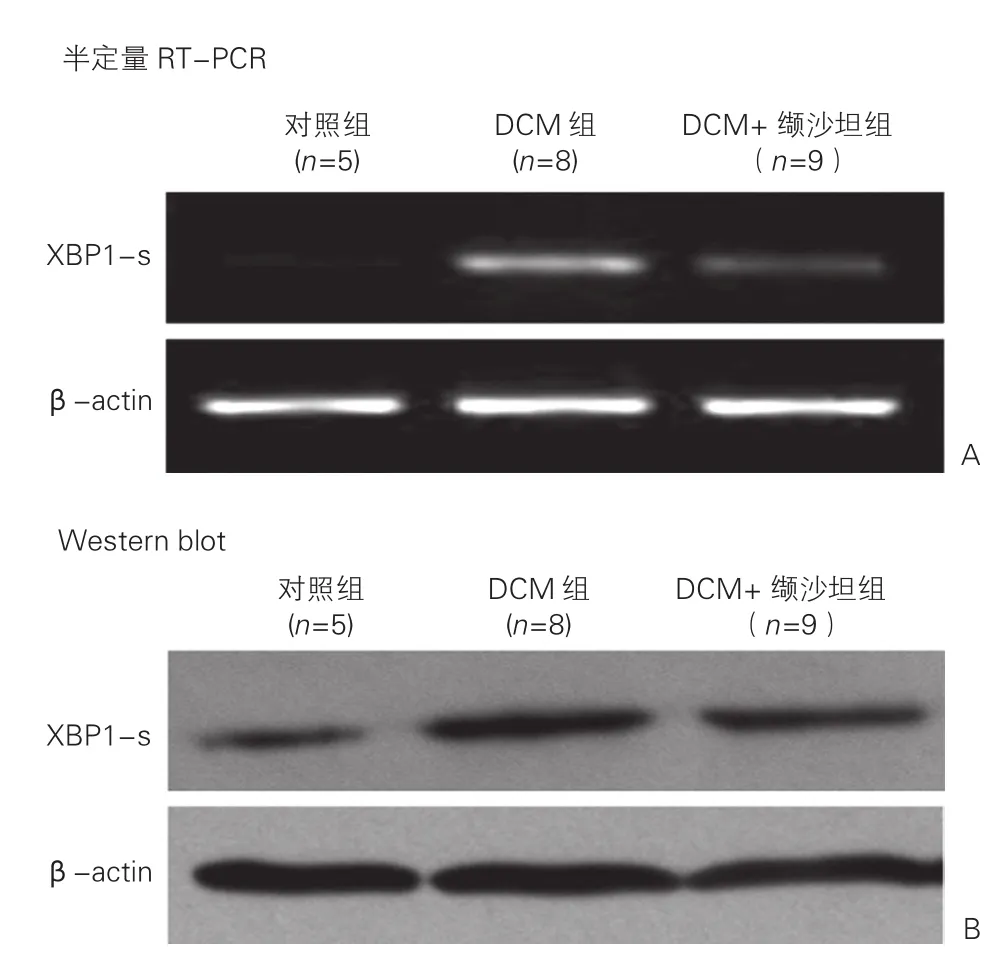
图6 半定量RT-PCR和Western blot检测XBP1-s mRNA及蛋白在三组大鼠心肌组织中的相对表达水平的比较
3 讨论
DCM被认为是一种与糖尿病相关的心肌结构改变及功能异常。在DCM病程中,心肌细胞内环境紊乱,细胞凋亡的程度逐渐超过了细胞增殖的速度,使得心肌凋亡的范围增大,组织细胞大量丧失,最终导致心功能的严重减退[3,4]。细胞凋亡的调节机制包括一系列复杂的级联反应,其中内质网应激介导的细胞凋亡通路近年来受到越来越多的关注,本研究通过构建DCM大鼠动物模型,利用GRP78的表达水平反映内质网应激的激活,检测细胞凋亡相关因子cleaved caspase 3和cytochrome c的表达水平,验证了在DCM病程中存在着内质网应激介导的心肌细胞凋亡。
XBP1是一种新发现的与蛋白折叠及内质网构建相关的蛋白质,是内质网应激的关键信号调控因子[5]。在内质网应激过程中,XBP1mRNA经过需肌醇酶1依赖性的剪接,转录形成由376个氨基酸构成的XBP1-s。后者持续高表达,将可能导致心肌细胞凋亡的显著增加[6-8]。本研究发现,在DCM大鼠心肌组织中存在XBP1-s表达增加,同时细胞凋亡相关因子cleaved caspase 3和cytochrome c表达上调,表明心肌细胞凋亡增加,这证实了XBP1-s的持续表达可导致DCM心肌细胞凋亡增加。
缬沙坦是一种高选择性血管紧张素Ⅱ 1型受体拮抗剂,除降压作用外,还可通过特异性阻断血管紧张素Ⅱ与血管紧张素Ⅱ 1型受体的结合,最大限度阻断肾素-血管紧张素系统的激活,消除血管紧张素Ⅱ对血压和心功能的不利影响,在临床上被广泛的用于降低血压和治疗其他血管紧张素Ⅱ引起的心血管事件[9,10]。相关研究发现链脲佐菌素诱导的糖尿病大鼠早期即存在着心肌细胞重构与凋亡[11,12]。本研究使用缬沙坦对DCM大鼠进行早期干预发现:缬沙坦可以有效减少DCM大鼠的心肌细胞凋亡,并且缬沙坦干预组中内质网应激的调控因子XBP1、内质网应激标志物GRP78的表达水平均显著下调,这表明缬沙坦减少心肌细胞凋亡的作用与抑制XBP1所介导的内质网应激有关。
[1] Lee KP, Dey M, Neculai D, et al. Structure of the dual enzyme Ire1 reveals the basis for catalysis and regulation in nonconventional RNA splicing. Cell, 2008, 132 : 89-100.
[2] Liu CY, Schroder M, Kaufman RJ. Ligand-independent dimerization activates the stress response kinases IRE1 and PERK in the lumen of the endoplasmic reticulum. J Biol Chem, 2000, 275: 24881-24885.
[3] Fischer M, Baessler A, Hense HW, et al. . Prevalence of left ventricular diastolic dysfunction in the community. Results from a Doppler echocardiographic-based survey of a population sample. Eur Heart J, 2003, 24: 320-328.
[4] 吕莎莎,刘宽芝. 辛伐他汀降低2型糖尿病大鼠心肌Toll样受体4表达. 中国循环杂志, 2014, 29: 64-67.
[5] Haze K, Okada T, Yoshida H, et al. Identification of the G13 (cAMP-response-element-binding protein-related protein) gene product related to activating transcription factor 6 as a transcriptional activator of the mammalian unfolded protein response. Biochem J, 2001, 355: 19-28.
[6] Lee KP, Dey M, Neculai D, et al. Structure of the dual enzyme Ire1 reveals the basis for catalysis and regulation in nonconventional RNA splicing. Cell, 2008, 132: 89-100.
[7] Liu CY, Schroder M, Kaufman RJ. Ligand-independent dimerization activates the stress response kinases IRE1 and PERK in the lumen of the endoplasmic reticulum. J Biol Chem, 2000, 275: 24881-24885.
[8] Xu J, Zhou Q, Xu W, et al. Endoplasmic reticulum stress and diabetic cardiomyopathy. Exp Diabetes Res, 2012, 2012: 827971.
[9] 彭晓玲,林泽鹏,张治伟,等. 缬沙坦长期治疗对原发性高血压患者左心室肥厚及心功能影响的对比研究. 中国循环杂志, 2003, 18: 172-174.
[10] Chan P, Wong KL, Liu IM, et al. Antihyperglycemic action of angiotensin II receptor antagonist, valsartan, in streptozotocin-induced diabetic rats. J Hypertens, 2003, 21: 761-769.
[11] Fiordaliso F, Li B, Latini R, et al. Myocyte death in streptozotocininduced diabetes in rats in angiotensin II- dependent. Lab Invest, 2000, 80: 513-527.
[12] Mason JW. Myocarditis and dilated cardiomyopathy: an inflammatory link. Cardiovasc Res, 2003, 60: 5-10.
Valsartan Inhibits Myocardial Apoptosis by Down-regulating Myocardial X-box Binding Protein 1 Expression in Experimental Diabetic Cardiomyopathy Rat’s Model
WU Ting-ting, WEI Qing-qing, YAN Yu-peng, SUN Ying-ying, LI Li, HU Luo-wen, MA Rui, LI Ou, WANG Ji.
Intensive Care Unit, China Meitan General Hospital, Beijing (100028), China
WANG Ji, Email: sdwhdz@hotmail.com
Objective: To study the relationship between myocardial X-box binding protein 1 (XBP1) expression and myocardial apoptosis in experimental diabetic cardiomyopathy (DCM) rat’s model and to clarify the mechanism of valsartan inhibiting myocardial apoptosis.Methods: A total of 50 Wistar rats were divided into 2 groups: Control group, the rats received intraperitoneal citrate buffer at 65mg/kg, n=10 and Streptozotocin group, the rats received intraperitoneal streptozotocin at 65mg/kg, n=40, all animals were treated for 7 days. DCM model was established in 37 rats (fasting blood glucose ≥ 16.7mmole/L) and they were further divided into 2 groups: DCM group, the rats received intragastric normal saline, n=20 and DCM + valsartan group, the rats received intragastric valsartan at 30mg/kg.day, n=17. The rats were treated for 16 weeks. The body weight, tail blood pressure, glucose and cardiac function were compared among 3 groups. Myocardial apoptosis was detected by TUNEL staining, RNAand protein expressions of myocardial cytochrome C, cleaved caspase 3, glucose regulation protein 78 (GRP78) and XBP1-s were examined by immunof l uorescence, real time RT-PCR and Western blot analysis.Results: Compared with Control group, DCM group showed disordered cardiac structure, more collagen content and myocardial apoptosis, P<0.05; increased RNA and protein expressions of GRP78, XBP1-s, cleaved caspase 3 and cytochrome C, P<0.05. Compared with DCM group, DCM + valsartan group had rather regularly arranged myocardiocytes, less interstitial fi brosis and myocardial apoptosis, P<0.05; decreased RNA and protein expressions of GRP78, XBP1-s, cleaved caspase 3 and cytochrome C, P<0.05.Conclusion: Valsartan may inhibit myocardial XBP1 activation and therefore, reduce the myocardial apoptosis in experimental DCM rat’s model.
Diabetic cardiomyopathy; Myocardial apoptosis; X-box binding protein 1; Valsartan
2013-11-20)
(助理编辑:曹洪红)
100028 北京市,煤炭总医院 重症医学科
吴婷婷 主治医师 博士 主要从事心血管重症的诊疗及分子生物学研究 Email:wutingtingfive@sina.com 通讯作者:王冀Email:sdwhdz@hotmail.com
R541
A
1000-3614(2014)10-0836-05
10.3969/j.issn.1000-3614.2014.10.0019
方法:将清洁级雄性8周龄Wistar大鼠50只随机分为两部分:腹腔注射65 mg/kg的柠檬酸盐缓冲液的大鼠为对照组(n=10); 腹腔注射链脲佐菌素65 mg/kg大鼠(n=40)注射7天后,收集大鼠尾静脉血测空腹血糖,其中37只连续2次空腹血糖≥16.7mmol/L(300mg/dl)为DCM大鼠建模成功并将其随机分为2组:给予以生理盐水灌胃的为DCM组(n=20),以30mg/kg.d灌胃缬沙坦给药的为DCM+缬沙坦组(n=17)。三组大鼠饲养过程中检测体重、血糖、血压、心功能等指标变化。大鼠16周后处死观察心肌组织结构、细胞形态、胶原分布情况,TUNEL染色观察心肌细胞凋亡,并通过免疫荧光、蛋白印迹法(Western blot)、实时定量逆转录-聚合酶链反应(RT-PCR)及半定量RT-PCR检测各组大鼠心肌组织中cytochrome c、cleaved caspase 3、葡萄糖调节蛋白78(GPR78)和剪接型XBP1(XBP1-s)表达水平。
结果:DCM组大鼠与对照组相比,心肌结构紊乱,胶原含量明显增加,心肌细胞凋亡增加(P<0.05),GRP78、XBP1-s、cleaved caspase 3和cytochrome c蛋白及核糖核酸(RNA)表达水平明显升高(P<0.05),DCM+缬沙坦组与DCM组相比,心肌细胞排列较整齐,心肌间质内和小动脉周围胶原纤维显著减少,心肌细胞凋亡明显减少(P<0.05),GRP78、XBP1-s、cleaved caspase 3和cytochrome c蛋白及RNA表达水平明显下降(P<0.05)。
结论:DCM大鼠心肌组织中存在着调节内质网应激的关键因子-XBP1的活化,DCM病程中存在着XBP1调控的内质网应激相关凋亡途径的激活,心肌细胞凋亡增加,而缬沙坦能够抑制DCM大鼠心肌细胞XBP1的激活,减少心肌细胞凋亡。

