瑞舒伐他汀对大鼠心肌梗死后活性氧物质产生及骨膜蛋白和心肌营养素表达的影响
李恩,孙利强,刘宗芳,汪涛
基础与实验研究
瑞舒伐他汀对大鼠心肌梗死后活性氧物质产生及骨膜蛋白和心肌营养素表达的影响
李恩,孙利强,刘宗芳,汪涛
目的:观察大鼠心肌梗死后骨膜蛋白、心肌营养素-1(CT-1)的表达及活性氧物质(ROS)的产生,并用瑞舒伐他汀对其干预,探讨其与心室重塑的关系。
瑞舒伐他汀;骨膜蛋白;心肌营养素;心肌梗死;心室重塑
(Chinese Circulation Journal, 2014,29:823.)
心肌梗死在我国发生率越来越高,成为严重威胁人类生命的疾病[1]。心血管领域都在积极探索各种治疗心肌梗死以及梗死后如何更好的逆转心室重塑的办法,以求改善患者的近期和远期预后。近来,研究表明患者心肌梗死后活性氧物质(ROS)大量激活,从而产生一系列的病理生理变化,氧化应激产生的ROS可能是心肌梗死后骨膜蛋白、心肌营养素-1(CT-1)过度表达的一条信号通路[2]。他汀类药物的抗炎、抗ROS作用大量实验已经得到证实。本研究选择心肌梗死后大鼠为研究对象,观察心肌梗死后ROS的变化与骨膜蛋白、CT-1表达变化之间的关系,并用瑞舒伐他汀进行干预,探讨瑞舒伐他汀是否可能通过其抗ROS作用和抑制骨膜蛋白、CT-1产生影响,从而逆转心室重塑,进而为临床上治疗心肌梗死后心功能不全、改善患者预后提供理论依据。
1 材料与方法
试验材料:瑞舒伐他汀片(商品名:可定,由阿斯利康制药有限公司提供);荧光定量聚合酶链式反应(PCR)试剂(包括如下:SYBR Premix Ex Taq TM,Ribonuclease Inhibitor,dNTP Mixture,Oligo d(T)18 Primers,引物设计,引物合成)由宝生物工程有限公司提供;Trizol Reagent 由Invitrogen life technologies提供;sp9000试剂盒(北京中杉生物工程公司);大鼠CT-1免疫组化试剂盒(上海雅吉酶联生物科技有限公司);骨膜蛋白多克隆抗体(上海萨博生物技术有限公司);超氧阴离子自由基测试盒、羟自由基测定试剂盒(南京建成生物工程研究所)
动物模型建立及实验分组:45只10周龄雄性Wistar大鼠,体重250~300 g,由郑州大学实验动物中心提供,随机分为假手术组(n=15)和心肌梗死组(n=30),按Maisel等[3]提供的方法建立心肌梗死模型,通过结扎左冠状动脉前降支(LAD)建立急性心肌梗死模型,术中以心电图Ⅰ导联和aVL导联ST段立即弓背向上抬高为心肌梗死模型制作成功标志。假手术组仅在LAD下留置丝线,不结扎。心肌梗死组模型建立成功24 h后将大鼠随机分为两组:心肌梗死对照组(n=15)和瑞舒伐他汀干预组(n=15), 瑞舒伐他汀干预组于手术后1天给予瑞舒伐他汀1 mg/(kg.d)灌胃[4],假手术组和心肌梗死对照组给予等量生理盐水灌胃,持续6周。6周后,假手术组死亡2只,心肌梗死对照组死亡5只,瑞舒伐他汀干预组死亡3只。假手术组13只,心肌梗死对照组10只,瑞舒伐他汀干预组12只最终获得完整大鼠资料。
左心室重量指数的测定:6周后处死动物。处死前大鼠称重后,3%戊巴比妥(30 mg/kg)腹腔麻醉,迅速开胸,取出心脏,分别称取全心和左心室(含室间隔)重量,并计算左心室重量指数(左心室重量/体重)。取左心室非梗死区心肌,保存于-80℃冰箱中,用于做荧光定量PCR。
非梗死区心肌CT-1mRNA、骨膜蛋白 mRNA的测定:采用SYBR Green Ⅰ荧光定量PCR检测左心室非梗死区心肌CT-1mRNA、骨膜蛋白 mRNA相对表达量,取冻存心肌约100 mg剪碎,用TRNzol试剂提取总RNA。取2 μl总RNA用随机引物Oligod(T)18和M-MLV逆转录成15 μl cDNA。取标准样品2 μl,加用试剂SYBR Premix Ex TaqTM,分别使用目的基因(CT-1、骨膜蛋白)和管家基因(GAPDH,主要用于对所有样品进行归一化处理)在GeneAmp 5700 Sequence Detector 仪进行扩增,其产物用于标准曲线的制作。然后分别使用目的基因(CT-1、骨膜蛋白)和管家基因(GAPDH)的倍比稀释的标准品(5、6个梯度)制作两条标准曲线,待测样品与标准品同时进行反应,得到目的基因的Ct值代入目的基因标准曲线,得到管家基因的Ct值代入管家基因标准曲线,换算出各自的起始模板量(由仪器自动读出),然后用目的基因(CT-1、骨膜蛋白)的定量结果除以管家基因(GAPDH)的定量结果(即RNA量校正)就可以得到不同样品之间的目的基因(CT-1、骨膜蛋白)相对表达量。目的基因CT-1的反应参数为95℃ 10 s,60℃ 34 s,40 cycles,管家基因GAPDH的反应参数为95℃ 10 s,60℃ 34 s,35 cycles。以上试剂及引物合成均由宝生物工程(大连)有限公司提供。引物序列如下:CT-1基因sense 5'-TCTATGGCGAGTGGGTGAGC-3',antisense5'-AGCAAGCAAGCAAAGAAAGA-3',产物长度为340 bp。骨膜蛋白基因 sense5'-GCTGCTGTTCCTGTGATA-3', antisense5'-GTGGCTGTGTAAGGCATTCA-3',产物长度为478 bp。GAPDH基因sense5'-BACAACTTTGGCATCGTGGA-3',antisense5'-AAGGCGCTGTCTTGAGACCTAA-3',产物长度为133 bp。
非梗死区心肌骨膜蛋白、CT-1的蛋白测定:心肌组织石蜡包埋后连续切片,脱蜡水化,滴加稀释的一抗、二抗,用二氨基联苯胺(DAB)显色封片。采用图像分析软件在显微镜下分析,镜下观察胞浆染色棕黄色为阳性,以阳性区平均灰度值表示其含量。心肌骨膜蛋白、CT-1的蛋白测定采用免疫组化法(SP法)检测[5]。
非梗死区心肌ROS测定:电子天平准确称取待测心肌组织的重量,按重量体积比加生理盐水制备成10%的组织匀浆,4℃下,3000转/分,离心10分钟,然后取组织匀浆上清再用生理盐水按1 :9和1:19分别稀释成1%和0.5%的组织匀浆备用。比色法测定心肌组织中超氧阴离子(O2-.)及羟自由基(OH.)的含量[6]。
统计学处理:SPSS 13.0软件处理,数据以均数±标准差表示,采用单因素方差分析和LSD检验,以P<0.05作为差异具有统计学意义。
2 结果
2.1大鼠体重、左心室重量及左心室重量指数的改变
6周后三组大鼠体重差异均无统计学意义(P>0.05),心肌梗死对照组和瑞舒伐他汀干预组的心脏重量、左心室重量、左心室重量指数均高与假手术组(P<0.05),而瑞舒伐他汀干预组均显著低于心肌梗死对照组(P <0.05)。表1
2.2非梗死区心肌营养素-1、骨膜蛋白 mRNA表达和蛋白含量的变化及瑞舒伐他汀的影响
与假手术组相比,心肌梗死对照组与瑞舒伐他汀治疗组的骨膜蛋白及CT-1 mRNA水平、骨膜蛋白及CT-1蛋白含量均较假手术组均明显增高(P<0.05)。与心肌梗死对照组比较,瑞舒伐他汀干预组的骨膜蛋白及CT-1 mRNA水平、骨膜蛋白及CT-1蛋白含量明显下降(P<0.05),见表2。 CT-1、骨膜蛋白的免疫组化图见图1、2。
表1 6周后三组大鼠体重、心脏重量、左心室重量及左心室重量指数的改变

表1 6周后三组大鼠体重、心脏重量、左心室重量及左心室重量指数的改变
注:与假手术组比较*P<0.05;与心肌梗死对照组比较△P<0.05
组别 只数 体重 (g) 心脏重量 (mg) 左心室重量 (mg) 左心室重量指数 (mg/g)假手术组 13 309.18±11.23 871.50±53.12 689.11±32.69 2.23±0.31心肌梗死对照组 10 310.25±8.31 928.02±21.76* 821.01±50.02* 2.65±0.10*瑞舒伐他汀干预组 12 315.46±9.51 891.13±42.15*△ 753.09±65.13*△ 2.39±0.14*△
表2 三组大鼠非梗死区骨膜蛋白及心肌营养素-1蛋白含量、骨膜蛋白及心肌营养素-1的mRNA表达水平变化
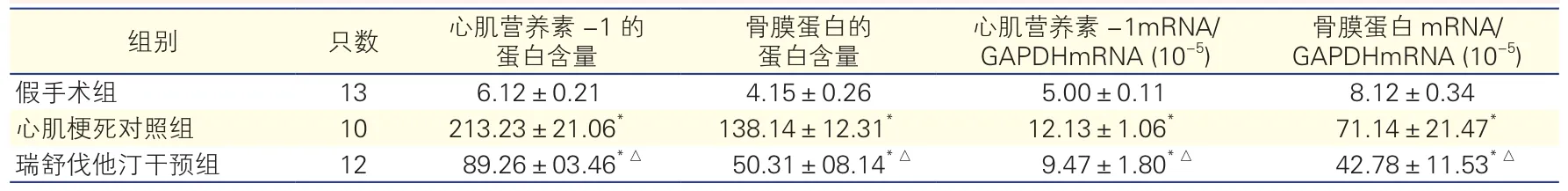
表2 三组大鼠非梗死区骨膜蛋白及心肌营养素-1蛋白含量、骨膜蛋白及心肌营养素-1的mRNA表达水平变化
注:与假手术组比较*P<0.05 ;与心肌梗死对照组比较△P<0.05
组别 只数 心肌营养素-1的蛋白含量骨膜蛋白的蛋白含量心肌营养素-1mRNA/ GAPDHmRNA (10-5)骨膜蛋白mRNA/ GAPDHmRNA (10-5)假手术组 13 6.12±0.21 4.15±0.26 5.00±0.11 8.12±0.34心肌梗死对照组 10 213.23±21.06* 138.14±12.31* 12.13±1.06* 71.14±21.47*瑞舒伐他汀干预组 12 89.26±03.46*△ 50.31±08.14*△ 9.47±1.80*△ 42.78±11.53*△

图1 三组大鼠心肌营养素-1蛋白免疫组化染色(×400)
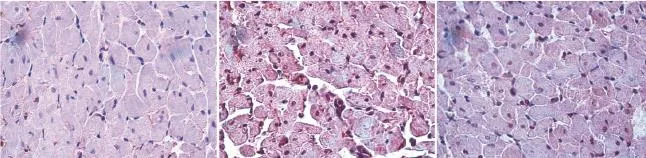
图2 三组大鼠骨膜蛋白免疫组化染色(×400)
2.3非梗死区活性氧物质的变化及瑞舒伐他汀的影响
心肌梗死对照组与瑞舒伐他汀干预组的心肌超氧阴离子(O2-.)、羟自由基(OH.)均高于假手术组(P<0.05),差异有统计学意义,瑞舒伐他汀干预组比心肌梗死对照组心肌超氧阴离子(O2-.)、羟自由基(OH.)明显降低(P<0.05),差异有统计学意义。表3
表3 大鼠非梗死区心肌活性氧物质含量的变化及瑞舒伐他汀干预的影响

表3 大鼠非梗死区心肌活性氧物质含量的变化及瑞舒伐他汀干预的影响
注:与假手术组比较*P<0.05 ;与心肌梗死对照组比较△P<0.05
组别 只数 超氧阴离子 (U/ml) 羟自由基 (U/ml)假手术组 13 104.23±18.38 132.09±35.86心肌梗死对照组 10 218.12±14.36* 318.12±46.71*瑞舒伐他汀干预组 12 161.13±16.71*△ 270.13±40.12*△
3 讨论
急性心肌梗死是危害人类健康的严重疾病。近年来,急性心肌梗死早期存活率有明显改善,但因急性心肌梗死后心室重塑而引起的心力衰竭的死亡率却日益增加。心肌梗死后心室重塑是指心肌梗死后心室大小、形态和组织结构的变化,突出特征为心肌细胞肥大,细胞间质纤维化,左心室腔扩张和球形变,心功能进行性降低,最终进展为心力衰竭。心室重塑时,氧化应激活性产物增多以及细胞因子等大量生成加速心肌细胞死亡和心室重塑的进程。
ROS是指由于活性氧的过量生成和/或细胞内抗氧化防御系统受损,导致超氧阴离子(O2-.)、过氧化氢(H2O2)等氧自由基及其相关代谢产物过量的总称。一般认为线粒体是产生ROS的主要部位,在线粒体呼吸链复合物Ⅲ的辅酶Q位置,由单个电子传递给分子氧而形成氧分子单价还原(即线粒体电子漏),从而造成超氧化物自由基不断生成而产生ROS[7,8];或者是NAD(P)H氧化酶、一氧化氮合成酶、线粒体呼吸链氧化酶和黄嘌呤氧化酶(XOD)等其中的一种或几种氧化酶活性增加的结果。急性心肌梗死后,由于炎性细胞因子的作用、儿茶酚胺的自身氧化等导致ROS产生增多,反过来ROS的增多又加重心肌损伤,二者之间形成恶性循环。
骨膜蛋白是1993年日本学者Takeshita等[9]从小鼠成骨细胞系MC3T3-E1cDNA文库中克隆出的一种黏附分子,为细胞外基质(ECM)蛋白的一种。压力负荷、应激、炎症等均可引起骨膜蛋白表达上调[10]。骨膜蛋白在AMI后大量表达这一观点目前学术界已经达成共识。Iekushi等[11]发现骨膜蛋白与心肌梗死后心功能恶化有关,缬沙坦通过抑制骨膜蛋白表达来改善心功能及心肌梗死后心室重塑。
CT-1是一个致心肌肥厚因子,最初是Pennica等[12]1995年从小鼠胚胎干细胞的胚状体培养液中分离获得的一种新型细胞因子,其分子结构与细胞因子白细胞介素-6(IL-6)家族成员具有高度同源性,属于白细胞介素-6(IL-6)细胞因子家族。成年大鼠和人类的CT-1 mRNA在心脏、骨骼肌、前列腺和卵巢中有较高表达[13]。病理状态下如遗传性高血压、心肌梗死、实验性心肌病、进行性心衰等均出现CT-1基因的过度表达[14,15]。 CT-1是迄今发现的IL-6家族中体外诱导心肌细胞肥大作用最强的细胞因子。
羟甲基戊二酸单酰辅酶A还原酶抑制剂,即他汀类药物通常被用于减少胆固醇的合成,降低血清总胆固醇和低密度脂蛋白胆固醇的水平。近年来的研究发现他汀类药物具有多种调节血脂以外的药理作用,如缩小粥样硬化斑块、抗血小板聚集、抗炎症、抗氧化应激,改善内皮细胞功能及改善血液流变学等[16]。多项大规模临床试验表明,他汀类药物不仅安全、耐受性好,而且可显著降低冠心病患者致死性和非致死性心血管事件的发生,目前已广泛应用于冠心病的一、二级预防[17-20]。他汀类药物的稳定斑块、改善内皮功能、抗氧化等作用大量研究已经得倒证实。他汀类药物是否可以通过其抗氧化作用,抑制氧化应激,抑制ROS,从而抑制骨膜蛋白、CT-1的表达进而抑制心肌梗死后心室重塑,这一通路的研究目前尚未见报道。
本研究以检测大鼠心梗后非梗死区心肌超氧阴离子(O2-.)及羟自由基(OH.)的含量以及骨膜蛋白CT-1 mRNA及蛋白水平变化来探讨ROS与骨膜蛋白、CT-1的关系,以及其与心室重塑的关系。结果发现:与假手术组相比, 心肌梗死对照组和瑞舒伐他汀治疗组非梗死区心肌超氧阴离子、羟自由基、骨膜蛋白 、CT-1 mRNA表达和蛋白含量以及及左心室重量指数明显增高;与心肌梗死对照组相比,瑞舒伐他汀组非梗死区心肌超氧阴离子、羟自由基、骨膜蛋白、CT-1 mRNA表达和蛋白含量以及左心室重量指数明显降低,提示瑞舒伐他汀可能通过抑制ROS、骨膜蛋白、CT-1的表达来改善大鼠心肌梗死后的心室重塑。
[1] 程姝娟, 颜红兵, 王健, 等. ST段抬高心肌梗死靶血管超长病变应用西罗莫司洗脱支架的临床与随访结果. 中国循环杂志, 2009, 24: 166-169.
[2] Sivaranjani N, Rao SV, Rajeev G. Role of reactive oxygen species and antioxidants in atopic dermatitis. J Clin Diagn Res, 2013, 7: 2683-2685.
[3] Maisel A, Cesario D, Baird S, et al. Experimental autoimmune myocarditis produced by adoptive transfer of splenocytes after myocardial infarction. Circ Res, 1998, 82: 458-463.
[4] 魏伟. 药理实验方法学. 人民卫生出版社. 2010: 7.
[5] 陈罡, 罗殿中, 李萍, 等. 改进免疫组化SP染色法的探讨. 广西医科大学学报. 2005, 22: 138-139.
[6] 汪涛, 秦志平. 培哚普利对大鼠心肌梗死后氧化应激状态及心肌细胞凋亡的影响. 郑州大学学报(医学版), 2008, 43: 321-323.
[7] Teiger E, Than VD, Richard L, et al. Apoptosis in pressure overloadinduced heart hypertrophy in the rat. J Clin Invest, 1996, 97: 2891-2897.
[8] Sawyer DB, Siwik DA, Xiao L, et al. Role of oxidative stress in myocardial hypertrophy and failure. J Mol Cell Cardio1, 2002, 34: 379-388.
[9] Takeshita S, Kikuno R, Tezuka K, et a1. Osteoblast-specific factor 2: cloning of a putative bone adhesion protein with homology with the insect protein fasciclin I. Biochem J, 1993, 294: 271-278.
[10] Stansfield WE, Andersen NM, Tang RH, et al. Periostin is a novel factor in cardiac remodeling after experimental and clinical unloading of the failing heart. Ann Thorac Surg, 2009, 88: 1916-1921.
[11] Iekushi K, Taniyama Y, Azuma J, et a1. Novel mechanisms of valsartan on the treatment of acute myocardial infarction through inhibition of the antiadhesion molecule periostin. Hypertension, 2007, 49: 1409-1414.
[12] Pennica D, King KL. Shaw KJ, et al. Expression cloning of cardiotrophin-1 a cytokine that induces cardiac myocyte hypertrophy. Proc Natl Acad Sci, 1995, 92: 1142-1146.
[13] Tsutamoto T, Asai S, Tanaka T, et al. Plasma level of cardiotrophin-1 as a prognostic predictor in patients withchronic heart failure. Heart Fail, 2007, 9: 1032-1037.
[14] Jougasaki M, Leskinen H, Larsen AM, et al. Ventricular cardiotrophin-1 activation precedes BNP in experimental heart failure. Peptides, 2003, 24, 24: 889-892.
[15] Freed DH, Cunnington RH, Dangerfield AL, et al. Emerging evidence for the role ofcardiotrophin-1 in cardiac repair in the infracted heart. Cardiovasc Res, 2005, 65: 782-792.
[16] Nissen SE, Tuzcu EM, Schoenhagen P, et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial. J Am Med Assoc, 2004, 291: 1071-1080.
[17] Mascitelli L, Goldstein MR. Regarding "Statin use and lower extremity amputation risk in nonelderly diabetic patients". Vasc Surg, 2014, 59: 876.
[18] Hu X, Sun A, Xie X, et al. Rosuvastatin changes cytokine expressions in ischemic territory and preserves heart function after acute myocardial infarction in rats. J Cardiovasc Pharmacol Ther, 2013, 18: 162-176.
[19] Xu Y, Tang T, Ding Y, et al. Improved cardiac performance by rosuvastatin is associated with attenuations in both myocardial tumor necrosis factor-alpha and p38 MAP kinase activity in rats after myocardial infarction. Am J Med Sci, 2010, 340: 121-127.
[20] 陈伟伟, 高润霖, 刘力生, 等. 中国心血管病报告2013概要. 中国循环杂志, 2014, 7: 487-491.
Effects of Rosuvastatin on Production of Reactive Oxygen Species and Expressions of Periostin, Cardiotrophin-1 in Experimental Rats After Acute Myocardial Infarction
LI En, SUN Li-qiang, LIU Zong-fang, WANG Tao.
Department of Cardiology, The Second Aff i liated Hospital of Zhengzhou University, Zhengzhou (450014), Henan, China
WANG Tao, Email: ln1025asdfgh@sohu.com
Objective: To investigate the effects of rosuvastatin on reactive oxygen species (ROS) production and periostin, cardiotrophin-1 (CT-1) expression, and to explore rosuvastatin on ventricular remodeling in experimental rats after acute myocardial infarction (AMI).Methods: A total of 45 male Wistar rats were randomly divided into 2 group, Sham operation group, n=15 and AMI group, n=30, the AMI model was established by left anterior descending coronary ligation. After 24 hours of AMI, the rats were further divided into 2 groups, AMI + rosuvastatin group, the rats received gastric rosuvastatin 1mg/(kg•d), and AMI group, the rats received gastric normal saline. n=15 in each group and all animals were treated for 6 weeks. The mRNA and protein expressions of CT-1 and periostin were examined by real time RT-PCR and immunohistochemistry, the contents of superoxide anion (O2-.) and hydroxy radical (OH.) were detected by colorimetric method among different groups.Results: Compared with Sham operation group and AMI + suvastatin group, the mRNA and protein expressions of CT-1, periostin, the contents of (O2-.), (OH.) and left heart weight index were increased in AMI group at non-infraction zone, P<005. Compared with Sham operation group, the mRNA and protein expressions of CT-1, periostin, the contents of (O2-.), (OH.) andleft heart weight index were increased in AMI + suvastatin group at non-infraction zone, P<005. Compared with AMI group, the mRNA and protein expressions of CT-1 and periostin were decreased in AMI + rosuvastatin group, P<005.Conclusion: Rosuvastatin may improve ventricular remodeling via inhibiting ROS production and CT-1, periostin expression in experimental rats after AMI.
Rosuvastatin; Periostin; Cardiotrophin-1; Myocardial infarction; Ventricular remodeling
2014-05-06)
(助理编辑:许菁)
450014 河南省郑州市,郑州大学第二附属医院 心内科(李恩、孙利强、刘宗芳),干部病房(汪涛)
李恩 主治医师 博士研究生 研究方向:冠心病的预防与治疗 Email: 394267264@qq.com 通讯作者:汪涛 Email: ln1025asdfgh@sohu.com
R54
A
1000-3614(2014)10-0823-05
10.3969/j.issn.1000-3614.2014.10.16
方法:45只雄性Wistar大鼠随机分为假手术组(n=15)和心肌梗死组(n=30),通过结扎左冠状动脉前降支(LAD)建立急性心肌梗死模型。模型建立成功24 h后,心肌梗死组再随机分为心肌梗死对照组(n=15)和瑞舒伐他汀干预组(n=15)。瑞舒伐他汀干预组每日给以瑞舒伐他汀1 mg/(kg.d)灌胃,假手术组和心肌梗死对照组每日给予等量生理盐水灌胃,持续6周。利用Real Time 聚合酶链式反应(PCR)法检测非梗死区CT-1、骨膜蛋白 mRNA的表达,免疫组化法测定CT-1、骨膜蛋白的蛋白含量,比色法分别测定标本中超氧阴离子(O2-.)及羟自由基(OH.)的含量。
结果:给药6周后,心肌梗死对照组相比假手术组、瑞舒伐他汀干预组非梗死区心肌中CT-1 mRNA、骨膜蛋白mRNA的表达、CT-1及骨膜的蛋白含量、超氧阴离子(O2-.)及羟自由基(OH.)含量、左心室重量指数显著升高(P<0.05),差异有统计学意义;瑞舒伐他汀干预组与假手术组相比,非梗死区心肌中CT-1 mRNA、骨膜蛋白 mRNA的表达、CT-1及骨膜蛋白的蛋白含量、超氧阴离子(O2-.)及羟自由基(OH.)含量、左心室重量指数显著升高(P<0.05),差异有统计学意义。瑞舒伐他汀干预组与心肌梗死对照组相比,CT-1及骨膜蛋白 mRNA表达和蛋白含量明显下降(P<0.05),差异有统计学意义。
结论:瑞舒伐他汀可能通过抑制ROS产生、CT-1及骨膜蛋白在mRNA和蛋白水平的表达来改善大鼠心肌梗死后心室重塑。

