支架内新生动脉粥样硬化研究进展*
罗明华 、王贺综述,关怀敏审校
综述
支架内新生动脉粥样硬化研究进展*
罗明华 、王贺综述,关怀敏审校
冠心病患者冠状动脉支架置入后再狭窄及晚期血栓形成可致严重心脏事件,成为临床预后的制约因素。近年来研究发现“支架内新生动脉粥样硬化(ISNA)”在“支架内再狭窄(ISR)”及“晚期支架内血栓(LST)”的发生过程中扮演着重要的角色。支架内新生动脉粥样硬化有其独特的病理特点、发生机制及其临床危害性,其与传统动脉粥样硬化的发生发展有着明显的区别与联系。探索ISNA发生机制及防治办法可能成为预防ISR及LST的重要靶点,也可能是预防支架术后晚期管腔丢失(LLL)的重要手段。对于改善支架置入后临床效果具有非常重要的意义。
冠心病;支架;新生动脉粥样硬化;追赶现象
经皮冠状动脉(冠脉)支架置入术已经成为治疗冠心病的常规手段。然而,支架内再狭窄(in-stent restenosis,ISR)却成为影响经皮冠状动脉介入治疗(PCI)疗效的重要原因。目前认为,经皮冠脉成形术(PTCA)后再狭窄主要由于血管弹性回缩所致,再狭窄率可高达50%[1]。随着裸金属支架(BMS)及药物涂层支架(DES)的应用,再狭窄率大幅下降。但是10%~20%再狭窄率以及晚期支架血栓(LST)仍然是制约DES置入术后临床效果的因素[2,3]。支架内再狭窄及晚期支架内血栓可致患者再次发生包括心绞痛、急性心肌梗死,甚至心原性猝死等主要心血管不良事件(MACE),是目前冠心病介入支架治疗后面临的严峻问题。近三年来,随着先进的影像学技术的进展,尤其是分辨率达到微米水平的光学干涉断层成像(OCT)技术运用于临床及基础研究,越来越多的影像学证据及尸检报告显示支架内新生动脉粥样硬化(in-stent neoatherosclosis,ISNA)是DES置入后支架内再狭窄及晚期支架内血栓的重要原因[3-8]。这是正在被披露并被接受的ISR的真相。
1 对新生动脉粥样硬化的认识过程
“新生动脉粥样硬化(neoatherosclerosis)”一词最早出现于2010年,笔者以“neoatherosclerosis”为自由词检索pubmed,仅仅搜索到55篇文献,说明对于这一现象的认识仍然还很局限。Kang等[9]通过血管内超声(IVUS)观察DES及BMS置入后新生内膜增殖的研究发现在内膜增殖最重的地方,钙化及坏死的成分较大;同时也发现支架置入时间越长,新生内膜中坏死及钙化的成分越多,认为支架置入后发生了ISNA。随后, Nakazawa等[10]进行的尸检研究使人们对ISNA的认识更加清晰。该研究中,新生动脉粥样硬化被定义为具有或不具有坏死核心的新生内膜内富含脂质的泡沫巨噬细胞簇。接着,便有更多的研究以血管内超声、光学干涉断层成像以及血管镜为工具,对ISNA进行了研究。Park等[11]撰文提出“支架内新生动脉粥样硬化是晚期支架失败的最终共同通路”的观点,认为无论是DES还是BMS,都可能引起与ISNA,从而导致支架内再狭窄或支架内血栓的发生,这是支架治疗失败的共同路径。 目前,学者对于ISNA的认识几乎仅限于临床影像学的观察及尸体解剖的结果,还有许多的谜题有待解决。
2 支架内新生动脉粥样硬化的病理特点及意义
研究显示ISNA具有发生率高、发生早、斑块不稳定、炎症反应重等特点[3,5,12]。Otsuka等[5]对149例支架置入后1个月至3年的患者尸检报告显示,不同DES患者ISNA的发生率19%~35%不等。Nakazawa 等[8]总结了66例DES及77例BMS置入患者的尸检报告,比较两组ISNA发生的比例及其发生时程。发现35%的DES置入病变出现了ISNA,且早在置入支架后4个月就开始出现以泡沫巨噬细胞浸润为特点的ISNA。而BMS置入病变在2年内没有发生,即使到4年才有很低的发生率。本课题组对11例DES支架术后发生急性冠脉综合征(ACS)的患者进行研究[7], 光学干涉断层成像检查发现7例患者出现了ISNA,最早发生在支架术后4个月。ISNA往往表现为不稳定斑块特点,Kang等[13]对50例DES置入后的患者进行光学干涉断层成像检查发现,52%的病变斑块具有薄纤维帽,58%的病变发生了新生内膜的破裂,58%的血管病变显示出血栓形成。病理学进一步研究发现ISNA斑块多表现为偏心病变、纤维帽薄 (<65 μm)、脂质含量高,伴或不伴钙化等不稳定斑块特点[3]。我们在临床中对支架内再狭窄患者的光学干涉断层成像检查发现支架内侧、支架小梁周围往往形成富含脂质的ISNA斑块。另外,ISNA也表现为大量炎症细胞浸润的特点[5,12]。研究发现在巨噬细胞位于纤维帽下及脂质的周围,支架内侧、支架小梁周围也聚集着富含脂质的巨噬细胞;大量的炎症细胞聚集在斑块内,主要是巨噬细胞、淋巴细胞和嗜酸性粒细胞等。
ISNA可致支架内再狭窄及晚期支架内血栓,引起不良临床后果。研究发现具有ISNA的患者较未发生ISNA的患者往往具有更高的靶病变血运重建率及支架内血栓的发生率[14]。当支架内全程及支架两端5 mm范围内的管腔丢失导致管腔的狭窄程度≥50%,即被诊断为支架内再狭窄[15]。DES置入后ISNA形成带来两个后果:一方面,由于斑块进展引起管腔丢失可导致支架内再狭窄,这往往需要再次血运重建;另一方面,ISNA从开始发生到支架内再狭窄的任何时期内都可能因粥样斑块不稳定,内膜破裂导致支架内血栓形成,尤其是晚期支架内血栓。这是目前被认为引起晚期支架内血栓发生的两大最重要因素之一(注:另一个因素是支架内皮化不全)[3,16]。支架内再狭窄及晚期支架内血栓导致主要心血管不良事件,严重危及患者生命安全。因此,DES应用短期得到的好处是降低再狭窄的发生率,而长期却带来了内皮化不全及新生动脉粥硬化,最终可能导致晚期支架内血栓及支架内再狭窄的临床后果,犹如Nakazawa等[8]评价DES应用于在冠心病的治疗:“前进一步,后退两步”。另外,笔者认为近期议论热烈的DES与BMS之间以及DES之间的“晚期追赶现象”也可能与ISNA有关,这些值得引起心血管介入医师的高度关注。
3 支架内新生粥样硬化的发生机制
由于ISNA是近三年来提出的概念,目前国内外研究并不深入,对其发生机制的基础研究更是缺乏。基于光学干涉断层成像、血管镜、血管内超声等在内的影像学技术在临床观察以及国外的尸检报告研究,Park 等[3]提出支架置入处持续的炎症反应及损伤血管的“愈合延迟”是导致ISNA的重要原因,笔者赞同该观点,同时也认为ISNA的过程包括了血管损伤修复过程及动脉粥样硬化过程,这两个过程统一于一个过程之中。目前认为,损伤修复过程及动脉粥样硬化过程同时也是炎症过程,所以,认为炎症反应在ISNA形成中发挥着举足轻重的作用。DES置入时血管内膜在球囊及支架作用下遭受广泛破坏,触发了损伤修复的急性炎症反应过程[17]。斑块挤破后释放大量组织因子,激活凝血酶,进而激活血小板并释放大量活性物质及炎性因子,招致更多的中性粒细胞及单核细胞游走并浸润于内膜下形成巨噬细胞,其吞噬病变处脂质转化成为泡沫细胞;同时,DES作为异物存在,诱发了靶病变血管慢性而持续的炎症反应。另外,DES持续释放药物抑制平滑肌增生的同时,也导致了靶病变以“再内皮化延迟”为特点的“愈合延迟”[18]。笔者认为,这种经久不息的炎症反应,加之损伤的血管迁延不愈共同构成了ISNA的形成基础。
针对支架置入后的局部研究显示[5,19],支架置入过程中血管受到损伤,引起了血管局部的炎症反应,在黏附分子介导下,形成血小板/血小板、血小板/白细胞、白细胞/内皮细胞复合物,P选择素介导激活的血小板与单核中性粒细胞间的粘附以及白细胞在内膜上的移动,导致损伤部位的瀑布样炎症反应,大量的单核细胞在趋化因子的作用下移行至内皮下间隙,转化为巨噬细胞。以巨噬细胞为主导的炎症反应促进中膜平滑肌细胞迁移,同时损伤处的血栓为平滑肌细胞增殖提供了一个可吸收的载体[20]。巨噬细胞及迁移的中膜平滑肌细胞开启了吞噬过程的关键步骤[21],巨噬细胞在炎症因子的作用下,上调清道夫受体,大量吞噬支架下的原有聚集的脂质成分,快速诱发泡沫细胞的形成、凋亡、坏死及崩解,形成新的脂核,导致ISNA。随着置入时间的延长,炎症反应趋于平缓。支架涂层上的药物释放完全后,对平滑肌细胞增殖的抑制作用逐渐消失,加之DES结构持续的慢性炎症反应,共同作用刺激平滑肌细胞过度增殖,表型发生改变,分裂增殖能力增强并合成大量的细胞外基质,使内膜发生重构,引起ISNA[22]。动物实验及临床观察证明损伤血管处炎症反应的存在。在兔、猪球囊损伤模型中显示出剧烈的炎症反应,早期单核细胞从管腔浸润至血管损伤局部血栓内[20]。DES支架置入1个月至3年的时间内累计有约1/3的支架内病变阶段发生了ISNA,甚至早在DES置入后4个月就出现了ISNA,且一半以上的粥样斑块内可以发现泡沫巨噬细胞簇[5,10],经皮介入治疗后,新生内膜处的炎症细胞量增加2.4倍[23]。在动脉粥样斑块旋切术的患者研究中发现,斑块中巨噬细胞浸润及血液中单核细胞活化状态与再狭窄的发生率存在一定的关系[19]。病理研究发现大量的炎症细胞聚集在斑块内,主要是巨噬细胞、淋巴细胞和嗜酸性粒细胞等[5]。总之,炎症反应贯穿于支架置入后损伤修复的整个过程,是ISNA形成的关键因素。
ISNA形成的另外一个关键因素是“愈合延迟”。靶病变的“愈合延迟”是由于DES持续释放药物所致。“愈合延迟”最重要的影响是“内皮化不全”。众所周知,完整而有效的内膜屏障是维持血管稳态的关键,而支架置入过程可使内膜损伤或者内膜剥脱,长期的支架涂层药物释放导致血管无法愈合,内皮细胞的自稳态功能消失,内膜对白细胞及血小板的粘附作用及渗透作用增加,阻止血液循环中脂质成分进入内膜下的屏障作用下降;同时也使内膜由原来的抗凝属性转化成促凝属性;开始合成血管活性物质、细胞因子及生长因子等,使脂蛋白的渗透性增加或者粘附分子的表达上调,加速脂质浸润,增加单核细胞粘附及内膜下迁移,促进粥样斑块的形成[24]。由此可见,维持血管内皮结构和功能的完整性,对于控制DES置入后ISNA具有重要作用。支架置入后再内皮化是DES置入后修复的关键病理生理过程,这一过程的顺利进行是保障内膜屏障,维持血管稳态,抑制脂质沉积与局部炎症反应的关键点。
4 支架内新生动脉粥样硬化与传统动脉粥样硬化的区别与联系
ISNA与传统动脉粥样硬化都是动脉粥样硬化的形成过程,二者的相同点如下。二者的病理本质是相同:都是粥样斑块,包含有脂质、细胞外基质成分、平滑肌细胞、炎症细胞等。所导致的结果是相同的:都可以引起血管管腔的丢失,导致血管狭窄,动脉粥样硬化导致的是原位血管的狭窄,而ISNA导致的是支架置入处血管的再次狭窄;另外,两者所形成的斑块如果变得不稳定则都可以引起破裂,都可导致斑块局部的血栓形成,引起急性心脏事件。 ISNA与动脉粥样硬化又存在着显著的差异,具体表现如下。二者的发展过程不同:①动脉粥样硬化过程是一个持续数十年的结果,被认为是一种慢性炎症过程[21],笔者认为,AS的形成过程犹如一座火山的形成过程,其斑块的生长并不是一成不变按照一定的速度在增长,而可能是一个间断静止/生长的过程。当机体遇到外在或者内在的致病因素包括微生物感染、创伤等情况下,导致了全身的炎症反应、氧化应激。斑块也在机体全身炎症状态下,引发局部的炎症反应或局部的炎症反应加重,促进斑块进展。当机体恢复至正常状态,斑块也可能逐渐稳定下来,进入低水平的慢性炎症期,斑块以及其缓慢的速度生长或者停止生长,而后再次进入下一个循环,如此,斑块在漫长的机体发展过程中,经历数十年,几十年才导致管腔的狭窄。而ISNA仅需要数月便可以形成[5]。这说明ISNA同传统动脉粥样硬化的形成与发展模式是不同的。②动脉粥样硬化是发生在具有完整的内膜系统的血管内,其内皮损伤的程度轻微,或者存在内皮功能不全的情况下发生,而ISNA则是在内膜及原有脂质核心被挤压变形后内膜撕脱、内膜不完整的基础上发生的,故ISNA发展会较快。③动脉粥样硬化是在正常的血管腔内逐步形成并生长的,而ISNA是在原有粥样斑块已经很大,并且可能存在着复合病变的情况下,具有很丰富的脂质核心、坏死物质、胆固醇结晶、炎症因子、炎症细胞等基础上形成的。④笔者认为最重要的区别可能在于动脉粥样硬化是一个慢性炎症过程,而且该慢性炎症是间断的,而ISNA则是一个急性炎症为开端,而后在此基础上,加上支架小梁以及药物载体的异物持续刺激下,形成持续的炎症反应过程。概括来说动脉粥样硬化是慢性、间断炎症过程,ISNA是急性炎症加慢性、持续性炎症过程,这也是ISNA快速发展的原因所在。⑤ 二者的病理表现是不同的,动脉粥样硬化的经典表现有脂质条纹、纤维斑块、粥样斑块及钙化、出血等复合病变,而ISNA则主要表现为丰富脂质核心的粥样斑块。认识到这两者的异同,有助于我们对ISNA形成机制的理解及对其干预的探讨。
5 支架类型对支架内新生动脉粥样硬化的影响
研究发现BMS与DES以及不同药物的DES置入后,ISNA的发生的程度及时间有明显的差别。Nakazawa等[10]通过尸体研究探索了DES及BMS置入后不同时间点的新生动脉粥样硬化的发生率及发生时间,发现DES置入处ISNA的发生率显著高于BMS(31% vs 16%)。DES发生的时间早于BMS[(1.5±0.4)年vs (6.1±1.5)年]。通过多元log回归分析发现ISNA的独立预测因素为年轻、较长的置入时间、雷帕霉素或紫杉醇药物支架的应用、基础的不稳定斑块等。说明DES较BMS发生ISNA的时间更早,发生率更高。Park等[25]通过血管内超声研究BMS及不含聚合物载体的不同剂量紫杉醇药物洗脱支架(PES)置入后不同时间内的血管内膜增殖情况,支架置入后半年随访发现管腔丢失程度在BMS组及低剂量组与高剂量组中依次降低,说明早期药物涂层支架可以抑制管腔丢失。但是2年后管腔丢失的程度则与早期刚好相反,高剂量组丢失最高,BMS组则没有管腔丢失;2年后支架内再狭窄的发生率在BMS组、低剂量组及高剂量组分别为6%、11%、25%。认为这种DES置入后早期管腔丢失率低,而晚期管腔丢失加速,导致再狭窄的现象就是晚期追赶现象(Late “Catch-Up” Phenomenon)。针对不同药物的DES置入对ISNA的形成影响的研究资料有限,有研究观察到雷帕霉素洗脱支架(SES)较紫杉醇洗脱支架(PES)更快形成ISNA,这两种DES较BMS的ISNA的发生率更高。6年累积发生率分别为(雷帕霉素洗脱支架38% vs 紫杉醇洗脱支架 24% vs BMS 10%)[11]。关于新一代DES置入后对ISNA形成的影响如何,目前仍然缺乏相应的研究数据。
BMS与DES以及不同药物的DES置入后,对ISNA发生的程度及时间存在差别的原因不清。研究发现BMS置入后出现三个时期生物反应[26],表现为:早期再狭窄(6个月之内)、中期狭窄减退(6个月~3年)、晚期管腔再次狭窄(4年以后)。笔者认为BMS及DES置入后不同的病理修复过程导致了对ISNA形成的不同影响。BMS置入后很快形成一层较厚的新生内膜,这导致了一定程度的管腔丢失;中期修复阶段中,内膜改建、细胞外基质重吸收,使早期由于内膜增生导致的管腔狭窄程度减轻;多年以后进入晚期阶段,支架内形成纤维增生或者新生动脉粥样硬化,从而引起支架内再狭窄。相反,DES置入后的修复模式则大不相同:DES置入后,由于持续释放的抑制细胞周期的药物作用,导致新生内膜形成受限,所以早期管腔丢失并不明显,但值得引起关注的是,这一时期可能是启动新生动脉粥样形成的关键时期;进入中期后,支架涂层上的药物逐渐释放,对细胞的抑制作用减弱,开始形成新生内膜,同时也启动了管腔丢失的进程;进入后期,由于药物释放完全,对平滑肌的抑制作用降低或消失,加之新生动脉粥样硬化的快速进展,促使晚期管腔丢失加速,从而形成支架内再狭窄,这一推测很好地解释了“晚期追赶”现象,但仍待研究证实。
6 支架内新生动脉粥样硬化的干预
对ISNA的干预是预防支架内再狭窄及晚期支架内血栓的重要途径。针对支架的工艺已经进行了诸多的探索,包括支架结构、生产工艺、药物载体以及涂层药物等[27-29],这些研究取得了可喜的成绩,促进了支架生物工程技术的飞速发展。也使临床冠心病介入治疗的疗效得到了突出的改善,但依然存在的一定比例的临床事件也往往使介入心脏病学者感到沮丧。全身药物的干预包括抗炎、抗凝、抗血小板、调脂、抗氧化剂、基因治疗等治疗方法运用于临床或动物实验的探索也取得了一定效果[30-32],但与临床所期望的结果仍有较大的差距。
7 小结及展望
冠心病DES置入后可以发生“支架内皮化不全”及支架置入处“持续的炎症反应”,前者一方面引起“支架内血栓”,另一方面与后者共同作用导致“ISNA”,而“ISNA”是“支架内再狭窄”的一个重要原因。“晚期支架内血栓”及“支架内再狭窄”是DES置入后发生心脏事件的主要原因,由ISNA引起的支架内再狭窄可解释“晚期追赶”现象(见图1)。
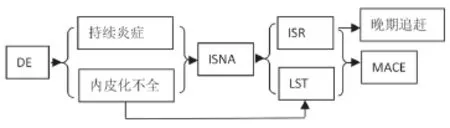
图1 药物涂层支架置入后支架内新生动脉粥样硬化的发生机制及其对临床事件的影响
因此, ISNA丰富了我们对于支架内再狭窄、晚期支架内血栓及晚期追赶现象的认识,同时,也为我们客观理解与评价药物涂层支架在临床中应用的利弊提供了更多思考的空间。探索ISNA发生机制及防治办法可能成为预防支架内再狭窄及晚期支架内血栓的重要靶点,也可能是预防支架术后晚期管腔丢失的重要手段。对于改善支架置入后临床效果具有非常重要的意义。
参考文献
[1] Nobuyoshi TK, Nosaka SM. Restenosis after successful percutaneous transluminal coronary angioplasty: serial angiographic follow-up of 229 patients. J Am Coll Cardiol, 1988, 12: 616-623.
[2] Mohan S, Dhall A. A comparative study of restenosis rates in bare metal and drug-eluting stents. Int J Angiol, 2010, 19: e66-72.
[3] Park SJ, Kang SJ, Virmani R, et al. In-stent neoatherosclerosis: a final common pathway of late stent failure. J Am Coll Cardiol, 2012, 59: 2051-2057.
[4] Wong DT, Soh SY, Malaiapan Y. In-stent thrombosis due to neoatherosclerosis: insight from optical coherence tomography. J Invasive Cardiol, 2013, 25: 304.
[5] Otsuka F, Vorpahl M, Nakano M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and Paclitaxel-eluting stents in humans. Circulation, 2014, 129: 211-223.
[6] Tian F, Chen Y, Liu H, et al. Assessment of Characteristics of Neointimal Hyperplasia after Drug-Eluting Stent Implantation in Patients with Diabetes Mellitus: An Optical Coherence Tomography Analysis. Cardiology, 2014, 128: 34-40.
[7] 陈玉善, 张金盈, 关怀敏, 等. 应用光学相干断层成像评价药物洗脱支架术后再发急性冠脉综合征患者的原因. 医药论坛杂志, 2013, 08: 13-15+18.
[8] Nakazawa G, Vorpahl M, Finn AV, et al. One step forward and two steps back with drug-eluting-stents: from preventing restenosis to causing late thrombosis and nouveau atherosclerosis. JACC Cardiovasc Imaging, 2009, 2: 625-628.
[9] Kang SJ, Mintz GS, Park DW, et al. Tissue characterization of in-stent neointima using intravascular ultrasound radiofrequency data analysis. Am J Cardiol, 2010, 106: 1561-1565.
[10] Nakazawa G, Otsuka F, Nakano M, et al. The pathology of neoatherosclerosis in human coronary implants bare-metal and drugeluting stents. J Am Coll Cardiol, 2011, 57: 1314-1322.
[11] Park SJ, Kang SJ, Virmani R, et al. In-stent neoatherosclerosis: a final common pathway of late stent failure. J Am Coll Cardiol, 2012, 59: 2051-2057.
[12] Yonetsu T, Kim JS, Kato K, et al. Comparison of incidence and time course of neoatherosclerosis between bare metal stents and drugeluting stents using optical coherence tomography. Am J Cardiol, 2012, 110: 933-939.
[13] Kang SJ, Mintz GS, Akasaka T, et al. Optical coherence tomographic analysis of in-stent neoatherosclerosis after drug-eluting stent implantation. Circulation, 2011, 123: 2954-2963.
[14] Lee SY, Shin DH, Mintz GS, et al. Optical coherence tomographybased evaluation of in-stent neoatherosclerosis in lesions with more than 50% neointimal cross-sectional area stenosis. EuroIntervention, 2013, 9: 945-951.
[15] Hamid H, Coltart J. 'Miracle stents'-a future without restenosis. McGill journal of medicine, 2007, 10: 105-111.
[16] Kang SJ, Lee CW, Song H, et al. OCT analysis in patients with very late stent thrombosis. JACC Cardiovasc Imaging, 2013, 6: 695-703.
[17] Touchard AG, Schwartz RS. Preclinical restenosis models: challenges and successes. Toxicol Pathol, 2006, 34: 11-18.
[18] Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk. J Am Coll Cardiol, 2006, 48: 193-202.
[19] Pietersma A, Kofflard M, de Wit LE, et al. Late lumen loss after coronary angioplasty is associated with the activation status of circulating phagocytes before treatment. Circulation, 1995, 91: 1320-1325.
[20] Schwartz RS, Holmes DR Jr, Topol EJ. The restenosis paradigm revisited: an alternative proposal for cellular mechanisms. J Am Coll Cardiol, 1992, 20: 1284-1293.
[21] Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med Overseas Ed, 1999, 340: 115-126.
[22] Yin RX, Yang DZ, Wu JZ. Nanoparticle drug- and gene-eluting stents for the prevention and treatment of coronary restenosis. Theranostics, 2014, 4: 175-200.
[23] Toutouzas K, Colombo A, Stefanadis C. Inflammation and restenosis after percutaneous coronary interventions. Eur Heart J, 2004, 25: 1679-1687.
[24] Traub O, Berk BC. Laminar shear stress: mechanisms by which endothelial cells transduce an atheroprotective force. Arterioscler Thromb Vasc Biol, 1998, 18: 677-685.
[25] Park DW, Hong MK, Mintz GS, et al. Two-year follow-up of the quantitative angiographic and volumetric intravascular ultrasound analysis after nonpolymeric paclitaxel-eluting stent implantation: late "catch-up" phenomenon from ASPECT Study. J Am Coll Cardiol, 2006, 48: 2432-2439.
[26] Kimura T, Abe K, Shizuta S, et al. Long-term clinical and angiographic follow-up after coronary stent placement in native coronary arteries. Circulation, 2002, 105: 2986-2991.
[27] Garg S, Bourantas C, Serruys PW. New concepts in the design of drugeluting coronary stents. Nat Rev Cardiol, 2013, 10: 248-260.
[28] Scacciatella P, D'Amico M, Pennone M, et al. Effects of EPC capture stent and CD34+ mobilization in acute myocardial infarction. Minerva cardioangiologica, 2013, 61: 211-219.
[29] 周旭晨, 李田昌, 梁滨, 等. 用冠状动脉造影探讨无聚合物微孔紫杉醇药物洗脱支架置入后近期和远期随访结果. 中国循环杂志, 2010, 25: 329-331.
[30] Kwon JS, Joung H, Kim YS, et al. Sulforaphane inhibits restenosis by suppressing inflammation and the proliferation of vascular smooth muscle cells. Atherosclerosis, 2012, 225: 41-49.
[31] Ribichini F, Tomai F, Pesarini G, et al. Long-term clinical followup of the multicentre, randomized study to test immunosuppressive therapy with oral prednisone for the prevention of restenosis after percutaneous coronary interventions: Cortisone plus BMS or DES veRsus BMS alone to EliminAte Restenosis (CEREA-DES). Eur Heart J, 2013, 34: 1740-1748.
[32] Wang XW, Zhao XJ, Xiang XY. Gene therapy for vein graft failure. J Card Surg, 2013, 28: 144-147.
2014-03-09)
(编辑:常文静)
国家自然基金资助项目(81273943)
450000 河南省郑州市,河南中医学院第一附属医院 心脏中心
罗明华 主治医师 硕士 主要研究方向为冠心病介入诊治 Email:lmhuaaaa@163.com 通讯作者:关怀敏 Email:guanhuaimin2004@aliyun.com
R54
A
1000-3614(2014)10-0848-04
10.3969/j.issn.1000-3614.2014.10.022

