特异性蛋白酶酶解虾副产物制备ACE抑制肽
左 琦,吴秉宇,张建华,钱炳俊
(上海交通大学农业与生物学院,上海200240)
特异性蛋白酶酶解虾副产物制备ACE抑制肽
左 琦,吴秉宇,张建华*,钱炳俊
(上海交通大学农业与生物学院,上海200240)
ACE抑制肽构效关系(QSAR)的研究认为小肽C末端氨基酸的疏水性和其ACE抑制活性之间呈正相关关系。针对性地选择胰凝乳蛋白酶和脯氨酸蛋白酶两步酶解虾副产物制备ACE抑制肽。在一定温度、pH和加酶量条件下,以蛋白质的水解度和ACE抑制率为指标,确定胰凝乳蛋白酶、脯氨酸蛋白酶的最佳酶解时间均为4h。两步酶解产物ACE抑制的IC50值为1.645mg protein/mL。经透析后,得到0~500u(组分1)和500~1000u(组分2)两个组分,组分1和组分2的IC50值分别降为0.333mg peptide/mL和1.320mg peptide/mL。质谱分析结果表明组分1中含有10个肽,分别由5~14个氨基酸组成;组分2中含有15个肽,分别由7~14个氨基酸组成。25个已知序列多肽中有22个多肽的羧基端是脯氨酸或芳香族氨基酸,与预期相符。
α-胰凝乳蛋白酶,脯氨酸蛋白酶,虾副产物,ACE抑制肽
血管紧张素转换酶(ACE)在血压调节中有至关重要的作用,它能将没有活性的血管紧张素I(Asp-Val-Tyr-Ile-His-Pro-Phe-His-Leu)C末端的二肽裂解,使其转换为能促使血压升高的血管紧张素Ⅱ(Asp-Val-Tyr-Ile-His-Pro-Phe)[1]。因此,抑制ACE的活性将能降低血压。
ACE抑制肽构效关系(QSAR)的研究认为,ACE抑制肽的C端氨基酸是与ACE活性部位结合的关键,C末端氨基酸的疏水性和小肽的ACE抑制活性之间正相关[2]。C末端氨基酸为具环状结构的芳香族氨基酸(包括色氨酸、酪氨酸和苯丙氨酸)或脯氨酸的ACE抑制肽,其活性一般较强[3],如Ile-Pro-Pro和Val-Pro-Pro[4]。
目前广泛用于治疗高血压的肽类药物,如卡托普利(Captopril)和赖诺普利(Lasinopril)都是C末端氨基酸为脯氨酸的肽,但都是化学合成品,虽然具有很好的降压效果,但是会引发皮肤病、咳嗽、肾功能衰竭等副作用[5]。近年来,有从乳清[6]、鱼[7]、鸡肉组织[8]和鸡蛋[8]等食物原料中分离得到ACE抑制肽的报道,寻找毒副作用小的食源性ACE抑制肽成为目前的研究热点。
我国虾类资源极为丰富,虾仁加工业比较发达,然而虾仁加工同时产生的大量虾头、虾壳等副产物却没有得到充分的利用[9]。虾副产物中蛋白质的比例较高,若能选用合适的酶对其进行酶解,制备ACE抑制肽,将能提高虾副产物的利用价值。本实验结合前期国内外对功能性寡肽构效关系(QSAR)的研究成果,选择α-胰凝乳蛋白酶和脯氨酸蛋白酶两种特异性蛋白酶酶解虾副产物,有望制备得到羧基端为脯氨酸或芳香族氨基酸的ACE抑制肽。
1 材料与方法
1.1 材料与仪器
南美白对虾 上海海旭水产有限公司;α-胰凝乳蛋白酶 国药集团化学试剂有限公司;脯氨酸蛋白酶 帝斯曼(中国)有限公司;TNBS(三硝基苯磺酸)、血管紧张素转化酶(ACE)、底物(Hippuryl-His-Leu)、肽标准混合物(由Gly-Tyr、Val-Tyr-Val、Tyr-Gly-Gly-Phe-Met、Tyr-Gly-Gly-Phe-Leu、Asp-Arg-Val-Tyr-Ile-His-Pro-Phe组成) 美国Sigma公司;CE透析袋 上海新睿生物科技有限公司。
多功能粉碎机 上海正慧工贸有限公司;DK-8D三孔电热恒温水浴锅 上海齐欣科学仪器有限公司;恒温干燥箱 德国Binder有限公司;UVmini-1240分光光度计 日本岛津仪器有限公司;5415D离心机 德国Eppendorf公司;320 pH计 美国梅特勒-托利多仪器(上海)有限公司;L-8900全自动氨基酸分析仪 日本日立公司;纳升液相色谱-四极杆飞行时间串联质谱联用仪 德国Bruke Dionex公司。
1.2 实验方法
1.2.1 原料准备 南美白对虾剥皮、去头,放于恒温干燥箱中65℃烘干12h,取出粉碎,过60目筛。
1.2.2 酶解条件 α-胰凝乳蛋白酶和脯氨酸蛋白酶的酶解条件[10-11]如表1所示。
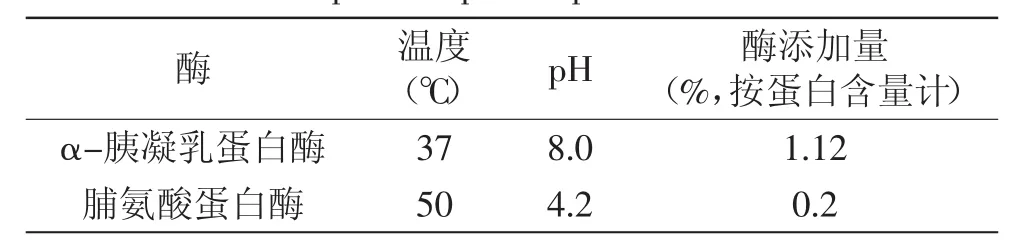
表1 两种酶的酶解条件Table 1 Hydrolysis conditions ofα-chymotrypsin and proline specific protease
1.2.3 蛋白质含量测定和氨基酸分析 称取1.0g样品,加入12mL硫酸和催化剂(硫酸铜和硫酸钾),放在FOSS消化炉上,消化1.5h。然后用自动凯氏定氮仪测定上清液的蛋白质含量[12]。氨基酸分析:氨基酸专用高效液相色谱法[13]。
1.2.4 水解度的测定 参考Adler-Nissen[14]的方法进行改进。在试管中加入2.00mL pH8.2的磷酸盐缓冲液和0.25mL样品混匀,再加入2.00mL 0.10%TNBS溶液摇匀,50℃水浴中避光反应60min后,加入4.00mL(0.10mol/L HCl)终止反应,室温冷却30min后,于340nm波长处测定吸光度。用不同浓度的亮氨酸代替样品做标准曲线。
水解度的计算:
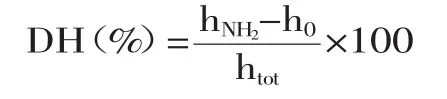
式中:hNH2为反应后氨基态氮浓度(mmol/g);h0为反应前氨基态氮浓度(mmol/g);htot为每克原料蛋白的肽键毫摩尔数(mmol/g),虾壳蛋白htot=8.073(mmol/g)。
1.2.5 ACE抑制率测定 参考Cushman[15]和Li-Chan[16]的方法进行改进。以Hippuryl-His-Leu为底物,测定抑制剂对ACE的抑制活性。试管中加入ACE(酶活力为0.86U/mL)和抑制剂各15μL,37℃水浴5min,然后加入HHL 75μL,37℃水浴45min后,加入1mol/L HCL终止反应。然后加入0.7mL乙酸乙酯萃取、离心(4000r/min,10min),吸取0.5mL乙酸乙酯层于试管中,120℃条件下使乙酸乙酯完全挥发,最后加入2mL去离子水,涡旋混匀后,228nm波长处测定其吸光值。ACE抑制率计算公式:
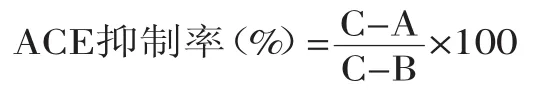
式中:C为ACE与HHL完全反应后的吸光度;A为加入抑制剂和ACE的吸光度;B为加灭活ACE的吸光度。
1.2.6 透析 首先将酶解液装入截留分子量为1000u的透析袋,放入装有去离子水的烧杯中;在磁力搅拌条件下透析6h后,换一次水,再透析4h;将烧杯里的溶液收集起来,得到分子量1000u以下的多肽溶液,45℃旋转蒸发浓缩后,装入截留分子量为500u的透析袋,最后透析得到分子量500~1000u的多肽溶液和分子量500u以下的多肽溶液,45℃旋转蒸发浓缩备用。
1.2.7 多肽含量测定 根据Church[17]的方法进行改进。首先配制50mL OPA溶液:分别加入25mL(100mmol/L)的四硼酸钠、2.5mL 20%(w/w)的十二烷基硫酸钠(SDS)、40mg的OPA(溶解在1mL甲醇中);100μL的β-巯基乙醇,用去离子水定容至50mL。然后取50μL的酶解液与2mL的上述OPA溶液在室温下反应2min于340nm波长处测定吸光度。用不同浓度梯度的肽标准混合物代替酶解液做标准曲线。
1.2.8 质谱条件 负离子模式检测;检测范围为m/z 100~1000;毛细管电压为2800V;样品孔电压为20V;
MCP检测电压为2100V;喷雾气流量为50L/h;脱溶剂气流量为350L/h;脱溶剂温度为300℃;离子源温度为100℃;碰撞能量为25eV。
2 结果与讨论
2.1 虾副产物蛋白质含量及氨基酸组成分析
凯式定氮测得虾副产物蛋白质含量为59.94%± 0.98%,蛋白质含量较高,具备制备ACE抑制肽的基本条件。氨基酸分析结果(见表2)表明,虾副产物中,除去酸水解破坏的色氨酸外,脯氨酸和芳香族氨基酸(酪氨酸和苯丙氨酸)占氨基酸总量的12.28%,从蛋白质含量和氨基酸组成两方面分析,虾副产物是制备ACE抑制肽好的来源。
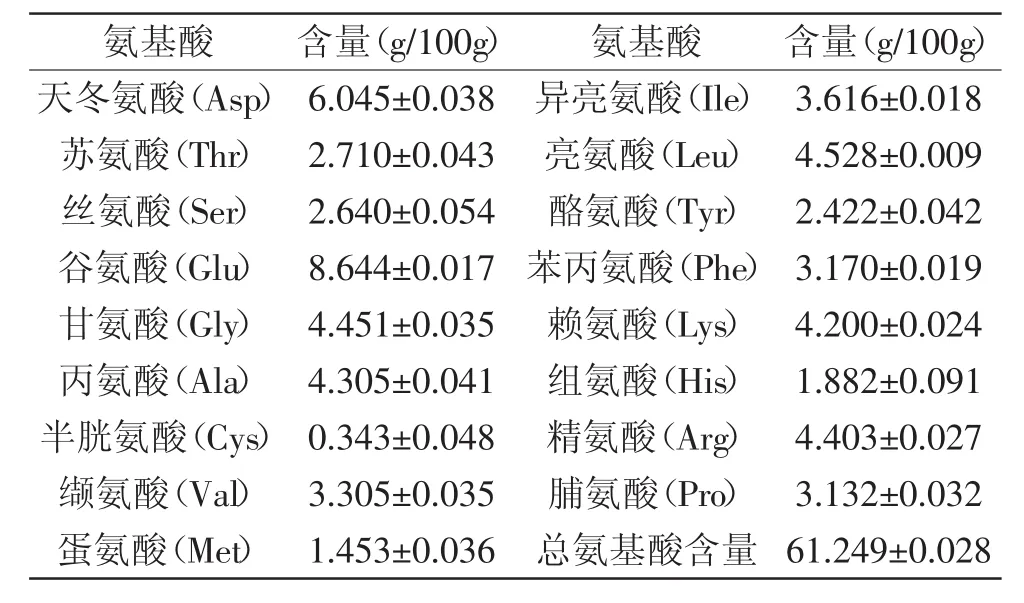
表2 虾副产物氨基酸组成Table 2 Amino acid composition of shrimp byproducts
2.2 α-胰凝乳蛋白酶和脯氨酸蛋白酶酶解时间的确定
α-胰凝乳蛋白酶为内切酶,可从酪氨酸、色氨酸和苯丙氨酸的羧基处切断肽键;脯氨酸特异性蛋白酶则能够在肽链中含有脯氨酸的羧基处切断肽键[10]。蛋白质的水解度代表蛋白质在酶解过程中,肽键被裂解的程度或百分比。根据两种蛋白酶酶解虾副产物的水解时间-水解度曲线确定两种酶的最佳酶解时间。
测定水解度的亮氨酸标准曲线如图1所示,胰凝乳蛋白酶的水解结果如图2所示。
一般认为,1个亮氨酸分子含有1个α-氨基,由此可将α-氨基的浓度转化为亮氨酸的浓度,在进行酶解液水解度测定时就可以根据图1得到酶解过程中产生的α-氨基,从而计算出相应的水解度。
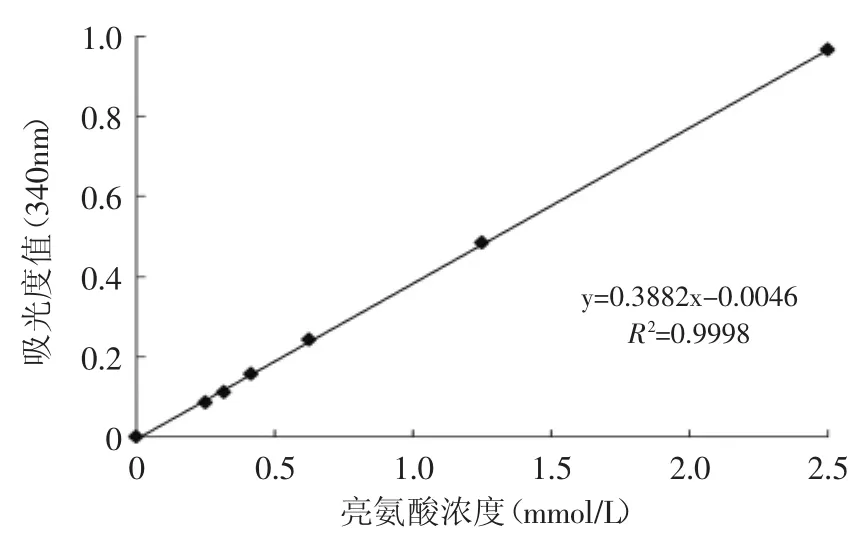
图1 亮氨酸标准曲线Fig.1 Standard curve of Leucine
由图2可知,在0~30min之内,水解度的增加速率很快,这可能是在最初的30min内蛋白质中可断裂的肽键较多,水解度提高快,而随着时间的推移,酶可作用的肽键数目减少,水解速率下降,到4h水解度达到11%后,水解度保持不变,说明此时蛋白已经被完全水解。选择蛋白的水解终点,可以保证充分水解,便于后续分离得到小肽。因此,第一步酶解时间的确定,只需考虑水解充分性的因素,选择4h时间点。而第二步酶解时间的确定,则需要综合考虑酶解的充分性和ACE抑制率。
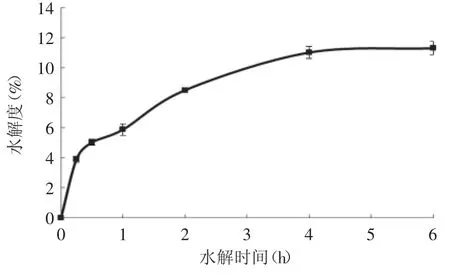
图2 虾副产物胰凝乳蛋白酶水解曲线Fig.2 Hydrolysis curve of shrimp byproduct by α-chymotrypsin
2.3 两步酶解产物ACE抑制活性的变化
脯氨酸蛋白酶的水解度和ACE抑制活性的变化如图3所示。
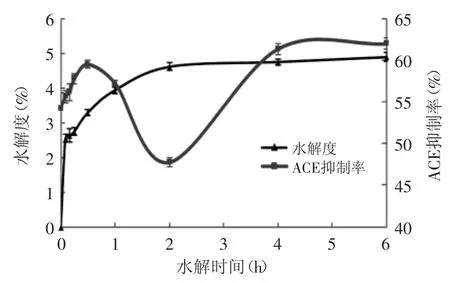
图3 脯氨酸蛋白酶水解度曲线和酶解液的ACE抑制活性Fig.3 Degree of hydrolysis and ACE inhibitory activity of proline specific proteases hydrolysate
由图3可知,在4h水解度达到4.74%以后,水解度保持不变,说明此时间点是脯氨酸蛋白酶的水解终点。脯氨酸蛋白酶酶解之后,进行ACE抑制活性测定。由图3可知,随着酶解时间的延长,ACE抑制率先上升,后下降,最后又上升。中间ACE抑制率的下降,可能是由于本来有抑制活性的大分子肽被酶解产生了无ACE抑制作用的小分子肽[18]。而随着酶解的进行,这些肽进一步被酶解成分子量更小的肽,其具有较高的ACE抑制率,当然,也有可能是肽浓度的增大,使ACE抑制率随之增大。根据结果得知,4h酶解时间的酶解液ACE抑制率最高,为61.30%,IC50为1.645mg/mL,选择此时间点的酶解液来进行后续实验。
2.4 透析后不同截留分子量透析液的ACE抑制活性
已有的研究结果表明,具有ACE抑制活性的肽,一般含有2~12个氨基酸,即分子量范围在256~1500u之间[19]。因此,选择截留分子质量1000u和500u的透析袋透析后,可以得到2个组分:组分1的分子质量小于500u,组分2的分子质量在500~1000u范围内。由于透析之后,去掉了分子量大于1000u以上的肽,所以要确定透析之后酶解液的肽浓度。测定肽浓度的标准曲线如图4所示。
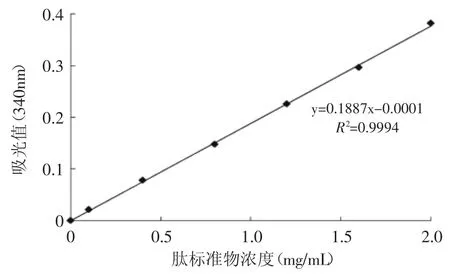
图4 多肽标准曲线Fig.4 Standard curve of peptide mixture
图4中所指的肽标准混合物是由Gly-Tyr、Val-Tyr-Val、Tyr-Gly-Gly-Phe-Met、Tyr-Gly-Gly-Phe-Leu、Asp-Arg-Val-Tyr-Ile-His-Pro-Phe构成的混合物,这5个肽分别由2~8个氨基酸组成。用此混合物作为标准底测定透析液中的肽含量,可以比较精确的定量肽含量。标准曲线中,肽标准物浓度和吸光度值的相关系数R2=0.9994,线性相关性较强,可用公式y= 0.1887x-0.0001计算透析后透析液的肽浓度。
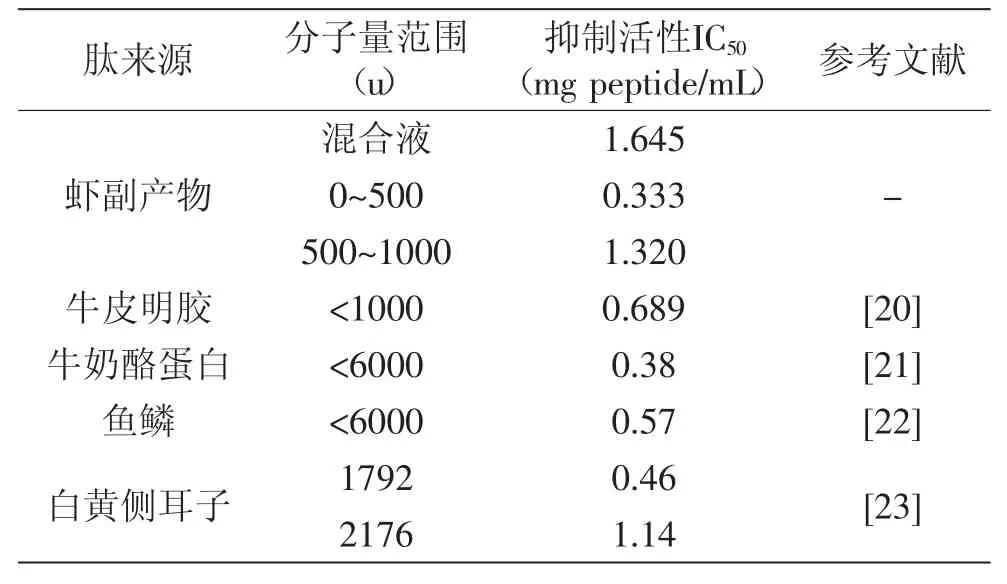
表3 透析产物和不同食物来源酶解肽的ACE抑制率IC50Table 3 ACE inhibitory peptides derived from different food proteins
由表3可知,未透析前,两步酶解产物的IC50值为1.645mg protein/mL,经过透析之后:组分1(0~500u)和组分2(500~1000u)的IC50值分别降为0.333mg peptide/ mL和1.320mg peptide/mL,可见透析分离后,IC50值有所下降。尤其是分子量为0~500u的肽,其IC50有较大程度的下降,表明经过透析,去掉了大分子的肽,得到分子量较小的肽,这些肽具有更高的ACE抑制活性。
由表3的对比可发现,虾副产物酶解液经过透析之后,分子量小于500u的透析液,其ACE抑制的IC50值低于以往研究中得到的食源性肽。说明虾副产物经过特异性蛋白酶的两步酶解,能制得ACE抑制率较高(IC50值低)的肽。
2.5 质谱分析结果
由表4可知,通过胰凝乳蛋白酶和脯氨酸蛋白酶两步酶解之后,组分1中含有10个肽,分别由5~14个氨基酸组成;组分2中含有15个肽,分别由7~14个氨基酸组成。25个已知序列多肽中只有EGGEL,VVIMTSHGNEQL,MSFQDSNNDGIGDL这3个多肽的羧基端不是脯氨酸或芳香族氨基酸,与文献[13]报道的ACE抑制性较强肽的羧基端应具有的结构相符合。

表4 两组分中多肽的组成Table 4 Composition of peptides in component 1 and 2
然而,得到的这22个羧基端是脯氨酸或芳香族氨基酸的肽,除了MIAMFMF、GKHLHTF、CYTEEVF这三个肽为7肽,其余19个肽都含有8个或8个以上的氨基酸。人体摄入之后,仍有可能被体内消化酶酶解。因此有必要模拟人体胃肠道消化,再对其进一步酶解。一方面考察这些肽经过消化酶酶解之后的活性变化,另一方面有望从中分离得到ACE抑制活性更高的肽。
3 结论
本文用胰凝乳蛋白酶—脯氨酸蛋白酶对虾副产物进行酶解,通过透析分离和质谱分析证实得到了一些C末端为芳香族氨基酸或脯氨酸的小分子肽,说明该酶解体系有望获得ACE抑制活性高的肽。但两步酶解的肽多为七肽以上,因此有必要模拟人体胃肠道消化,再对这些肽进一步酶解,一方面考察这些肽经过消化酶酶解之后的活性变化,另一方面有望从中分离得到ACE抑制活性更高的肽。
[1]Ghassem M,Arihara K,Babji A S,et al.Purification and identification of ACE inhibitory peptide from Harua(Channa striatus)myofibrillar protein hydrolysate using HPLC-ESI-TOF MS/MS[J].Food Chemistry,2011,129:1770-1777.
[2]Pripp A H,Isaksson T,Stepaniak L,et al.Quantitative structure-activity relationship modeling of ACE-inhibitory peptides derived from milk proteins[J].European Food Researchand Technology,2004,219:579-583.
[3]Cheung H S,Wang F L,Ondetti M A,et al.Binding of peptide substrates and inhibitors of angiotensin-converting enzyme.Importance of the COOH-terminal dipeptide sequence [J].Journal of Biological Chemistry,1980,255:401-407.
[4]Foltz M,Cerstiaens A,Mols R,et al.The angiotensin converting enzyme inhibitory tripeptides Ile-Pro-Pro and Val-Pro-Pro show increasing permeabilities with increasing physiological relevance of absorption models[J].Peptides,2008,29:1312-1320.
[5]Israaili Z H,Hall W D.Cough and angioneurotic edema associated with angiotensin converting enzyme inhibitor therapy:A review of the literature and pathophysiology[J].Annals of Internal Medicine,1992,117(3):234-242.
[6]Hernández Ledesma B,Recio I,Ramos M,et al.Preparation of ovine and caprine-lactoglobulin hydrolysates with ACE-inhibitory activity.Identification of active peptides from caprine β-lactoglobulin hydrolysed with thermolysin[J].International Dairy Journal,2002,12:805-812.
[7]Curis J M,Dennes D,Waddell D S,et al.Determination of angiotensin-converting enzyme inhibitory peptide Leu-Lys-Pro-Asn-Met(LKPNM)in bonito muscle hydrolysates by LC-MS/MS [J].Journal of Agricultural and Food Chemistry,2002,50:3919-3925.
[8]Rao S Q,Ju T,Sun J,et al.Purification and characterization of angiotensin I-converting enzyme inhibitory peptides from enzymatic hydrolysate of hen egg white lysozyme[J].Food Research International,2012,46:127-134.
[9]王润莲,张政军,梁沛琼.虾、蟹、螺副产物的营养价值[J].饲料研究,2006:61-62.
[10]彼得吕斯·雅各布斯·西奥多瑞,斯·蒂克尔,鲁波·伊第恩斯.来自Penicillium chrysogenum的脯氨酸特异性蛋白酶:中国,200980120102.4[P].2011-05-04.
[11]Kim S K,Wijesekara I.Developmentand biological activities of marine-derived bioactive peptides:A review[J]. Journal of Functional Foods,2010(2):1-9.
[12]中华人民共和国卫生部.GB 5009.5-2010食品中蛋白质的测定[P].北京:中国标准出版社,2010.
[13]刘长虹.食品分析及实验[M].北京:化学工业出版社,2006:81-110,204-205.
[14]Adler Nissen J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J]. Journal of Agricultural and Food Chemistry,1979,27:1256-1262.
[15]Cushman D W,Cheung H S.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemistry Pharmacology,1971,20:1637-1648.
[16]Lo W M Y,Li-Chan E C Y.Angiotensin I converting enzyme inhibitory peptides from in vitro pepsin-pancreatin digestion of soy protein[J].Journal of Agricultural and Food Chemistry,2005,53:3369-3376.
[17]Church F C,Swaisgood H E,Porter D H,et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science,1983,66:1219-1227.
[18]Theodore A E,Kristinsson H G.Angiotensin converting enzyme inhibition of fish protein hydrolysates prepared from alkaline-aided channel catfish protein isolate[J].Journal of the Science of Food and Agriculture,2007,87:2353-2357.
[19]Li G H,Le G W,Shi Y H,et al.Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J].Nutrition Research,2004,24:469-486.
[20]Kim S K,Byun H G,Park P J,et al.Angiotensin I converting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry,2001,49:2992-2997.
[21]Jiang J L,Chen S W,Ren F Z.Milk casein as a functional ingredient:Preparation and identification of angiotensin-I-converting enzyme inhibitory peptides[J].JournalofDairy Research,2007,74:18-25.
[22]Fahmi A,Morimura S,Guob H C,et al.Production of angiotensin I converting enzyme inhibitory peptides from sea bream scales[J].Process Biochemistry,2004,39:1195-1200.
[23]Jang J H,Jeong S C,Kim J H,et al.Characterization of a new antihypertensive angiotensin I-converting enzyme inhibitory peptide from Pleurotus cornucopiae[J].Food Chemistry,2011,127:412-418.
Preparation of angiotensin I-converting enzyme inhibitory peptides derived from shrimp byproduct by specific enzyme hydrolysis method
ZUO Qi,WU Bing-yu,ZHANG Jian-hua*,QIAN Bing-jun
(School of Agriculture and Biology,Shanghai Jiaotong University,Shanghai 200240,China)
Based on the quantitative structure-activity relationship and predictive models of angiotensin I-converting enzyme(ACE)inhibitory peptide,hydrophobic amino acid residues at C-terminal are positively correlated with ACE inhibitory activity.In order to get more proline and hydrophobic amino acid residues at C terminal,α-chymotrypsin and proline protease were chosen to hydrolyse the shrimp byproducts to produce ACE inhibitory peptides.The hydrolysis times were optimized according to the hydrolysis degree(HD)for α-chymotrypsin,and both HD and ACE-inhibitory activity for proline protease,the results showed that the optimal hydrolysis time for both enzyme were 4 hours.The half maximal inhibitory concentration(IC50)for ACE inhibition of hydrolysate was 1.645mg protein/mL.The hydrolysate was separated into fraction 1(0~500u)and fraction 2(500~1000u)by molecular weight cut-off(MWCO)membrane.The IC50value of fraction 1 and fraction 2 were 0.333mg peptide/mL and 1.320mg peptide/mL,respectively.The peptide mixtures were analyzed by time-of-flight mass spectrometry.Ten peptides,which were consisted of peptides with 5 to 14 amino acid residues,were identified in fraction 1.Fifteen peptides,which were consisted of peptides with 7 to 14 amino acid residues were identified in fraction 2.The C-terminal amino acids of 22 out of the 25 peptides were proline or aromatic amino acid,which was corresponding to QSAR results.
α-chymotrypsin;proline protease;shrimp byproducts;ACE inhibitory peptides
TS201.1
A
1002-0306(2014)10-0181-05
10.13386/j.issn1002-0306.2014.10.032
2013-09-02 *通讯联系人
左琦(1988-),女,硕士研究生,研究方向:食品科学。
国家海洋局海洋公益性行业科研专项经费项目(201205031-05)。

