超声辅助提取工艺中pH对苹果果胶品质的影响
窦 姣,郭玉蓉,薛战锋,李 洁,陈玮琦,张晓瑞
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
超声辅助提取工艺中pH对苹果果胶品质的影响
窦 姣,郭玉蓉*,薛战锋,李 洁,陈玮琦,张晓瑞
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
为了研究pH对苹果果胶品质的影响,利用不同pH的盐酸溶液对苹果渣中的果胶进行超声辅助提取,并对果胶品质进行了评估。结果表明:超声辅助提取工艺中pH对所得果胶的品质有显著影响,在pH1.00~2.00范围内,随着pH的升高,果胶得率、多酚含量呈现先增大后减小的趋势,半乳糖醛酸含量逐渐减少,酯化度、特性粘度和粘均分子量均呈逐渐增大的趋势。红外谱图显示:不同pH条件下所得苹果果胶结构基本一致,均具有糖类物质的特征吸收峰。
苹果果胶,超声波,提取,pH,品质
果胶是一类相对分子质量在1~40万之间的多糖聚合物,其主要结构是以α-1,4-糖苷键连接而成的多聚半乳糖醛酸链[1]。果胶是一种完全无毒的天然食品添加剂,广泛用于食品工业,主要作为凝胶剂、稳定剂和增稠剂,可显著提高食品品质[2]。果胶的酯化度和半乳糖醛酸含量分别决定了它的凝胶特性和纯度,被认为是判定果胶品质的一个重要指标[3]。目前,我国对果胶的需求呈高速增长趋势,但商品果胶的来源非常有限。据资料显示,干苹果渣中含有15%~18%的果胶,因此苹果渣可以作为提取果胶的来源之一,而且果胶具有非常可观的市场价格,提取、利用苹果果胶对于实现资源综合利用,提高产品附加值以及减少环境污染具有重要的意义[4]。
以苹果渣为原料提取果胶,提取条件是影响果胶品质的重要因素。研究发现超声辅助提取法可以极大地提高苹果果胶得率、缩短提取时间、提高果胶纯度,其中pH是果胶提取的一个重要参数[5]。目前,对超声辅助提取果胶工艺的研究主要集中在提取工艺的优化及与传统提取工艺的对比等方面[6-7],并没有深入探讨各因素对苹果果胶品质的影响。因此,本文以pH的变化为主要因素,研究了超声辅助提取过程中不同pH对苹果果胶品质的影响,为超声辅助提取技术在果胶产业化中的应用提供一定的技术支撑。
1 材料与方法
1.1 材料与仪器
苹果渣(水分含量12%左右) 陕西师范大学冷破碎制汁生产线提供;无水乙醇、浓HCl、Na2HPO4、NaH2PO4、半乳糖醛酸、NaOH、咔唑、浓H2SO4、酚酞、没食子酸、福林酚、无水Na2CO3均为分析纯。
EQUINX55型傅里叶变换红外光谱仪 德国Brucher公司;CR-400/410型色彩色差计 柯尼卡美能达投资有限公司;RE 52-99型旋转蒸发仪 上海亚荣生化仪器厂;LGJ-18C型冷冻干燥机 北京四环科学仪器厂;WFJ2100型分光光度计 尤尼科仪器有限公司上海分公司;PHS-3C型精密pH计 上海精密科学仪器有限公司;高速万能粉碎机 北京科伟永兴仪器有限公司;乌氏粘度计 上海EHSY西域仪器公司;DD-5M型低速大容量离心机 长沙平凡仪器仪表有限公司。
1.2 实验方法
1.2.1 苹果果胶的超声波辅助提取工艺 苹果渣→55℃干燥→粉碎(过60目筛)→分别加入pH为1.00、1.25、1.50、1.75、2.00的HCl溶液超声辅助提取(料液比1∶25,温度45℃,时间40min,功率180W)→离心20min(4000r/min)→上清液浓缩(至原体积的1/4)→95%乙醇沉淀(4℃,静置过夜)→真空冷冻干燥→苹果果胶→粉碎(过60目筛)备用。
1.2.2 苹果果胶酯化度(degree of esterification,DE)的测定 果胶酯化度即果胶中的甲氧基含量,采用双滴定法测定[8]。准确称取0.2g果胶样品移入250mL锥形瓶中,用乙醇润湿,加入20mL 40℃不含CO2的蒸馏水,用瓶塞塞紧,摇匀振荡,完全溶解后加1%的酚酞指示剂3滴,用0.1mol/L的NaOH标准溶液进行标定至粉红色,记录所消耗NaOH的体积(V1)即为初滴定度。继续加入10mL 0.1mol/L的NaOH标准溶液,加塞后强烈振荡2h,加入10mL 0.1mol/L的盐酸溶液,摇匀至粉红色消失为止。然后加入3滴酚酞指示剂,用0.1mol/L NaOH溶液滴定至呈微红色。记录所消耗NaOH的体积(V2),即为皂化滴定度。果胶酯化度计算公式如下:
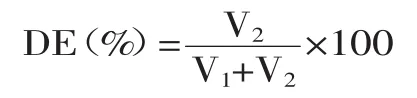
式中:V1为样品溶液的初滴定度(mL);V2为样品溶液的皂化滴定度(mL)。
1.2.3 苹果果胶半乳糖醛酸含量的测定 果胶的纯度以果胶中多聚半乳糖醛酸的含量(GA)为评判标准,用咔唑比色法测定[9]。果胶经水解,其产物半乳糖醛酸可在强酸环境下与咔唑试剂产生缩合反应,生成紫红色化合物,其呈色深浅与半乳糖醛酸含量成正比,因此可在530nm下比色测定。
1.2.3.1 标准曲线的制作 精确称取0.1g半乳糖醛酸标品,溶于蒸馏水中,定容至100mL,得到浓度为1mg/mL的溶液。分别取上述半乳糖醛酸溶液1、2、4、6、8、10mL置于100mL容量瓶中,加水定容至100mL,得到浓度为10、20、40、60、80、100μg/mL的溶液备用。分别吸取不同浓度的标准溶液1mL置于比色管中,各加入6mL浓H2SO4混匀,沸水浴20min,取出后快速冷却至室温,加入0.15%的咔唑-乙醇溶液0.2mL,混匀,暗处放置2h。在530nm处测定吸光值,绘制标准曲线。
1.2.3.2 样品的测定 称取0.1g果胶样品溶于50mL去离子水中,将样品溶液稀释20倍,取1mL加入25mL比色管中,加入6mL浓H2SO4混匀,沸水浴20min,取出后快速冷却至室温,加入0.15%的咔唑-乙醇溶液0.2mL,混匀,暗处放置2h。在530nm处测吸光值,根据半乳糖醛酸标准曲线,计算相应的半乳糖醛酸含量。果胶中半乳糖醛酸含量的计算公式为:

式中:C为对照标曲求得的果胶稀释液的半乳糖醛酸含量(μg/mL);V为果胶提取液原液体积(mL);A为果胶提取液的稀释倍数;W为样品质量(g);106为质量单位换算系数。
1.2.4 苹果果胶总酚含量的测定 焦性没食子酸标准曲线的制作:分别配制浓度为10、20、30、40、50μg/mL的焦性没食子酸溶液,分别吸取2mL的各标准溶液于25mL棕色容量瓶中,加入12mL的饱和Na2CO3溶液和1mL的福林酚试剂,室温,置于暗处静止反应1h,用可见分光光度计在765nm处测定吸光值[10-11]。
准确称取0.1g果胶样品溶于10mL棕色容量瓶中,取2mL样品溶液于25mL棕色容量瓶中,分别加入12mL饱和Na2CO3溶液和1mL的福林酚试剂,加水定容至刻度,置于暗处静止反应1h,765nm处测定其吸光值。
1.2.5 苹果果胶色值的测定 采用CR-400/410型色彩色差计测定苹果果胶的色值。其中L*值代表亮度,a*值代表红值,b*值代表黄值,C*值代表彩度值,h代表色调角[12]。
1.2.6 苹果果胶特性粘度和黏均分子量的测定 用0.1mol/L的磷酸缓冲液将果胶样品分别配制为浓度在0.1~0.8g/100mL范围内的溶液。用乌氏粘度计分别测定不同浓度果胶溶液和溶剂的绝对粘度η和η0,单位为mPa·s每次测定三次,取平均值[13]。计算相对粘度ηr和增比粘度ηsp,计算过程中ηr值在1.2~2.0范围内有效。反映了比浓粘度与比浓对数粘度与溶液浓度之间的关系。经验公式:

1.2.7 苹果果胶红外光谱分析 将1mg干燥果胶样品与100mg KBr置于干燥的玛瑙研钵中混合研磨压片,采用傅里叶变换红外光谱仪在4000~400cm-1区间对果胶样品进行红外光谱扫描,观察谱峰情况[14-15]。
1.3 数据处理和统计方法
所有实验均进行3次重复。实验结果采用“DPS 7.05”统计软件进行统计分析,Excel软件绘图制表。不同处理间的数据采用多重比较的方法进行显著性分析,显著水平为0.05。
2 结果与分析
2.1 超声辅助提取中pH对苹果果胶得率的影响
由图1可知,超声辅助提取中pH对苹果果胶得率有显著(p<0.05)影响。随着pH增加,苹果果胶得率呈现先增加后减小的趋势,pH1.50时果胶得率最大,与刘超等[16]研究结果一致。原因可能为高酸度损坏细胞结构,并导致细胞壁上的原果胶降解,当提取液的pH为1.50时,苹果渣中的原果胶水解强烈,果胶得率最高;当提取液的pH大于1.50时,果胶未充分溶出,得率降低;当提取液的pH小于1.50时,过高的酸度使果胶的半乳糖醛酸分子结构被破坏,果胶脱酸裂解,产品得率降低[17]。因此,当提取液的pH为1.50时,果胶得率最大。

图1 pH对苹果果胶得率的影响Fig.1 Effect of pH on the yield of apple pectin
2.2 超声辅助提取中pH对苹果果胶酯化度的影响
由图2可知,超声辅助提取中pH对苹果果胶酯化度有显著(p<0.05)影响,随着pH的升高,酯化度由66.1%显著增加到77.4%,果胶类型由高酯中凝果胶变为高酯超快凝果胶,凝胶强度越来越大。原因可能为:低pH条件下,果胶半乳糖醛酸链上的酯化键比α(1→4)糖苷键更易发生酸性水解,因此pH1.00时果胶样品的酯化度低于pH2.00时的酯化度,这一研究结果与曹敏霞等的研究结果一致[18]。

图2 pH对苹果果胶酯化度的影响Fig.2 Effect of pH on the degree of esterification of apple pectin
2.3 超声辅助提取中pH对苹果果胶半乳糖醛酸含量的影响
根据咔唑比色法,绘制出以半乳糖醛酸含量为横坐标(单位:μg/mL),以530nm处溶液的吸光度值为纵坐标的标准曲线,如图3所示,标曲方程为:y= 0.0051x+0.008(R2=0.9991)。
由图4可知,超声辅助提取中pH对苹果果胶半乳糖醛酸含量有显著(p<0.05)影响。随着pH降低,苹果果胶的半乳糖醛酸含量由65.1%显著增加到72.9%,表明果胶纯度随pH降低而增大,因为低pH条件下,提取果胶的同时会使苹果渣中的纤维素、淀粉等杂质水解为不能被乙醇沉淀的小分子多糖,进而使果胶的纯度提高,而随着果胶的pH逐渐增大,纤维素等杂质继续被乙醇沉淀,导致果胶纯度降低[17-18]。
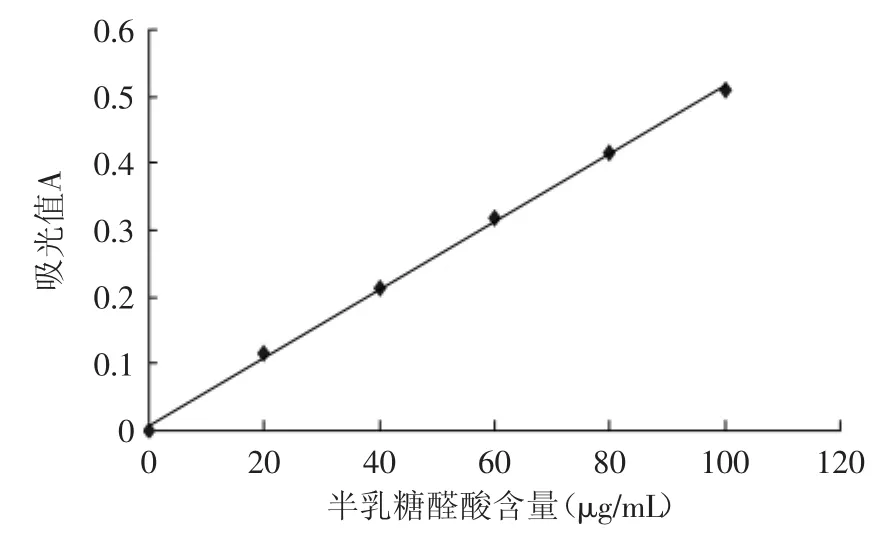
图3 半乳糖醛酸标准曲线Fig.3 The standard curve of galacturonic acid
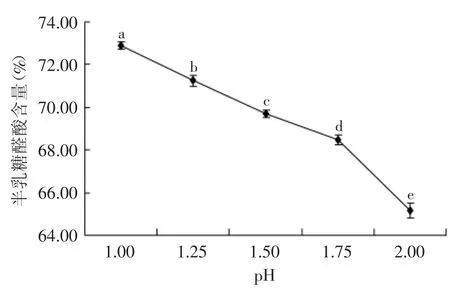
图4 pH对苹果果胶半乳糖醛酸含量的影响Fig.4 Effect of pH on the galacturonic acid content of apple pectin
2.4 超声辅助提取中pH对苹果果胶总酚含量的影响
由图5可以得出,pH对苹果果胶总酚含量有显著(p<0.05)影响。随着pH不断升高,总酚含量呈现先增加后减小的趋势,当pH为1.50时,总酚含量达到最高。原因可能为:高酸度促进了多酚物质的溶出,进而使总酚含量升高;而当酸度过低时,部分多酚物质被破坏导致含量降低[19]。因此,pH1.50时总酚含量最高。
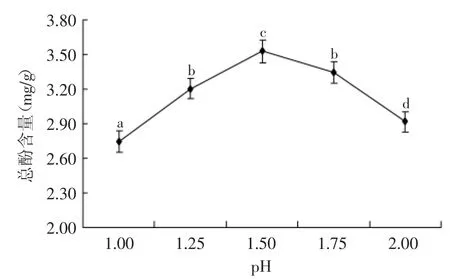
图5 pH对苹果果胶总酚含量的影响Fig.5 Effect of pH on the content of total polyphenol of apple pectin

表1 pH对超声辅助提取苹果果胶色差的影响Table 1 Effect of pH on the colour values of apple pectin extracted by ultrasonic wave
2.5 超声辅助提取中pH对苹果果胶色差的影响
根据色差分析的原理可知,L*表示样品的亮度值;a*表示红值,a*值越大表示样品越红;b*表示黄值,b*值越大表示样品越黄;C*表示样品的彩度值,C*越大表示样品颜色越纯,h表示色调角,h值越大表示红色减弱,黄色增强[19]。由表1可知,苹果果胶的色差值随pH变化显著(p<0.05),亮度值、黄值和色调角均随着pH的升高呈上升趋势;红值随pH升高呈下降趋势;彩度值随pH升高呈现先增加后减小的趋势,当pH为1.25时,彩度值最大,而pH1.25与pH1.50的彩度值差异不显著,当pH为1.50时酸度较低,所以,选择pH 1.50时所得果胶颜色更纯正,更单一。
2.6 超声辅助提取中pH对苹果果胶特性粘度和黏均分子量的影响
根据Huggins和Kramer方程拟合确定特性粘度[η],通过外推法获得Huggins特性粘度和Kramer特性粘度,分别以两种特性粘度为依据,根据经验公式[η]= kMηα计算果胶样品的黏均分子量。图6、图7分别为根据Huggins和Kramer经验方程所得到的比浓粘度和比浓对数粘度。特性粘度和粘均分子量计算结果见表2。
理论上,Huggins和Kramer两条曲线在Y轴的截距应归于一点,但由图6、图7可以看出作图会出现异常情况,这可能会与聚合物在溶液中的形态及本身的结构有关。对于这种情况应以作图来确定聚合物溶液的特性粘度[η],因为Huggins方程中的k值与和聚合物的形态和结构有关,具有明确的物理意义,而Kramer为数学计算式,不具有明确意义[20]。
由图6、图7可以看出,苹果果胶的比浓粘度与比浓对数粘度均随pH的升高而增大,在相同pH条件下,比浓粘度与比浓对数粘度均随浓度升高而增大,在一定的浓度范围内表现出量效关系。由表2可知,苹果果胶的粘均分子量随pH的升高而增大,与比浓粘度和比浓对数粘度具有相同的趋势,原因可能有两方面:一方面是由于低pH条件可以加速果胶的降解,易使果胶中半乳糖醛酸链的α(1→4)糖苷键发生水解,果胶分子链被破坏,从而使分子量减小;另一方面可能是因为超声波打断了果胶内部的分子结构,促进了苹果果胶的降解,导致分子量减少。

图6 利用Huggins方程判定苹果果胶的比浓粘度Fig.6 Intrinsic viscosity of apple pectin by extrapolation tozero concentration with Huggins equations

图7 利用Kramer方程判定苹果果胶的比浓粘度Fig.7 Intrinsic viscosity of apple pectin by extrapolation to zero concentration with Kramer equations
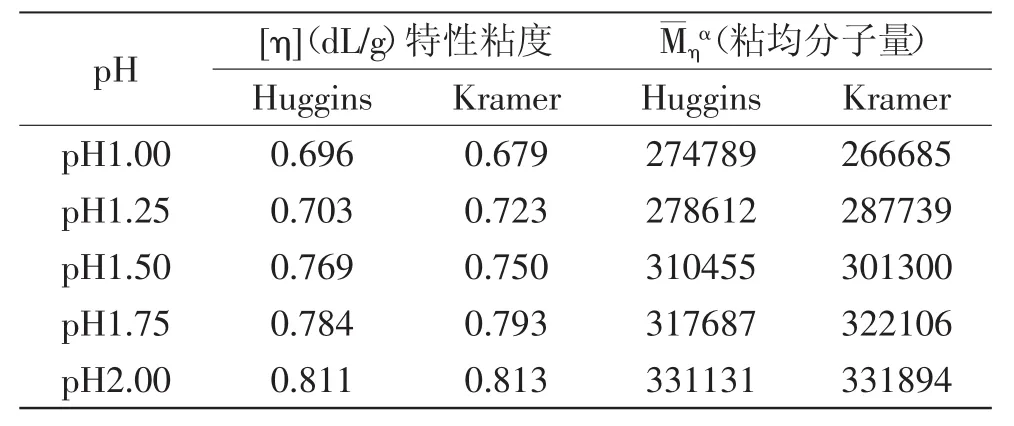
表2 pH对苹果果胶固有黏度和黏均分子量的影响Table 2 Effect of pH on the intrinsic viscosity and average molecular weight of apple pectin
2.7 苹果果胶的红外光谱及解析
不同pH条件下所提果胶的红外谱图见图8。红外光谱图显示,不同pH条件下提取的苹果果胶在400~4000cm-1范围内具有糖类的特征吸收峰。2500~3600cm-1范围内的宽峰是分子内或分子间的O-H伸缩振动的结果,2934cm-1附近的吸收峰是由C-H(CH、CH2和CH3)伸缩振动引起的,1730~1760cm-1范围内的吸收峰为糖醛酸羧基中的酯键(-COOR)C-O的伸缩振动,1730cm-1附近的吸收峰,说明果胶中含有酸性糖,1600~1630cm-1范围内的吸收峰为游离羧酸或羧酸盐(-COO-)的不对称伸缩振动吸收峰,同时也是糖的水化物样品的吸收峰,1000~1300cm-1范围内的强吸收峰是由C-O伸缩振动引起的,1150、1100、1020cm-1附近的吸收峰为果胶中半乳糖醛酸在指纹区的特征吸收峰[21-22]。由图8可知,5种样品果胶的吸收峰基本一致,说明超声辅助提取中不同pH条件对苹果果胶的结构影响不大。
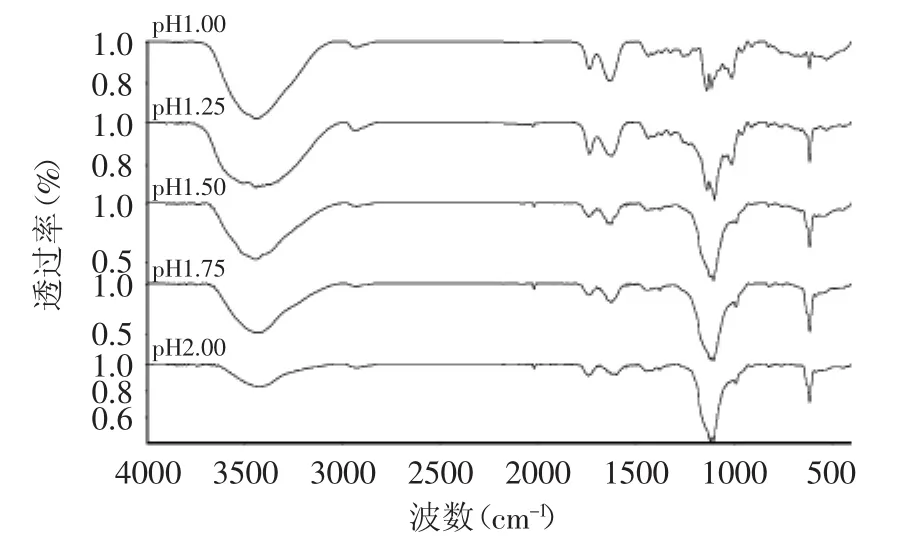
图8 不同pH提取果胶的红外光谱图Fig.8 Fourier transforms infrared spectra of apple pectin extracted from different pH
3 结论
超声辅助提取工艺中,不同pH对苹果果胶得率及果胶品质均有显著影响。果胶得率和总酚含量均随pH升高呈现先增大后减小的趋势,果胶纯度随pH升高呈现逐渐减少的趋势,酯化度、特性粘度和粘均分子量均呈逐渐增大的趋势。苹果果胶的色差值随pH变化显著(p<0.05),亮度值、黄值和色调角均随着pH的升高呈上升趋势;红值随pH升高呈下降趋势;彩度值随pH升高呈现先增加后减小的趋势。红外谱图显示,不同pH条件下提取的果胶样品均具有果胶物质的特征吸收峰。
综合考虑各项指标,可以得出:不同pH条件下所得苹果果胶的品质各不相同,具有不同的特性,可根据自身特点应用于不同的产品中。超声辅助提取作为一种新颖、快速的提取工艺,在未来苹果果胶的提取及应用过程中将具有更大的发展空间。
[1]Wieslaw Jedrychowshi,Umberto Maugeri,Agnieszka Pac,et al.Reduced risk of colorectal cancer and regular consumption of apples:Hospital based case-control study in Poland[J].Central European Journal of Medicine,2009,4(3):320-326.
[2]天津轻工业大学.食品生物化学[M].北京:中国轻工业出版社,1994.
[3]Kratchanova M E,Pavlova I.The effect of microwave heating of fresh orange peels on fruit tissues and quality of extracted pectin[J].Carbohydrate polymers,2004,56:181-185.
[4]孙立军,郭玉蓉,田兰兰.苹果果胶研究进展[J].食品工业科技,2012,33(4):445-449.
[5]Constenla D,Ponce A G,Lozano J E.Kinetic model of pectin demethylation[J].Latin American Applied Research,2003,33:91-96.
[6]Levigne S,Ralet M C,Thibault J F.Characterization of pectins extracted from fresh sugar beet under different conditions using an experimental design[J].Carbohydrate polymers,2002,49:145-153.
[7]Homa Bagherian,Farzin Zokaee Ashtiani,Amir Fouladitajar,etal.Comparison between conventional,microwave- and ultrasound-assisted methodsforextraction ofpectin from grapefruit[J].Chemical Engineering and Processing,2011,50:1237-1243.
[8]仇农学,田玉霞,邓红,等.超滤法分离苹果果胶及其理化性质[J].中国农业科学,2009,42(10):3609-3616.
[9]田玉霞.苹果渣中果胶的超声波辅助提取及基于不同分子量级的特性表征[D].西安:陕西师范大学,2010.
[10]邱涛涛,王华,毛世红.石榴叶总酚测定及提取工艺研究[J].食品科学,2009,30(10):131-134.
[11]Luan Yan.Measurement of apple polyphenols and study on extraction and purification of polyphenols[D].Beijing:China Agriculture University,2003.
[12]刘燕琼,黄雪松.大蒜多糖的粘度性质[J].食品研究与开发,2007,28(12):14-15.
[13]Berardini N,Knodler M,Schieber A,et al.Utilization of mango peels as a source of pectin and polyphenolics[J].Innovation Food Science and Emerging Technologies,2005(6):442-452.
[14]邸铮.苹果皮渣中果胶的提取及性质研究[D].北京:中国农业大学,2008.
[15]鲁慧芳,丁长河,侯丽芬,等.苹果渣中果胶提取条件及其分子质量的测定研究[J].食品与发酵工业,2007,33(6):154-157.
[16]刘超,李钐,韩玉谦.超声波提取苹果果胶工艺优化及凝胶特性研究[J].食品研究与开发,2012,33(12):46-49.
[17]马惠玲,盛义保,张丽萍,等.苹果渣果胶多糖的分离纯化与抗氧化活性研究[J].农业工程学报,2008,24(1):218-222.
[18]曹敏霞,周林燕,吴继红,等.微波辅助提取中pH与脱色对苹果果胶的影响[J].农业工程学报,2010,26(2):410-415.
[19]吴继红,彭凯,张燕.传统与微波辅助提取苹果果胶品质比较[J].农业工程学报,2009,25(9):350-355.
[20]Yeoh S,Shi J,Langrish T A G.Comparisons between different techniques for water-based extraction of pectin from orange peels [J].De salination,2008,218:229-237.
[21]唐翠娥.薜荔籽果胶的提取工艺及其性质研究[D].南昌:南昌大学,2007.
[22]徐慧.辣椒果胶的提取工艺及理化性质研究[D].天津:天津科技大学,2010.
Effect of pH on the quality of apple pectin extracted with ultrasonic-wave assisted
DOU Jiao,GUO Yu-rong*,XUE Zhan-feng,LI Jie,CHEN Wei-qi,ZHANG Xiao-rui
(Shaanxi Normal University,College of Food Engineering and Nutritional Science,Xi’an 710062,China)
In order to study the effect of pH values on the quality of apple pectin,different pH of ultrasonic-wave assisted were adopted to extract apple pectin from apple pomace so as to evaluate the quality of apple pectin. The results indicated that pH had significant influence on the quality of apple pectin.In the range of pH1.00~2.00,as the pH arising,the pectin yields and polyphenol first increased and then decreased,while,the content of galacturonic acid decreased.However,the degree of esterification increased,the same trend as intrinsic viscosity and viscosity average molecular weight.IR spectral analysis showed that no major structural differences of apple pectin under different pH conditions.Meanwhile,different pectins all had characteristic absorption peak of carbohydrate.
apple pectin;ultrasonic-wave;extracted;pH;quality
TS201.2
A
1002-0306(2014)10-0172-05
10.13386/j.issn1002-0306.2014.10.030
2013-10-10 *通讯联系人
窦姣(1990-),女,硕士研究生,主要从事食品功能成分开发及利用方面的研究。
农业部现代苹果产业技术体系建设专项基金资助(CARS-28)。

