刺梨总三萜提取方法及其α-葡萄糖苷酶抑制活性研究
秦晶晶,李齐激,薛 琰,马 琳,杨小生,*
(1.贵州大学药学院,贵州贵阳550002;2.贵州省中国科学院天然产物化学重点实验室,贵州贵阳550002)
刺梨总三萜提取方法及其α-葡萄糖苷酶抑制活性研究
秦晶晶1,2,李齐激2,薛 琰2,马 琳2,杨小生1,2,*
(1.贵州大学药学院,贵州贵阳550002;2.贵州省中国科学院天然产物化学重点实验室,贵州贵阳550002)
以药食两用植物刺梨为对象,研究不同提取方法对提取刺梨总三萜影响及其最佳方法下总三萜的α-葡萄糖苷酶抑制活性。通过采用5种不同提取方法(水煮醇沉法、回流提取法、大孔树脂法、浸渍法、超临界萃取法)对总三萜提取率,α-葡萄糖苷酶抑制模型对总三萜抑制活性进行考察。结果表明,回流提取法刺梨总三萜提取率最高,为0.53%;其三萜总提物经处理所得A、B部分α-葡萄糖苷酶抑制活性较好(IC50值分别为9.6、3.4μg/mL),活性远优于阳性对照阿卡波糖(IC50=75.2μg/mL)。该提取方法经济、方便、适合工业化生产,且三萜总提物具有较好的α-葡萄糖苷酶抑制活性。
刺梨总三萜,提取方法,α-葡萄糖苷酶抑制活性
刺梨为蔷薇科蔷薇属植物缫丝花Rosa roxburghii Tratt.的果实,又名送春归,主要分布于我国西南地区,以贵州省资源最为丰富,为少数民族用药,具有消食健脾,收敛止泻的功效,主要用于治疗积食腹胀,泄泻等疾病[1]。经现代研究表明,刺梨中主要含有三萜、黄酮、多糖、维生素等化学成分,因富含维生素C、维生素P和超氧化物歧化酶(SOD)被称为“三王水果”,其维生素C含量是猕猴桃的10倍[2]。另外,刺梨提取物及其三萜成分(如刺梨苷、刺梨酸、野蔷薇苷等)在调节机体免疫功能、延缓衰老、解毒、抗动脉粥样硬化、抗应激、抗肿瘤、抗炎、镇痛、抑制免疫反应的单核细胞增殖、抑制外周血中B细胞、T细胞和巨噬细胞、抑制HIV等方面表现出一定的药理活性[3-10]。
目前,提取生物活性总三萜的方法较多,邓迎娜等[11]利用超声提取灵芝总三萜,在传统回流提取法的基础上提高了总三萜类的提取率,避免了高温对其组分的破坏;白新鹏等[12]通过微波提取猕猴桃根总三萜一次提取率达85.13%;李金华等[13]用超临界CO2萃取段木灵芝孢子油中总三萜取得一定效果;此外,还有传统的煎煮法、浸渍法等[14-15]均发挥了一定的作用。综上,不同植物提取总三萜的方法也不尽相同,需结合实际情况进行调整。因此,本文对刺梨总三萜的提取方法及其α-葡萄糖苷酶抑制活性进行研究,为进一步开发刺梨相关药、食及保健品提供一定的研究基础和科学依据。
1 材料与方法
1.1 材料与仪器
实验材料 于2013年9月采自贵州龙里,经“贵州大学”安华明教授鉴定为刺梨Rosa roxburghii Tratt.fmalis Rehd.et Wils的成熟果实,标本存放于“贵州省中科院天然产物重点实验室Lab8号实验室”;熊果酸 购自中国食品药品检定研究院,批号:110742-200415;α-葡萄糖苷酶 日本OSAKA BIO公司4;硝基苯-α-D-吡喃葡萄苷 Sigma公司;阿卡波糖 德国拜耳公司;高氯酸 为优极纯;香草醛、冰乙酸、无水乙醇 均为分析纯。
HP-8453型双光束紫外可见分光光度计 美国惠普公司;FA 114型万分之一电子天平 上海海康电子仪器厂;电热恒温水浴锅 北京永光明医疗仪器厂;Max-190型酶标仪 美国Molecular Devices公司;恒温培养箱 上海博泰实验设备有限公司;旋转蒸发仪 瑞士BUCHI公司;96孔板细胞 美国Corning Costar Cambridge M公司。
1.2 实验方法
1.2.1 不同提供方法供试品的制备
1.2.1.1 水煮醇沉法 取刺梨粗粉约200g,按游泽芳[16]方法制备,浓缩干燥得总提物13.59g。精密称取总提物0.27g加适量甲醇定容于25mL容量瓶,摇匀,即得。
1.2.1.2 回流提取法 取刺梨粗粉约200g,参考南莹等[17]方法并稍作修改,加250mL乙醇回流提取,每次2h,重复3次,合并滤液,浓缩至无醇味,加适量乙酸乙酯萃取3次,合并乙酸乙酯萃取液,加适量水沉淀后,滤过,得沉淀物A和溶液B,分别浓缩干燥即得总提物A(400mg)、B(650mg)。再分别精密称取A(25mg)、B(13mg)加适量甲醇定容于25mL容量瓶,摇匀,即得。
1.2.1.3 大孔树脂法 取刺梨粗粉约200g,按游泽芳[16]方法制备,收集70%乙醇洗脱部分,浓缩干燥即得干燥物1g,精密称取0.175g加适量甲醇定容于25mL容量瓶,摇匀,即得。
1.2.1.4 浸渍法 取刺梨粗粉约200g,按杨爱梅等[18]方法制备,得总浸膏0.5g,精密称取38mg后加适量甲醇定容于25mL容量瓶,摇匀,即得。
1.2.1.5 超临界萃取法 取刺梨粗粉约200g,加入萃取釜中,参考李加兴等[19]方法稍作修改,在萃取压力18、23、25MPa,萃取温度45℃,解析压力5MPa,解析温度50℃条件下进行超临界流体萃取,萃取物干燥即得2.10g,精密称取0.27g后加适量甲醇定容于25mL容量瓶,摇匀,即得。
1.2.2 不同提取方法中刺梨总三萜的含量测定
1.2.2.1 刺梨总三萜标准曲线的绘制 精密称取熊果酸对照品10mg,置于100mL容量瓶中,加甲醇溶解,定容,摇匀即得浓度为0.11mg/mL的对照品溶液。精密吸取熊果酸对照品溶液0.2、0.4、0.6、0.8、1.0、1.2、1.6mL置于试管中,100℃水浴蒸干甲醇,加0.40mL香草醛-冰乙酸溶液和1.00mL高氯酸,在60℃水浴加热15min后,移入冰水浴中,再加入5.00mL冰乙酸,摇匀,在545nm处测定吸收值。以熊果酸浓度(μg/mL)为横坐标,吸光度(A)为纵坐标进行线性回归,得线性回归方程,计算R2。
1.2.2.2 精密度实验 分别精密吸取6份对照品溶液0.7mL,按1.2.2.1项下方法进行处理并测定吸光度值,计算RSD值。
1.2.2.3 稳定性实验 分别精密吸取6份1.2.1.2项下供试品溶液0.2mL,分别于0、2、4、6、8、10h按1.2.2.1项下方法测定吸光度值,计算RSD值。
1.2.2.4 重复性实验 分别精密吸取6份1.2.1.2项下供试品溶液0.2mL,按1.2.2.1项下方法测定吸光度值,计算RSD值。
1.2.2.5 加样回收率实验 分别取1.2.1.2项下已知总三萜含量(69.87%)的样品6份,约18mg,精密称定,按1∶1比例加入对照品,按1.2.2.1项下方法操作,测定吸光度值,计算平均值及RSD值。
1.2.2.6 样品的含量测定 分别精密吸取1.2.1项下供试品溶液0.2mL于具塞试管中,按1.2.2.1项下方法测定吸光度值(A),运用回归方程计算样品含量。
1.2.3 刺梨总三萜α-葡萄糖苷酶抑制活性筛选
1.2.3.1 供试品的选择 根据样品含量测定结果,优先选择刺梨总三萜含量较高的1.2.1.2项下样品进行测定。
1.2.3.2 α-葡萄糖苷酶抑制活性检测方法 参考杨付梅等[20]方法并稍作修改:反应体系,96孔板上加入80μL磷酸二氢钠缓冲液(pH6.9),再加入10μL α-葡萄糖苷酶溶液(0.1U/mL)和10μL样品溶液,混匀,37℃恒温10min后,加入20μL PNPG(2.5mmol/L),37℃恒温反应15min,最后加入40μL的Na2CO3(1mol/L),在405nm波长下测定OD值。
以阿卡波糖(Acarbose)为阳性对照,同时设定阴性对照组(缓冲液+酶液),空白对照(缓冲液)。按下式计算酶活性抑制率:
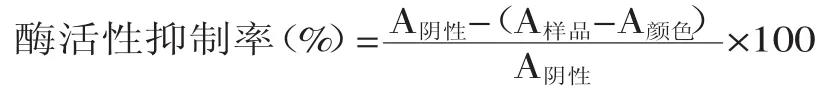
1.3 数据统计分析
所有实验数据均为3次重复实验结果的平均值,数据统计分析采用SPASS 11.5进行,绘图采用Mircrosoft Excel 2007进行,数值表示为平均值x±SD。
2 结果与分析
2.1 方法学考察
2.1.1 标准曲线的制备 以熊果酸浓度x(μg/mL)为横坐标,吸光度y(A)为纵坐标,通过线性拟合得回归方程为y=0.0054x+0.0434,相关系数R2=0.9997大于0.99,标准曲线见图1。结果表明熊果酸质量-吸光度线性关系良好。

表1 精密度实验结果(n=6)Table 1 The results of precision test(n=6)

表2 稳定性实验结果(n=6)Table 2 The results of stability test(n=6)

表3 重复性实验结果(n=6)Table 3 The results of repeatability test(n=6)
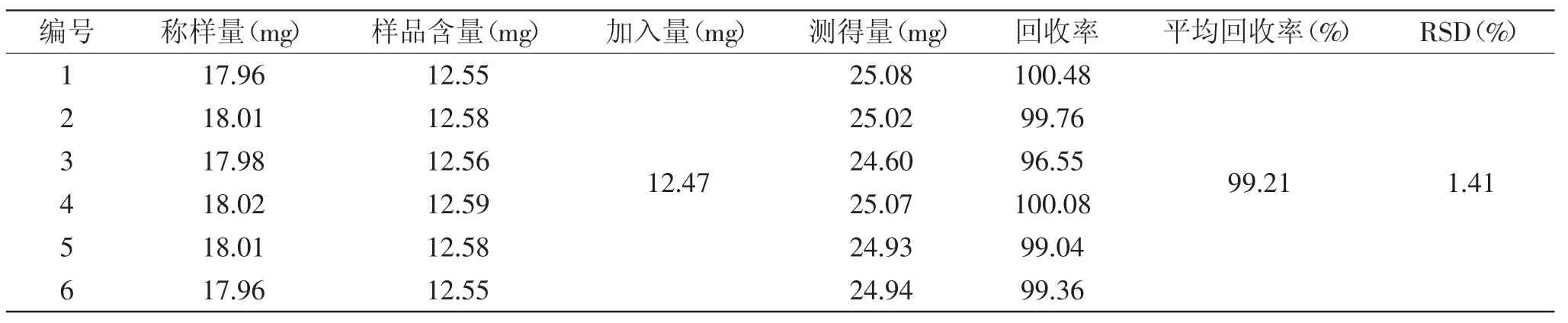
表4 刺梨提取物A的加样回收率(n=6)Table 4 Recoveries of Rosa roxbughii extraction A(n=6)
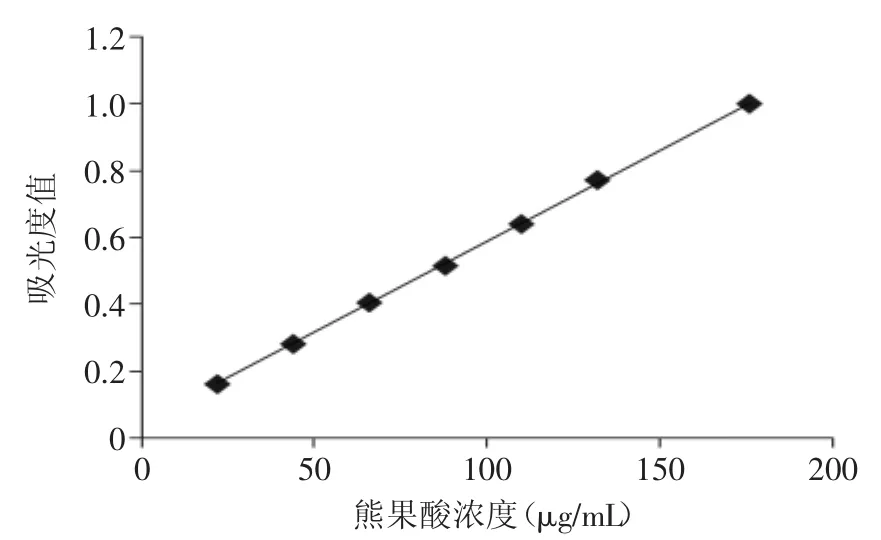
图1 标准曲线图Fig.1 The figure of standard curve
2.1.2 精密度实验 熊果酸标准品溶液精密度实验结果见表1,计算相对标准偏差值(RSD)为1.89%(n=6)小于2%,表明该实验精密度良好。
2.1.3 稳定性实验 刺梨供试品溶液稳定性实验结果见表2,计算RSD值为1.24%(n=6)小于2%,表明样品在10h内稳定。
2.1.4 重复性实验 刺梨供试品溶液重复性实验结果见表3,计算相对标准偏差RSD值为0.45%(n=6)小于2%,表明该实验重复性良好。
2.1.5 加样回收率实验 刺梨供试品回收率实验结果见表4,计算平均加样回收率为99.21%,RSD为1.41%(n=6)小于2%,表明该实验加样回收率较好。
2.1.6 不同提取方法中总三萜的含量 按1.2.2.1项下方法对1.2.1项对供试品进行总三萜含量测定,计算结果见表5。

表5 不同提取法中总三萜的含量(x±SD,n=3)Table 5 Different extraction methods on the determination of total saponins(x±SD,n=3)
由表5可知,5种提取方法中超临界萃取法提取率最高,为1.05%±0.01%,但总三萜含量较低,为10.02% ±0.10%;回流提取法提取率适中,但含量最高70.86% ±0.40%。综合比较几个方法提取率与总三萜含量,回流提取法为刺梨总三萜最佳提取方法,综合提取效果最好。
2.2 刺梨总三萜体外α-葡萄糖苷酶抑制活性
刺梨总三萜提取物A、B体外α-葡萄糖苷酶抑制活性结果见表6。
由表6可知,与阳性对照阿卡波糖(IC50值为75.2μg/mL)比较,刺梨提取物A、B的分别为9.6、3.4μg/mL,均表现出较好的抑制活性。
3 讨论
3.1 刺梨总三萜提取方法的选择
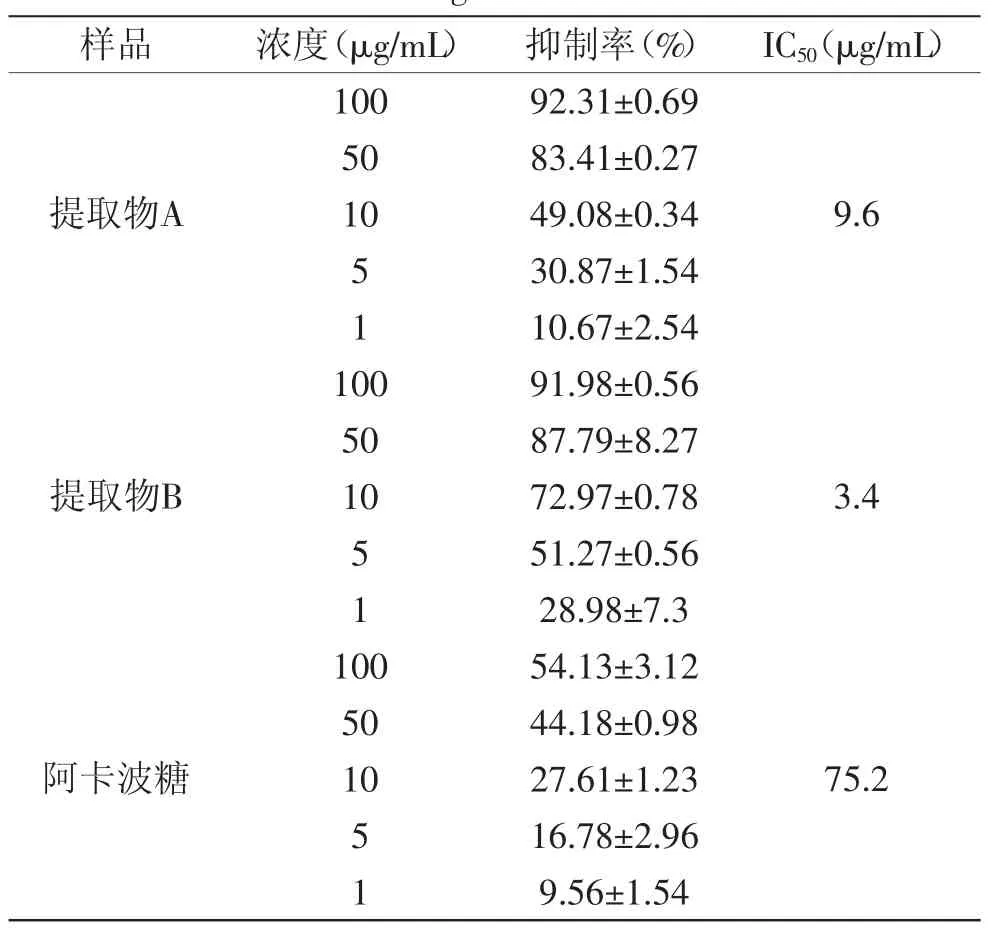
表6 刺梨总三萜α-葡萄糖苷酶抑制活性(x±SD,n=6)Table 6 α-glucosidase inhibitory activity of total saponins in Rosa roxbughi(ix±SD,n=6)
刺梨三萜作为该植物的活性成分之一,主要由多取代羟基熊果烷型五环三萜及其苷类物质组成,其中刺梨三萜皂苷以含单糖链为主,在乙醇-水中具有较好的溶解性。之前已有文献[11-12]报道超声、微波提取总三萜有诸多优点,且提取效率也高,但本实验结果显示该方法并不适合提取该植物中总三萜。为更好地探索刺梨总三萜的最佳提取方法,本实验结合该植物三萜类成分自身特点和类似文献[16-19]方法,选择其中最常用的5种提取方法加以改进来考察刺梨总三萜的含量变化,结果显示超临界萃取法提取率最高1.05%±0.01%,但含量较低10.02%±0.10%,且设备较贵,综合利用率低;回流提取法提取率虽然适中,但含量最高(约70%),且经济、简单、易于工业化生产,综合提取效率也高。综合比较5种方法的提取率与总三萜含量,结合工业化生产实际,最终认为回流提取法可作为刺梨总三萜的最佳提取方法。
3.2 刺梨总三萜对α-葡萄糖苷酶具有较好的抑制活性
众所周知,α-葡萄糖苷酶抑制剂是防治餐后高血糖症及缓解高胰岛素血症的重要抑制剂之一,应用前景十分广阔。与天然水果肉桂、荔枝、胡柚α-葡萄糖苷酶抑制活性(IC50分别为350.37μg/mL、80、25.42mg/mL)比较[21-23],本实验所建模型阳性对照阿卡波糖IC50值(75.2μg/mL)较小,灵敏度高,具有较好的重复性和可操作性。
4 结论
刺梨作为我国重要的药食两用植物资源,资源十分丰富,大面积种植栽培,其天然植物保健功能值得深入研究与开发。通过对不同提取方法下刺梨总三萜的含量进行测定,综合考察其利用效率,可将回流提取法作为刺梨总三萜的最佳提取方法,该方法综合利用率高、经济节约、便于实现,且体外α-葡萄糖苷酶抑制活性较好,该初步活性测试结果可为刺梨高值化利用与开发提供参考。
[1]赵学敏.本草纲目拾遗(清09)[M].北京:人民卫生出版社,1983:295.
[2]敖芹,谷晓平,梦维亮.贵阳刺梨研究进展[J].耕作与栽培,2010(6):1-7.
[3]粱光义.刺梨甙及野蔷薇甙的分离与结构研究[J].植物学报,1988,30(4):409-413.
[4]粱光义.刺梨酸的分离与结构研究[J].药学学报,1987,22(2):121-125.
[5]张春妮,周毓,王俊军.刺梨药理研究的新进展[J].医学研究生学报,2005,18(11):1049-1051.
[6]付慧晓,王道平,黄丽蓉,等.刺梨和无籽刺梨挥发性香气成分分析[J].精细化工,2012,29(9):875-878.
[7]吴立夫,王道地,卿晓红.刺梨汁对小鼠免疫功、耐缺氧及耐寒能力的影响[J].贵州农学院学报,1996,15(3):22-25.
[8]杨小生,马琳,梁冰,等.刺梨果活性提取物及其制备方法、检测方法和应用:中国,ZL 201110080992.X[P].2011-01-10.
[9]刘虹麟.陈代雄,方宁,等.刺梨提取物CL1对胃癌SGC-7901细胞增殖和人脐血CD34+造血干/祖细胞增殖分化能力的影响[J].中国临床药理学与治疗学,2006,11(7):829-832.
[10]戴支凯,余丽梅,杨小生.刺梨提取物(CL)抗肿瘤作用[J].中国中药杂志,2007,32(14):1453-1457.
[11]邓迎娜,易醒,肖小年,等.超声提取泽泻中三萜类总组分[J].食品工业科技,2007,28(9):145-147.
[12]白新鹏,裘爱泳,方希修.改进微波装置辅助提取猕猴桃根三萜类化合物的研究[J].2006,22(8):188-193.
[13]李金华,黄星.灵芝孢子油及其制备方法和用途[P].中国:200410051412,2005.
[14]王瑛,张艳华,王伟明.中药三萜类化合物提取纯化工艺的研究进展[J].黑龙江医药,2010,19(3):226-227.
[15]周俐斐,芦柏震,侯桂兰.中药三萜类化合物提取分离及测定方法研究进展[J].海峡药学,2007,23(2):62-64.
[16]游泽芳.结石草有效部位的工艺优化及质量控制研究[D].贵阳:贵州大学,2013:27-31.
[17]南莹,李齐激,马琳,等.紫外风光光度法测定刺梨总三萜与总黄酮含量[J].遵义医学院学报,2012,35(6):473-476.
[18]杨爱梅,曾艳,杨林,等.藏药戟叶垂头菊中三萜类成分的分离和结构鉴定[J].中成药,2010,32(4):636-639.
[19]李加兴,孙金玉,陈双平,等.超临界CO2萃取猕猴桃跟三萜类化合物工艺优化[J].食品科学,2011,32(18):72-76.
[20]杨付梅,孙黔云.α-葡萄糖苷酶抑制剂微量筛选模型的正交法构建和筛选[J].中国药理学通报,2009,25(8):1113-1116.
[21]许芹永,朱靖博,王振中,等.肉桂抑制α-葡萄糖苷酶活性成分研究[J].天然产物研究与开发,2012,24:1246-1249.
[22]张俊,何静,周锦云,等.胡柚中抑制α-葡萄糖苷酶活性组分的研究[J].中国食品学报,2013,13(2):1246-1249.
[23]张钟,吴文婷,王萍,等.荔枝水溶性多糖作为α-葡萄糖苷酶抑制剂的活性测定[J].食品科学,2013,34(13):175-179.
Study on extraction methods and α-glucosidase inhibitory activity from the total triterpenes of Rosa roxbughii
QIN Jing-jing1,2,LI Qi-ji2,XUE Yan2,MA Lin2,YANG Xiao-sheng1,2,*
(1.Guizhou University College of Pharmacy,Guiyang 550002,China;2.The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences,Guiyang 550002,China)
The extraction yield of total triterpenes from R.roxbughii that was extracted by different extraction methods and the α-glucosidase inhibition activities of the best extraction of total triterpenes was studied.To investigate the extraction yield of total triterpenes to extract by five different extraction methods(water boiling and precipitation with ethanol,refluxing process,macro absorption resin,impregnation method,supercritical fluid extraction),and to evaluate the highest extraction yield of the total triterpenes against α-glucosidase inhibition activities.The results showed that the total triterpene’s extraction yield of refluxing process were higher than the other extraction methods,CoMParing with acarbose,the extractions A and B had preferable inhibition activities against α-glucosidase,and their IC50values were 75.2,9.6,3.4μg/mL,respectively.This method was economy,convenience and appropriate for commercial process,and the total triterpenes had preferable inhibition activities against α-glucosidase.
total triterpenes;extraction method;α-glucosidase inhibition activity
TS255.1
A
1002-0306(2014)10-0186-04
10.13386/j.issn1002-0306.2014.10.033
2013-12-11 *通讯联系人
秦晶晶(1988-),女,在读硕士研究生,研究方向:药食两用植物营养保健功能。
国家973计划前期预研项目(2012CB722601);贵州省科技重大专项(2013-6006);贵州省科技创新人才团队建设项目(2013-4006)。

