堆肥过程不同分子量水溶性有机物电子转移能力的演变及影响因素
杨超 何小松 高如泰 席北斗 黄彩红 张慧 檀文炳 李丹

摘要利用超滤技术、电化学方法和光谱技术,以堆肥水溶性有机物的不同分子量(MW)组分为研究对象,分析在堆肥过程中不同分子量水溶性有机物(DOM)的组成特征、结构演变和电子转移能力变化的影响因素。结果表明,类蛋白物质主要存在于堆肥前期的DOM(MW<1kDa)中,随着堆肥的进行,类蛋白物质不断降解,类富里酸物质持续合成,堆肥后期类蛋白物质被完全降解,类富里酸物质成为DOM(MW<1kDa)主要的荧光组分。类腐殖物质是DOM(MW=1~3kDa)、DOM(MW=3~5kDa)和DOM(MW>5kDa)的主要荧光组分,堆肥过程中类腐殖质物质在3种不同分子量组分的变化各不相同,但是堆肥后期类腐殖质物质在3个不同分子量组分的含量均高于堆肥初期。堆肥过程中DOM(MW<1kDa)的电子供给能力(EDC)呈降低趋势,而电子接受能力(EAC)呈升高趋势;DOM(MW>5kDa)的EDC在堆肥过程中呈上升趋势,而EAC则无明显的变化规律。DOM(MW=1~3kDa)和DOM(MW=3~5kDa)的EDC和EAC在整个堆肥过程无明显变化规律。不同分子量组分堆肥DOM的EAC受控于堆肥过程木质素降解产物的含量,而其EDC變化与荧光参数和紫外参数无明显关系。
关键词堆肥;水溶性有机物;分子量;电子转移能力;平行因子分析
1引言
随着我国经济的发展,饮食结构发生很大改变,每年对肉类、牛奶等消费量以接近10%的速度增长[1]。人们对畜牧产品的消费需求导致畜牧养殖业成为我国农业经济的重要部分,与此同时,养殖废弃物不合理的处理已成为我国农业面源污染的主要来源之一[2]。堆肥由于其低成本和无污染等优点,成为我国处理畜禽粪便的重要处理方式[3,4]。堆肥是生物强化处理工艺,在该过程中有机物被降解成二氧化碳或者转化成腐殖酸[5]。水溶性有机物(Dissolvedorganicmatter,DOM)是堆肥过程有机物转化最活跃的部分,其中脂肪类,多糖类和蛋白类化合物优先被微生物降解,而芳香族物质则稳定存在,且在此过程中不断积累[6,7]。
DOM的组成复杂,既包括小分子的有机酸、糖类等,又包括大分子的蛋白质和腐殖质[8,9]。在自然生态系统中,DOM可作为营养物质参与微生物的生命活动,同时其吸附和还原能力影响污染物在环境中的迁移和转化[10,11]。DOM通过氧化还原能力介导地球化学反应的能力,使其能够强化微生物和污染物之间的电子传递,进而影响污染物的存在形态,因此电子转移能力是衡量DOM环境效应的重要指标。腐熟的堆肥产品含有较低的易降解的有机物和较高含量的有机大分子物质[3,5,6],施加于土壤后可改善土壤的理化性质,加速污染物的转化。因此研究堆肥过程中DOM结构和组成的演变,以及其对DOM的电子转移能力影响,能够拓宽堆肥产品的应用途径。
不同分子量DOM在光化学反应和生物反应具有重要作用[12]。已有研究表明,低分子量的DOM(MW<1kDa)容易被微生物利用,而高分子量DOM(MW>15kDa)具有较强的稳定性[13]。不同分子量DOM的结构、稳定性、腐殖化程度和芳香性不同[14,15],RomeraCastillo等采用色谱分析法发现,DOM的分子量可能影响DOM的结构和荧光性能[16]。文献\[17,18\]表明,堆肥前期DOM主要为分子量小于1kDa组分,而堆肥后期DOM主要为分子量大于25kDa的组份,且堆肥过程中小分子量的物质可能被转化成大分子量物质。不同分子量的DOM组成和结构不同,其电子转移能力不同,但是DOM分子量和电子转移能力的关系却鲜有报道。
本研究采集鸡粪堆肥过程中5个典型样品,并提取DOM。采用超滤的方法将DOM分成4种不同分子量组分,即MW<1kDa、MW=1~3kDa、MW=3~5kDa和MW>5kDa。通过电化学的方法对堆肥DOM不同分子量组分的电子转移能力进行测定,并采用紫外可见光谱和荧光光谱对其组成和结构进行了表征,以期揭示堆肥过程不同分子量DOM的组成差异、结构演变特征、电子能力变化及影响因素。
2实验部分
2.1仪器与试剂
AnalytikJenaMultiN/C2100型TOC分析仪(德国耶拿公司);UNICO2600A紫外分光光度计(美国优尤尼柯公司);HitachiF7000型荧光光谱仪(日本日立公司);3种不同截留分子量(1、3和5kDa)的超滤膜(科氏(KOCH)公司);CHI660e型电化学工作站(上海辰华有限公司)。1,1′乙撑2,2′联吡啶二溴盐(DQ,中国计量科学研究院);2,2联氮二(3乙基苯并噻唑6磺酸)二铵盐(ABTS,上海君川科技有限公司)。实验所用电极均购于上海辰华有限公司。实验用水均为MilliQ超纯水(美国Millipore公司)。
2.2堆肥样品的采集和堆肥过程
在北京市昌平区某养鸡场采集新鲜鸡粪,辅以锯屑和干草,调节堆肥物料中鸡粪、锯屑和干草的配比为6:2:1、C/N(碳氮比)约为26、含水率为50%~60%(质量比)后[19],实验室内于高400mm、宽330mm的圆桶式静态堆肥设备中进行堆肥。前3d堆体温度由25℃迅速上升到50℃,第4d达到最高温度63℃。堆肥进行到第7d后温度逐渐下降,到第16d堆体温度稳定在室外温度。此时对堆肥物料翻堆,并再次将含水率调到50%~60%范围内使其进行二次发酵。于堆肥1,8,16,28和40d从上到下采集不同高度的3份样品,并充分混匀,依次编号为S1,S2,S3,S4和S5,随后在
55℃冷冻干燥,充分研磨后过100目筛。
2.3样品的提取和制备
将研磨筛分后的样品与超纯水按固液比(w/V)1〖KG-3∶〖KG-510进行DOM的提取,室温200r/min水平振荡24h,于4℃以10000r/min离心10min,上清液过0.45μm醋酸纤维滤膜,得到DOM。
参考已有的分子量分组方法[20,21],通过3种不同截留孔径的超滤膜将DOM分为<1kDa,1~3kDa,3~5kDa和>5kDa的4个组分。采用TOC分析仪测定样品的溶解性有机碳,以DOC表示。
2.4电子转移能力的测定
参考文献\[22\]介导电化学氧化(Mediatedelectrochemicalreduction,MER)和介导电化学还原(Mediatedelectrochemicaloxidation,MEO)的方法并略作改动。将电化学测得电子转移能力(Electrontransfercapacity,ETC)与采用传统微生物还原方法测得电子转移能力[8,23]进行相关性分析,发现二者呈显著正相关(数据未给出)。具体方法如下:以直径3mm的玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极作为对电极。ABTS和DQ分别作为介导电化学的氧化剂和还原剂,0.61V作为介导电化学氧化电势,
0.49V作为介导电化学还原电势。反应之前,2.5mL0.2mol/LKCl,2.5mL0.2mol/L磷酸盐缓冲液(pH7)作为反应溶液,通氮气5min去除反應液的氧气。随后加入1mLDQ(0.1g溶于50mL水)或ABTS(0.2g溶于50mL水),反应平稳后,加入待测样品(溶液的最终碳浓度为30mg/L),反应进行两次。同时整个反应均在无氧环境中进行。ETC的计算公式为:
〖JZ(ETC(EDC或EAC)=Ap/(e·NA·MC)〖JZ)(1)
其中ETC的单位为μmole(gC)
,AP是曲线总积分库伦,e表示电子所带电荷,NA是阿伏伽德罗常数。MC是反应体系中的碳含量(0.21mg)。
2.5光谱分析
光谱测量之前,所有样品的DOM均调为10mg/L。荧光光谱扫描狭缝为5nm,扫描速度为1200nm/min,PMT电压为700V,发射波长(Em)扫描范围为280~500nm,激发波长(Ex)的扫描范围为200~450nm。以超纯水作为空白,DOM荧光图谱减去空白荧光图谱后进行平行因子分析。
将堆肥5个阶段不同分子量DOM样品转化为三维的数据矩阵(20个样品×50×55Em),在MATLAB7.0(Mathworks,Natick,MA)上的DOMFluortoolbox(www.models.life.ku.dk)使用平行因子对三维数据矩阵进行解析。得分值用Fmax值表示,同时以其在样品的百分比研究组分的演变[6]。
同样将样品DOC调为10mg/L,紫外光谱的扫描间距为1nm,扫描范围为190~700nm。采用E270表示270nm处的吸光度,计算270nm处的特征吸收参数SUVA270(SUVA270=E270/DOC)[24]。
使用SPSS16.0进行数据统计分析。使用Origin9.0进行图形绘制。
3结果与讨论
3.1堆肥DOM不同分子量荧光组分
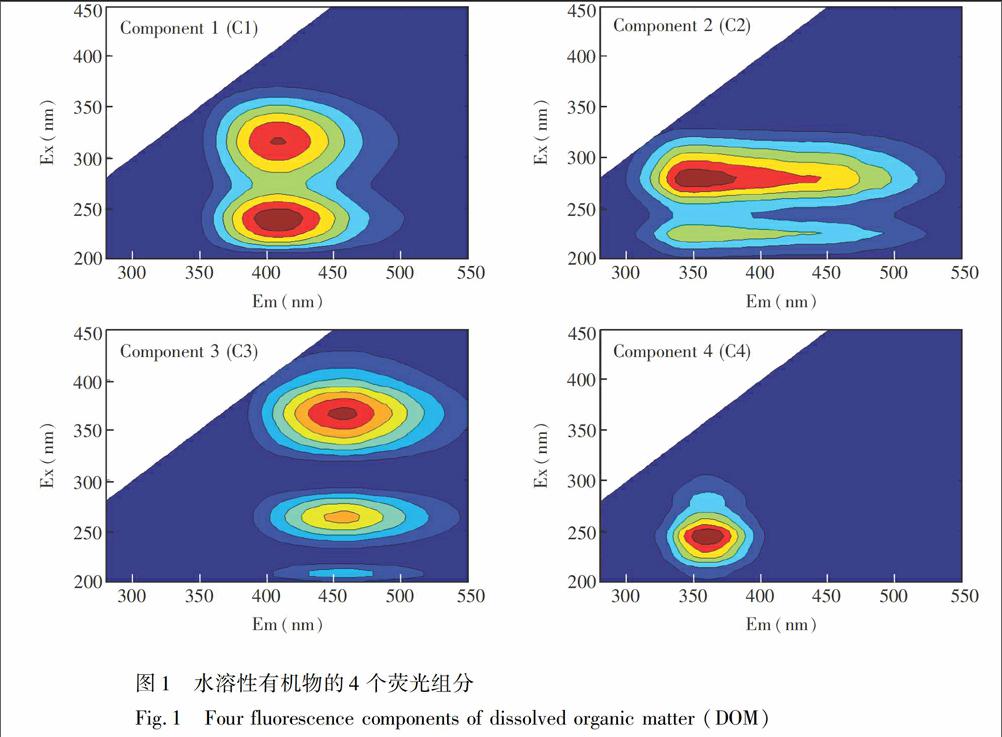
平行因子法是对三维荧光光谱数据进行荧光物质成分分解的有效方法[25]。为了探讨堆肥过程DOM的结构和组成变化特征,采用平行因子方法对荧光光谱进行解析。通过残差分析和折半分析确定堆肥DOM有4个荧光性成分,如图1所示。根据文献,推断C1\[Em/Ex(nm),410/(240,315)\]和C3\[Em/Ex(nm),455/(210,265,365)\]均为类腐殖质物质,其中C1\[Em/Ex(nm),410/(240,315)\]为类富里酸物质[25,26],C3\[Em/Ex(nm),455/(210,265,365)\]为类胡敏酸物质[28];C2存在肩峰,此肩峰与长短波长下的类腐殖质有关,已有研究表明,色氨酸可与腐殖质结合形成类色氨酸荧光峰[29,30],因此组分2可能为与类腐殖质物质共存的形态;C4(360/245)为类蛋白物质[30]。
3.2堆肥过程DOM不同分子量荧光组分演变规律
通过超滤的方法将DOM分离成4个不同分子量的组分,基于三维荧光平行因子分析,根据荧光组分得分值Fmax变化,研究DOM在堆肥过程中其结构和组分的变化。图2表示堆肥过程中荧光组分在不同分子量的分布,基于平行因子分析得到的4个组分在不同分子量DOM的分布差异明显。
根据三维荧光平行因子分析结果可知,类蛋白物质(组分1)主要存在于堆肥前期的DOM(MW<1kDa)中,随着堆肥的进行,该荧光物质所占的比重逐渐降低,而类富里酸的荧光组分所占的比重则逐渐增强。在堆肥过程中,类蛋白物质结构简单,微生物可利用性强,因此在MW<1kDa的DOM的所占的比重逐渐减少直至消失,而类富里酸是具有芳香结构较稳定的组分,同时源于微生物对于木质素的降解,堆肥过程中其在MW<1kDa的DOM中所占的比重稳定增加,在堆肥后期DOM中类富里酸物质是其主要成分。组分2可能为类色氨酸与类腐殖质物质共存的形态,其在堆肥过程中呈波动式增加,组分2的变化也能够表明堆肥是个腐殖化的过程。C3是类胡敏酸物质,图2表明类胡敏酸物质稳定存在于MW<1kDa的DOM中,且随堆肥的进行波动不大。胡敏酸相对分子量在102~107Da之间[31],故低分子量的胡敏酸能够存在于分子量<1kDa的DOM中,同时其又是具有醌和酚等芳香性结构的物质[32],因此其组分在堆肥过程中稳定存在且含量波动不大。
类腐殖质物质(组分1和组分3)是DOM(MW=1~3kDa)、DOM(MW=3~5kDa)和DOM(MW>5kDa)的主要组分,且随着堆肥的进行其含量增加显著,分别由堆肥初期的56.8%,65.3%和58.3%演变为堆肥后期的76.5%,74.2%和71.5%。类蛋白物质在这3种不同分子量DOM的含量较低,其在堆肥初期3种不同分子量DOM中分别为12.8%、4.5%和8.7%,在堆肥后期3种分子量组分中其荧光组分完全消失。
3.3不同分子量堆肥DOM的电子转移能力的演变规律
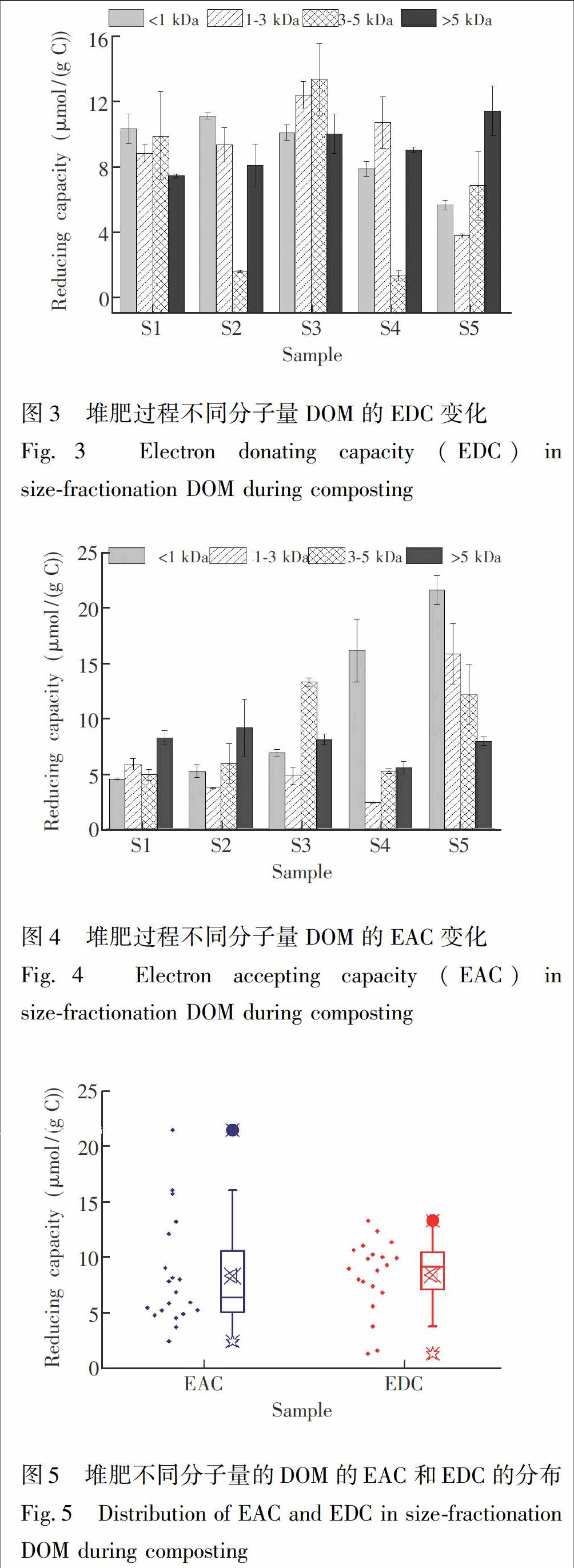
采用电化学的方法测定堆肥过程中不同分子量DOM的ETC。ETC包含EDC和EAC。图3表示不同堆肥时期不同分子量DOM的EDC变化。DOM(MW<1kDa)的EDC变化范围为5.58~11.07μmol/(gC),在堆肥第8d中DOM(MW<1kDa)的EDC最强,随后随着堆肥的进行逐渐降低。DOM(MW>5kDa)的EDC变化范围为7.40~11.39μmol/(gC),虽然在堆肥第28d有波动,但是在整个堆肥过程EDC呈上升的趋势。堆肥过程中DOM(MW=1~3kDa)的EDC呈先升高后降低的趋势,堆肥16d的EDC达到最大值(12.38μmol/(gC)),在堆肥40d降到最低(3.78μmol/(gC))。而DOM(MW=3~5kDa)的EDC在堆肥过程无明显变化规律。总之,对于堆肥前期(S1和S2),DOM(MW<1kDa)的EDC比DOM(MW>5kDa)的EDC强,而随着堆肥的进行不同分子量的DOM的EDC不断演变,在堆肥后期(S5)则呈相反的趋势,即DOM(MW>5kDa)的EDC要强于DOM(MW<1kDa)的EDC。
堆肥5个阶段不同分子量组分的EAC的變化如图4所示。DOM(MW<1kDa)的EAC变化范围为4.51~21.56μmol/(gC),与EDC变化不同,在堆肥过程中DOM(MW<1kDa)的EAC呈逐渐上升的趋势。DOM(MW>5kDa)的EAC变化范围为5.45~9.06μmol/(gC),在堆肥过程中波动不大且无明显规律。同DOM(MW>5kDa)的EAC变化趋势相同,DOM(MW=1~3kDa)的EAC在堆肥过程中无明显变化趋势,但是在堆肥40d的EAC最大(15.78μmol/g(C))。DOM(MW=3~5kDa)的EAC呈先升高后降低后又略微增加的波动式变化趋势,〖PS07524.eps,Y,PZ#
在堆肥16dDOM达到最大(13.25μmol/g(C)),而在堆肥1dDOM最小(4.89μmol/g(C))。同时对比同一堆肥阶段不同分子量的EAC可见,堆肥前期(S1和S2)DOM(MW>5kDa)的EAC强于DOM(MW<1kDa)的EAC,而随着堆肥的进行,不同分子量DOM的EAC也不断演变,在堆肥后期(S4和S5)则呈相反的趋势,即DOM(MW<1kDa)的EAC强于DOM(MW>5kDa)的EAC。
5个堆肥阶段不同分子量所有堆肥DOM的EAC和EDC分布如图5所示,可见EAC的离散程度高于EDC,表明EAC受DOM组成和结构演变的影响程度要高于EDC。通过比较平均值可发现,EDC的平均值要
大于EAC的平均值,但是差距并不明显。堆肥是有机质的降解和腐殖化过程,在该过程中糖类和蛋白类物质能够优先被微生物降解,而芳香族结构物质不容易被降解,且源于木质素的降解芳香族物质不断增加[6,7]。由于堆肥初期含有较多还原性的蛋白质和小分子的氨基酸和糖类[33],因此具有较高的EDC。同时有机质的EAC主要来源于芳香族化合物[9],且堆肥后期芳香族化合物不断生成,因此堆肥EAC受结构演变的影响较大。
3.4DOM的结构和组分演变对ETC的影响
在堆肥过程中不同分子量DOM的EAC和EDC呈现不同的变化规律,为探究这种变化与结构和组成演变之间的关系,对DOM的EAC和EDC与紫外参数和荧光参数做相关性分析,结果如表1所示,EAC与组分2呈现极显著相关(p<0.01),且与组分1和SUVA270达到显著相关(p<0.05)。组分2是色氨酸与腐殖质共存的物质。有研究表明,堆肥过程中木质素降解产生芳香碳,芳香碳能够进一步氧化成醌基,这些醌基与氨基酸交互作用形成类富里酸和类胡敏酸物质[34],因此这些色氨酸与腐殖质结合形态的物质对DOM的EAC影响显著。紫外光谱参数SUVA270能够表示堆肥过程中源于木质素降解的芳香碳的含量[24],EAC与SUVA270呈显著相关表明,DOM的EAC与木质素降解产生的芳香碳有关,这与He等[9]报道一致。组分1代表类富里酸物质,前文分析显示类富里酸物质是堆肥过程变化最显著的物质且其同样是具有芳香结构的难降解物质,DOM的EAC与组分1呈现显著相关,同样能够表明DOM的EAC与堆肥过程中的芳香碳的含量有关。所以DOM的EAC与C1、C2和SUVA270呈现显著相关表明堆肥过程中芳香族化合物对DOM的EAC影响显著。
与EAC不同,DOM的EDC与荧光参数和紫外参数都无明显关联。电子供给能力又可以分为初始电子供给能力(insituEDC)和潜在电子供给能力(PotentialEDC)。初始电子供给能力与样品提取方式有关,而潜在电子供给能力测量前样品进行预还原[35]。本研究样品提取、分离和存储均暴露于空气中,故堆肥DOM的EDC仅仅是初始电子供给能力,不能够代表真实的EDC,故其与荧光参数和紫外参数无明显关联,这与文献\[17\]的结论一致。
4结论
采用三维荧光平行因子分析和紫外光谱法研究不同分子量堆肥DOM的结构演变,利用电化学方法测定不同分子量堆肥DOM的ETC,结合相关性分析研究ETC变化的影响因素。研究发现DOM(MW<1kDa)和DOM(MW=1~3kDa)的EDC呈先升高后降低的变化趋势,而DOM(MW>5kDa)的EDC呈波动式的上升趋势,DOM(MW=35kDa)的EDC无明显的变化趋势。堆肥过程中DOM(MW<1kDa)的EAC持续增加,DOM(MW=1~3kDa)呈先上升后降低而后又略微上升的变化趋势,对于DOM(MW=3~5kDa)和DOM(MW>5kDa)的EAC则无明显的变化趋势。在堆肥初期,DOM的EDC随分子量的增加呈降低的变化趋势,其EAC呈增加的变化趋势,与之相反,堆肥后期DOM的EDC随分子量的增加呈升高的变化趋势,其EAC呈降低的变化趋势。DOM中类富里酸物质、与色氨酸结合的腐殖质物质及SUVA270与EAC呈显著相关,堆肥DOM的EAC受控于堆肥过程中源于木质素降解芳香碳的含量。通过电化学方法和光谱技术,同时结合数学统计学方法确定影响DOM电子转移能力演变的主要影响因素,为研究堆肥产品在土壤修复领域的利用提供快捷、科学的途径。
References
1YANGLei,LIUCheng,ZAHNGZhiYong,LIJun.Chin.J.Ani.Sci.,2009,5(18):22-25
杨磊,刘承,张智勇,李俊.中国畜牧杂志,2009,5(18):22-25
2ZHANGYuBai,LIQinFen.Chin.Agri.Sci.Bull.,2009,25(9):268-272
张聿柏,李勤奋.中国农学通报,2009,25(9):268-272
3HuZH,LiuYL,ChenGW,GuiXY,ChenTH,ZhanXM.BioresourceTechnol.,2011,102(15):7329-7334
4ZHANGShuQing,ZHANGFuDao,LIUXiuMei,WANGYuJun,ZHANGJianFeng.ScientiaAgriculturaSinica,2006,39(2):337-343
张树清,张夫道,刘秀梅,王玉军,张建峰.中国农业科学,2006,39(2):337-343
5SaidPullicinoD,ErriquensFG.BioresourceTechnol.,2007,98(9):1822-1831
6ZhaoXY,HeXS,XiBD,GaoRT,TanWB,ZhangH,LiD.WasteManage.,2016,56:79-87
7SaidPullicinoD,GigliottiG.Chemosphere,2007,68(6):1030-1040
8YANGChao,HEXiaoSong,XIBeiDou,HUANGCaiHong,CUIDongYu,GaoRuTai,TANWenBing,ZHANGHui.ChineseJ.Anal.Chem.,2016,44(10):1568-1574
杨超,何小松,席北斗,黄彩红,崔东宇,高如泰,檀文炳,张慧.分析化学,2016,44(10):1568-1574
9HeXS,XiBD,CuiDY,LiuY,TanWB,PanHW.J.Hazard.Matter.,2014,268(15):256-263
10YuanT,YuanY,ZhouSG,LiFB,LiuZ,ZhuangL.J.SoilSediment,2011,11(3):467-473
11ZhuZ,TaoL,LiF.Chemosphere,2013,93(1):29-34
12ShimotoriK,OmoriY,HamaT.Aquat.Microb.Ecol.,2009,58(1):55-66
13KaiserK,BennerR.Mar.Chem.,2009,113(12):63-77
14JinH,MinhyeP,SchlautmanMA.Environ.Sci.Technol.,2009,43(7):2315-2321
15CoryRM,KaplanLA.Limnol.Oceanogr.,2012,57(5):1347-1360
16RomeraCastilloC,ChenM,YamashitaY,JaffeR.WaterRes.,2014,55(2):40-51
17YongY,TaoY,ZhouS,TianY,QinL,JianH.BioresourceTechnol.,2012,116(4):428-434
18HuangDY,LiZ,CaoWD,XuW,ZhouSG,LiFB.J.SoilSediments,2009,10(4):722-729
19ZHAOYue,HEXiaoSong,XIBeiDou,YUHuiBin,WEIZiMin,LIMingXiao,WANGWei.Spectros.Spect.Anal.,2010,30(6):1555-1560
趙越,何小松,席北斗,于会彬,魏自民,李鸣晓,王威.光谱学与光谱分析,2010,30(6):1555-1560
20HiillJR,O'DriscollNJ,LeanDRS.Sci.TotalEnviron.,2009,408(2):408-414
21IlinaSM,DrozdovaOY,LapitskiySA,AlekhinYV,DeminVV,ZavgorodnyayaYA.Org.Geochem.,2014,66(1):14-24
22AeschbacherM,SanderM,SchwarzenbachRP.Environ.Sci.Technol.2010,44(44):87-93
23CUIDongYu,HEXiaoSong,XIBeiDou,TANWenBing,YuanYing,GaoRuTai.ChineseJ.Anal.Chem.,2015,43(2):218-225
崔东宇,何小松,席北斗,檀文炳,袁英,高如泰.分析化学,2015,43(2):218-225
24PeuravuoriJ,PihlajaK.Anal.Chim.Acta,1997,337(2):133-149
25ZHUPeng,LIUChengLin,ZHUFei.SpectroscopyandSpectralAnalysis,2015,35(6):1611-1617
祝鹏,刘成林,祝飞.光谱学与光谱分析,2015,35(6):1611-1617
26CoblePG.Mar.Chem.,1996,51(4):325-346
27LeenheerJA,CroueJ.Environ.Sci.Technol.,2003,37(1):18A-26A
28YamashitaY,JaffeR.Environ.Sci.Technol.,2008,42(19):7374-7379
29HudsonN,BakerA,WardD,ReynoldsDM,BrunsdonC,CarliellMarquetC.Sci.TotalEnviron.,2008,391(1):149-158
30GONGXueYong,ZHANGHongZhi,HOUChao,WANGYuMin,DONGJian.ChineseJ.Anal.Chem.,2016,44(10):1533-1538
鞏学勇,张宏志,侯超,王玉民,董建.分析化学,2016,44(10):1533-1538
31StevensonFJ.HumusChemistryGenesisCompositionReactions,1983,135(6):642
32SpieringsJ,WormsIA,MiévilleP,SlaveykovaVI.Environ.Sci.Technol.,2011,45(8):3452-3458
33MaurerF,ChristlI,KretzschmarR.Environ.Sci.Technol.,2010,44(15):5787-5792
34TuomelaM,VikmanM,HatakkaA,ItvaaraM.BioresourceTechnol.,2000,72(2):169-183
35HeitmannT,GoldhammerT,BeerJ,BlodauC.GlobalChangeBiol.,2007,13(8):1771-1785
AbstractUltrafiltrationtechnologyandspectrumtechnologywereusedtostudythecompositionalandstructuralevolutionofsizefractionateddissolvedorganicmatter(DOM)duringchickenmanurecomposting.Electrochemicalmethodwasusedtomeasureelectrontransfercapacity.TheresultsshowedthatmostofproteinlikecomponentswereexistinDOM(MW<1kDa)anditwasthemaincomponentsinDOM(MW<1kDa)duringinitialcomposting.Theproteinlikecomponentswerepersistentlydegradedandthehumiclikecomponentswerepersistentlygeneratedduringcompostingprocess.Theproteinlikecomponentsdidn′texistinDOM(MW<1kDa)andthefulviclikecomponentswerethemaincomponentsintheendofcompostingprocess.ThehumiclikesubstanceswerethemainfluoresencecomponentsofDOM(MW=1-3kDa,MW=3-5kDa,MW>5kDa).ThoughthechangesofhumiclikecomponentswithdifferentmolecularweightofDOMweredifferentduringcomposting,thecontentofhumiclikecomponentsintheendofcompostingprocesswashigherthanthatintheinitialcompostingprocess.TheelectrondonatingcapacitywaspersistentlyreducingandelectronacceptingcapacitywaspersistentlyincreasingforDOMwithMW<1kDaintheprocessofcomposting.Incontrast,fortheDOMwithMW>1kDa,theelectrondonatingcapacitywaspersistentlyincreasingandtheelectronacceptingcapacitywasirregularintheprocessofcompostingprocess.Meanwhile,thechangeofelectrontransfercapacitywasirregularforDOMwithMW=1-3kDaandMW=3-5kDa.Inaword,EACofcompostderivedDOMwithsizefractionationwascontrolledbythearomaticcarboncontentwhichwasderivedfromlignindegradation,butnotrelatedtospectrumparameter.
KeywordsComposting;Dissolvedorganicmatter;Molecularweight;Electrontransfercapacity;Parallelfactoranalysis
(Received11October2016;accepted6December2016)
ThisworkwassupportedbytheChinaNationalFundsforDistinguishedYoungScientists(No.51325804)andtheNationalNaturalScienceFoundationofChina(No.51508540)

