比较三种新型生物制剂治疗中重度活动性类风湿关节炎的疗效与安全性
赵 征,朱 剑,张江林,张亚美,黄 烽,邓小虎(解放军总医院风湿科,北京 100853)
比较三种新型生物制剂治疗中重度活动性类风湿关节炎的疗效与安全性
赵 征,朱 剑,张江林,张亚美,黄 烽,邓小虎(解放军总医院风湿科,北京 100853)
目的:观察利妥昔单抗、托珠单抗及阿达木单抗联合慢作用抗风湿药物(DMARDs)治疗中重度活动性类风湿关节炎24周后的疗效和安全性。方法:共入组87例DAS28 > 3.2的活动性类风湿关节炎患者,给予利妥昔单抗或托珠单抗或阿达木单抗同时联合DMARDs,或仅用DMARDs药物治疗,主要疗效指标为达到ACR20的患者比例,次要疗效指标为达到ACR50、ACR70的比例及DAS28-CRP的改善情况。结果:在24周时,利妥昔单抗、托珠单抗及阿达木单抗达到ACR20的比例分别为66.67%、94.44%和73.08%,而单用DMARDs组则为53.57%,同时各治疗组患者DAS28-CRP亦较基线及仅用DMARDs组显著下降,且托珠单抗及阿达木单抗组优于利妥昔单抗组。最常见的不良事件为上呼吸道感染,其次是淋巴细胞下降及肝功能异常。结论:利妥昔单抗、托珠单抗及阿达木单抗对类风湿关节炎均具有显著的疗效和良好的安全性,阿达木单抗及托珠单抗的疗效优于利妥昔单抗。
生物制剂;类风湿关节炎;疗效;安全性;药品不良反应
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的以慢性多关节滑膜炎为主要临床表现的自身免疫性疾病,发病率高,致残性强,以对称性、进行性和破坏性关节病变为主要特征,严重者可出现关节畸形。随着生物制剂的应用(包括抗肿瘤坏死因子-α[1-2],IL-1受体抑制剂[3],人鼠崁合的抗CD20单克隆抗体[4],以及IL-6受体单抗),治疗炎性关节炎发生了一系列的变化。
本研究选择了3种不同作用机制治疗类风湿关节炎的生物制剂,包括利妥昔单抗、托珠单抗及阿达木单抗。利妥昔单抗是一种新型的基因工程技术制备的治疗性抗CD20单克隆抗体,能选择性结合CD20(+)B细胞。托珠单抗是一种免疫球蛋白IgG1(γ1,κ)子类重组人源化抗人白介素6(IL-6)受体单抗,目前尚未在我国上市,该实验的用药者为参加我院Ⅲ期临床试验的类风湿关节炎患者,该药物观察为上海罗氏公司进行的全国多中心临床研究,获得解放军总医院伦理委员会批准,本研究仅选取了在我院参加该实验的类风湿关节炎患者。阿达木单抗是直接针对TNF-α的抑制剂,是只含人多肽序列的重组全人源免疫球蛋白(IgG1)单克隆抗体。上述三种生物制剂均被证实可以显著缓解活动期类风湿关节炎的症状,本研究比较了这三种药物治疗中重度活动性类风湿关节炎的疗效及安全性,以期为临床用药选择提供参考。
1 资料与方法
1.1 研究对象
选取18岁以上的活动性类风湿关节炎患者,均符合1987年美国风湿病协会(American College of Rheumatology,ACR)的类风湿关节炎分类标准,患者同时服用慢作用抗风湿药物(disease-modifying antirheumatic drugs,DMARDs),包括甲氨蝶呤、羟氯喹和来氟米特,可以单用或联用上述DMARDs,但禁止甲氨蝶呤和来氟米特联用,剂量要求稳定8周以上。允许使用非甾体类抗炎药及皮质激素(强的松≤ 10 mg·d-1或相当剂量),剂量稳定至少4周。同时排除其他感染性及慢性疾病,以及已知对这三种生物制剂过敏的患者,所有患者进行为期24周的疗效及不良反应观察。
1.2 治疗方法
利妥昔单抗组每24周于第1日和第15日静脉输注利妥昔单抗500 mg或1000 mg,之前30 ~ 60 min内口服对乙酰氨基酚1 g和马来酸氯苯那敏8 mg,输注前30 min,给予静滴甲基强的松龙100 mg以减少可能出现的输液反应。托珠单抗组每4周静脉输注托珠单抗8 mg·kg-1。阿达木单抗组每2周皮下注射阿达木单抗40 mg。
1)以ACR20为主要疗效指标,ACR50及ACR70为次要疗效指标。ACR20标准:肿胀及触痛关节数均达到减少≥ 20%;且在下面5个指标中有3项改善≥20%:①受试者评估的疼痛VAS评分;②受试者评估的疾病总体状况VAS评分;③研究者评估的疾病总体状况VAS评分;④健康状况问卷(HAQ);⑤CRP。ACR50、ACR70改善:采用与ACR20相同的标准,定义为至少有3项获得50%或70%的改善。
2)疾病活动情况:①DAS28即疾病活动性评分(disease activity score,DAS),包括人体28个关节的压痛计数、肿胀计数、CRP水平以及病人的自身综合评估四个项目。凡有压痛或者肿胀的关节得1,有压痛同时又有肿胀的关节得2,然后将所有的数据加起来,代入公式计算。可按照DAS28将疾病的活动性分为四级:缓解(< 2.6)、轻度活动(≥2.6,但< 3.2)、中度活动(≥3.2,但< 5.1)和重度活动(≥5.1)。②CRP。
3)安全性评价:收集本实验过程中所有不良事件(AE)。
1.4 统计学方法
采用STATA 7.0统计分析软件对数据进行处理,以P < 0.05为差异有统计学意义。数据以()表示,首先进行方差齐性检验,如结果满足方差齐性,则采用单因素方差分析或t检验方法,如不满足方差齐性,则采用秩转换检验方法。
2 结果
2.1 一般情况
共入组87例类风湿关节炎患者,详见表1。
规模上,虽然大多宣称支持上万路摄像头的大型组网,但由于各家软件内部底层设计和存储转发转码等技术水平差异,还需要实际应用案例和运营状况的事实支撑。
表1 87例类风湿关节炎患者一般情况.Tab 1 Demographic and baseline characteristics in 87 patients with RA.
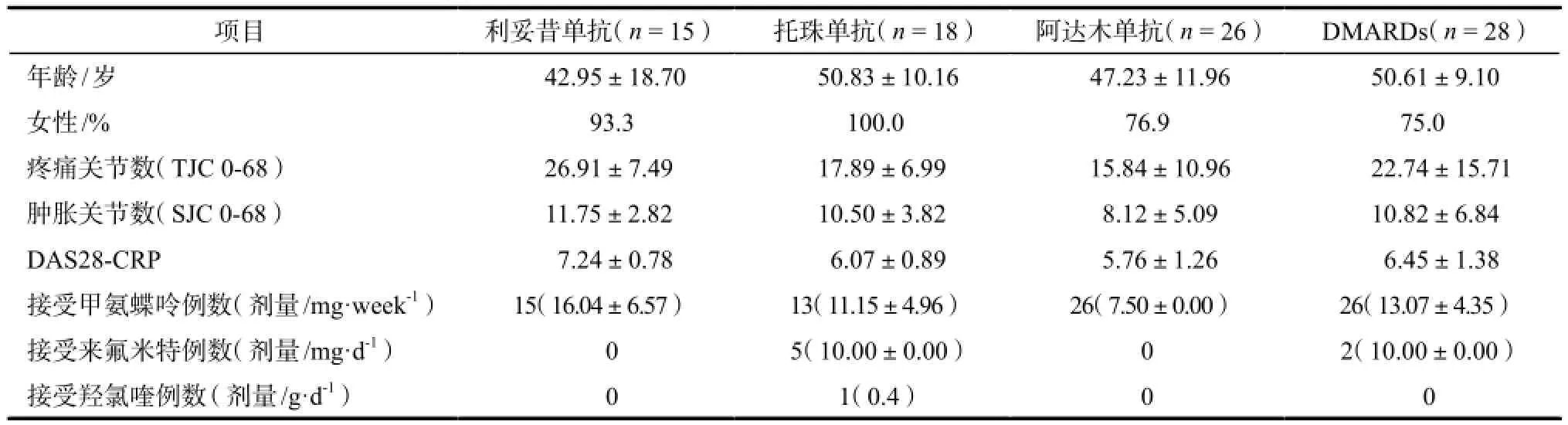
表1 87例类风湿关节炎患者一般情况.Tab 1 Demographic and baseline characteristics in 87 patients with RA.
项目 利妥昔单抗(n = 15) 托珠单抗(n = 18) 阿达木单抗(n = 26) DMARDs(n = 28)年龄/岁 42.95±18.70 50.83±10.16 47.23±11.96 50.61±9.10女性/% 93.3 100.0 76.9 75.0疼痛关节数(TJC 0-68) 26.91±7.49 17.89±6.99 15.84±10.96 22.74±15.71肿胀关节数(SJC 0-68) 11.75±2.82 10.50±3.82 8.12±5.09 10.82±6.84 DAS28-CRP 7.24±0.78 6.07±0.89 5.76±1.26 6.45±1.38接受甲氨蝶呤例数(剂量/mg·week-1) 15(16.04±6.57) 13(11.15±4.96) 26(7.50±0.00) 26(13.07±4.35)接受来氟米特例数(剂量/mg·d-1) 0 5(10.00±0.00) 0 2(10.00±0.00)接受羟氯喹例数 (剂量/g·d-1) 0 1(0.4) 0 0
各组患者在入组时年龄、性别、关节肿胀及疼痛数、疾病活动度等均无显著性差异,其中阿达木单抗组2例因疗效不佳,1例因不良事件退出研究,单用DMARDs组有2例因疗效不佳退出研究。所有患者均接受稳定剂量的DMARDs治疗8周以上,其中托珠单抗组有5例,DMARDs组有2例接受了来氟米特治疗,仅1例托珠单抗组的患者联合来氟米特及羟氯喹治疗。其余患者均接受甲氨蝶呤治疗。
2.2 疗效指标及疾病活动情况
2.2.1 主要疗效指标随时间推移的ACR20产生应答患者的比例情况详见表2。
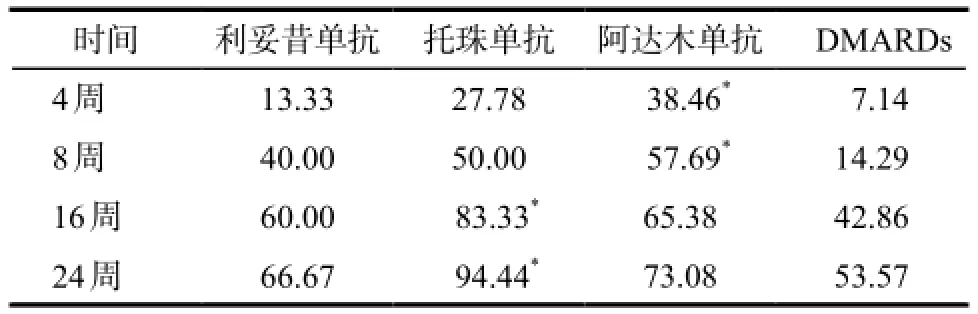
表2 患者在各时间点达到ACR20的比例.%Tab 2 The proportion of ACR20 in patients with different treatment time. %
由表2可见,阿达木单抗治疗组在4周和8周时达到ACR20的比例较DMARDs组显著升高(P <0.05),16周之后,托珠单抗治疗组达到ACR20的比例较DMARDs组显著升高(P < 0.05),在24周时利妥昔单抗、托珠单抗、阿达木单抗及DMARDs组达到ACR20患者的比例分别为66.67%、94.44%、73.08%和53.57%。
2.2.2 次要疗效指标随时间推移的ACR50、ACR70产生应答患者的比例情况详见表3。
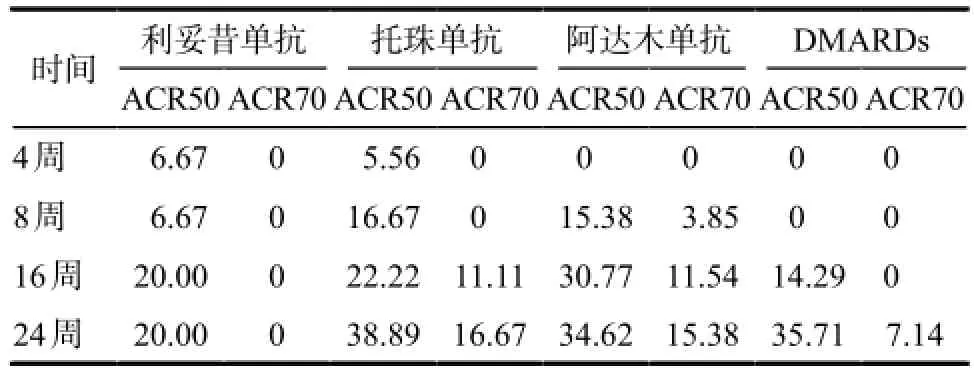
表3 患者在各时间点达到ACR50、ACR70的比例.%Tab 3 The proportion of ACR50, ACR70 in patients with different treatment time. %
结果显示利妥昔单抗、托珠单抗及阿达木单抗治疗组24周时达到ACR50的患者比例分别为20.00%、38.89%、34.62%,且托珠单抗及阿达木单抗治疗组分别有16.67%和15.38%的患者达到ACR70,但与DMARDs组相比差异无统计学意义。
2.2.3 24周时各指标变化情况24周时,各组对ACR核心内容(包括关节压痛数、肿胀数、患者对疼痛及疾病活动的总体评价、医师对疾病活动的总体评价、HAQ及CRP)的改善情况详见表4。
表4 24周时ACR核心内容的改善情况.Tab 4 Response of ACR core components in twenty-fourth weeks.
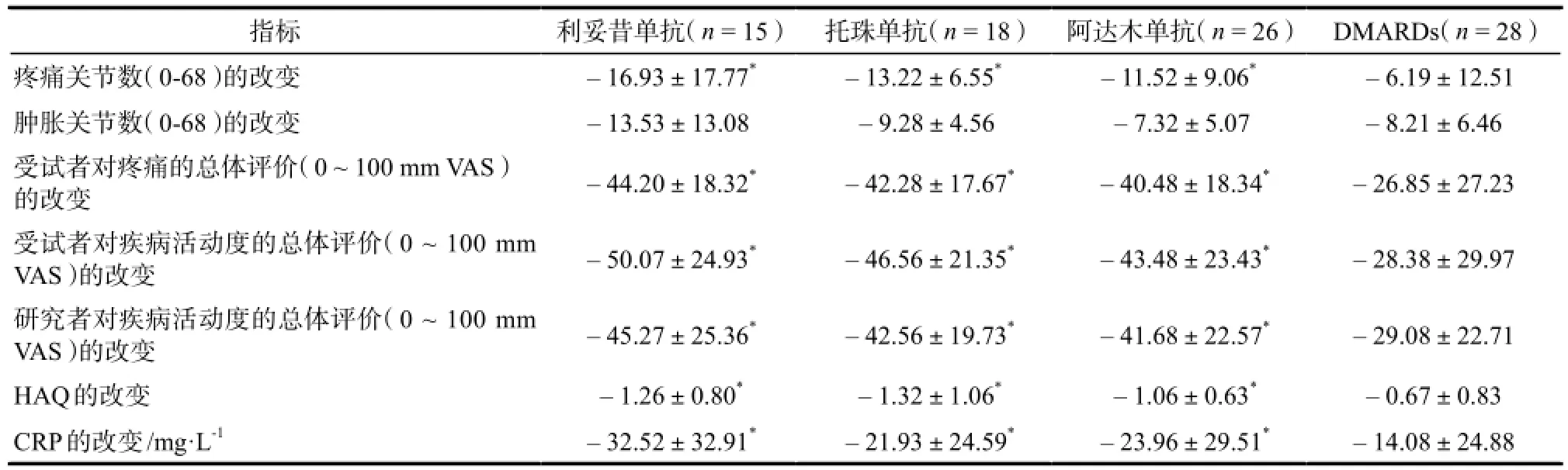
表4 24周时ACR核心内容的改善情况.Tab 4 Response of ACR core components in twenty-fourth weeks.
注:与DMARDs组比较,*P < 0.05Note: compared with DMARDs group,*P < 0.05
指标 利妥昔单抗(n = 15) 托珠单抗(n = 18) 阿达木单抗(n = 26) DMARDs(n = 28)疼痛关节数(0-68)的改变 – 16.93±17.77* – 13.22±6.55* – 11.52±9.06* – 6.19±12.51肿胀关节数(0-68)的改变 – 13.53±13.08 – 9.28±4.56 – 7.32±5.07 – 8.21±6.46受试者对疼痛的总体评价(0 ~ 100 mm VAS)的改变– 44.20±18.32* – 42.28±17.67* – 40.48±18.34* – 26.85±27.23受试者对疾病活动度的总体评价(0 ~ 100 mm VAS)的改变 – 50.07±24.93* – 46.56±21.35* – 43.48±23.43* – 28.38±29.97研究者对疾病活动度的总体评价(0 ~ 100 mm VAS)的改变 – 45.27±25.36* – 42.56±19.73* – 41.68±22.57* – 29.08±22.71 HAQ的改变 – 1.26±0.80* – 1.32±1.06* – 1.06±0.63* – 0.67±0.83 CRP的改变/mg·L-1 – 32.52±32.91* – 21.93±24.59* – 23.96±29.51* – 14.08±24.88
结果表明各组除关节肿胀数外,其余ACR核心内容在24周时均较基线明显改善,而生物制剂组明显优于DMARDs组(P < 0.05),但各生物制剂组之间没有显著性差异。
2.2.4 疾病活动情况DAS28-CRP随着时间的推移,各组DAS28-CRP值较基线均显著降低,其中托珠单抗及阿达木单抗组的DAS28-CRP值自4周起较利妥昔单抗组、DMARDs组显著降低(P < 0.01),但利妥昔单抗组与DMARDs组比较差异无统计学意义。详见表5。
2.3 不良事件发生情况
共发生不良事件51例次,均为轻中度、暂时性,无严重不良事件,未经任何特殊治疗,亦不影响实验研究,在随访结束时均恢复正常,其中考虑与药物相关的不良事件主要包括上呼吸道感染、肝酶异常、白细胞下降等。各组之间比较差异无统计学意义。见表6。
3 讨论
利妥昔单抗、托珠单抗及阿达木单抗分别针对B细胞、IL-6及TNF-α发挥作用,国外一项对161名类风湿关节炎患者的随机、对照、双盲研究[5]显示,在24周时,利妥昔单抗联合环磷酰胺或甲氨蝶呤组在ACR的改善率上明显高于单用甲氨蝶呤组,而单用利妥昔单抗组的疗效虽在数值上略高于单用甲氨蝶呤组,但差异无统计学意义。同时,关于托珠单抗的研究也指出,其可显著改善类风湿关节炎患者症状、降低疾病活动性[6],且该药单用与联合其余DMARDs类特别是甲氨蝶呤疗效相当[7]。研究[8]指出,阿达木单抗亦可显著改善类风湿关节炎患者的临床症状及实验室指标。有学者认为,应尽早的缓解类风湿关节炎患者的病情,特别是对中重度且对DMARDs不敏感的类风湿关节炎患者,应联合使用生物制剂治疗[9-10]。
表5 患者在各时间点DAS28-CRP值.Tab 5 DAS28-CRP responses in patients with different treatment time.
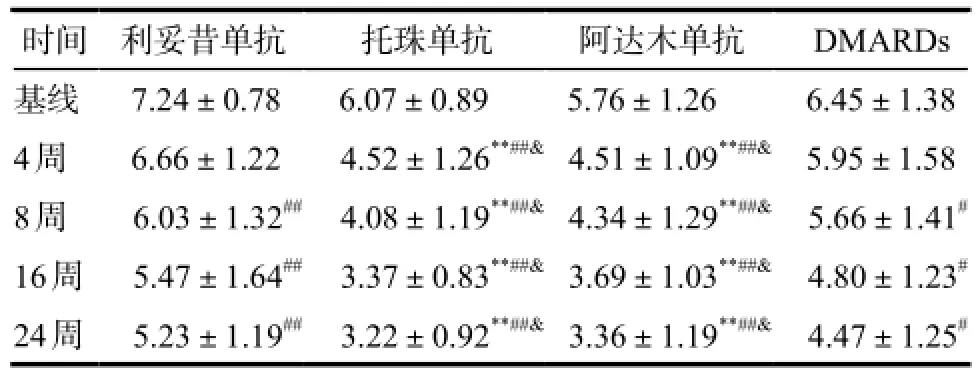
表5 患者在各时间点DAS28-CRP值.Tab 5 DAS28-CRP responses in patients with different treatment time.
注:与DMARDs组比较,*P < 0.05,**P < 0.01;与基线比较,#P <0.05,##P < 0.01;与利妥昔单抗组比较,&P < 0.01Note: compared with DMARDs group,*P < 0.05,**P < 0.01; compared with baseline,#P < 0.05,##P < 0.01; compared with rituximab group,&P < 0.01
时间 利妥昔单抗 托珠单抗 阿达木单抗 DMARDs基线 7.24±0.78 6.07±0.89 5.76±1.26 6.45±1.38 4周 6.66±1.22 4.52±1.26**##&4.51±1.09**##& 5.95±1.58 8周 6.03±1.32## 4.08±1.19**##&4.34±1.29**##& 5.66±1.41#16周 5.47±1.64## 3.37±0.83**##&3.69±1.03**##& 4.80±1.23#24周 5.23±1.19## 3.22±0.92**##&3.36±1.19**##& 4.47±1.25#
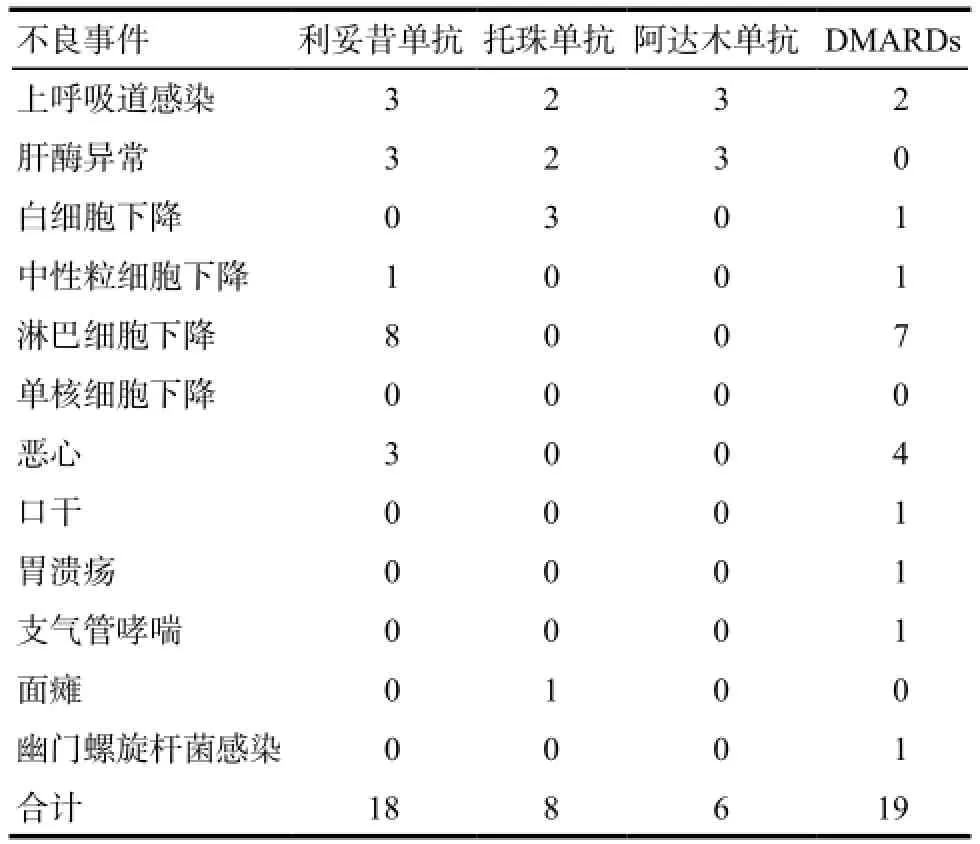
表6 不良事件发生情况.例次Tab 6 Occurrence of adverse events. case
本研究发现,阿达木单抗治疗组在4周和8周时达到ACR20的比例较DMARDs组显著升高(P <0.05),16周之后,托珠单抗治疗组达到ACR20的比例较DMARDs组显著升高(P < 0.05)。但利妥昔单抗组与DMARDs组达到ACR20的比例没有统计学差异,可能与入选病例较少有关。进一步分析各组的ACR核心内容,包括关节压痛数、患者对疼痛及疾病活动的总体评价、医师对疾病活动的总体评价、HAQ及CRP,发现各生物制剂组均较DMARDs组明显改善,但各生物制剂组之间没有明显差异。
DAS28-CRP可以反映疾病的活动度,本研究发现托珠单抗及阿达木单抗治疗组患者的DAS28-CRP值自4周起较基线及DMARDs组显著降低(P <0.01),利妥昔单抗组及DMARDs组自8周起DAS28-CRP值亦较基线显著降低(P < 0.05),相互比较时发现,自4周起,利妥昔单抗组DAS28-CRP下降程度不及托珠单抗及阿达木单抗治疗组(P < 0.01),而托珠单抗与阿达木单抗组相比,DAS28-CRP差异无统计学意义。
综上,本研究结果显示利妥昔单抗、托珠单抗及阿达木单抗均能较好的改善类风湿关节炎患者的病情,降低患者的疾病活动度。阿达木单抗起效最快,托珠单抗的疗效最为显著,在降低疾病活动的功效上,托珠单抗及阿达木单抗均优于利妥昔单抗。从经济学角度分析,建议为中重度类风湿关节炎患者选择生物制剂治疗时,应首选托珠单抗或阿达木单抗。
[1]Segal B, Rhodus NL, Patel K. Tumor necrosis factor (TNF) inhibitor therapy for rheumatoid arthritis[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2008, 106(6): 778-787.
[2]Toussirot E, Wendling D. The use of TNF-alpha blocking agents in rheumatoid arthritis: an update[J]. Expert Opin Pharmacother, 2007, 8(13): 2089-2107.
[3]Mertens M, Singh JA. Anakinra for rheumatoid arthritis: a systematic review[J]. J Rheumatol, 2009, 36(6): 1118-1125.
[4]Dass S, Vital EM, Emery P. Rituximab: novel B-cell depletion therapy for the treatment of rheumatoid arthritis[J]. Expert Opin Pharmacother, 2006, 7(18): 2559-2570.
[5]Edwards JC, Szczepanski L, Szechinski J, et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis[J]. N Engl J Med, 2004, 350(25): 2572-2581.
[6]Nishimoto N, Miyasaka N, Yamamoto K, et al. Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with an inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endothelial growth factor by IL-6 receptor inhibition therapy[J]. Mod Rheumatol, 2009, 19(1): 12-19.
[7]Ruderman EM. The role of concomitant methotrexate in biologic therapy for rheumatoid arthritis[J]. Bull Hosp Jt Dis, 2013, 71(Suppl 1): S29-S32.
[8]Krieckaert CL, Nair SC, Nurmohamed MT, et al. Personalised treatment using serum drug levels of adalimumab in patients with rheumatoid arthritis: an evaluation of costs and effects[J]. Ann Rheum Dis, 2013, 12(21): 204101
[9]Nam JL, Winthrop KL, van Vollenhoven RF, et al. Current evidence for the management of rheumatoid arthritis with biological disease-modifying anti-rheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of RA[J]. Ann Rheum Dis, 2010, 69(6): 976-986.
[10]Smolen JS, Aletaha D, Bijlsma JW, et al. Treating rheumatoid arthritis to target: recommendations of an international task force[J]. Ann Rheum Dis, 2010, 69(4): 631-637.
Ef fi cacy and safety of three new biologics in the treatment of moderate to severe rheumatoid arthritis
ZHAO Zheng, ZHU Jian, ZHANG Jiang-lin, ZHANG Ya-mei, HUANG Feng, DENG Xiao-hu(Department of Rheumatology, PLA General Hospital, Beijing 100853, China)
Objective:To observe the efficacy and safety of rituximab, tocilizumab and adalimumab combined with disease-modifying antirheumatic drugs (DMARDs) in patients with rheumatoid arthritis (RA).Methods:A total of 87 RA patients with a 28-joint Disease Activity Score (DAS28) > 3.2 were randomly given rituximab, tocilizumab, adalimumab combined with DMARDs respectively or DMARDs alone for 24 weeks. The primary end point was the proportion of patients achieving American College of Rheumatology criteria for 20% improvement (ACR20). The secondary end points included the proportion of patients achieving ACR50, ACR70, improvement of DAS28, C-reactive protein (CRP) and Health Assessment Questionnaire (HAQ). Safety was assessed by adverse event documentation.Results:At the end of the 24thweek, 82 patients completed the treatment. The proportion of patients achieving ACR20 treated by rituximab + DMARDs, tocilizumab + DMARDs, adalimumab + DMARDs, DMARDs alone was 66.67%, 94.44%, 73.08% and 53.57% respectively. Results for other secondary efficacy endpoints showed that these three new biologics could provide substantial bene fi ts to patients with RA by reducing clinical signs, HAQ and DAS28. Ef fi cacy of tocilizumab and adalimumab were better than rituximab. Most treatment-related adverse events were mild to moderate. The most common adverse event was upper respiratory tract infection. Lymphocytes decreased and abnormal liver function was next. No serious infections were observed.Conclusion:These three new biologics have signi fi cant ef fi cacy and good safety towards RA patients. The ef fi cacy of tocilizumab and adalimumab are better than rituximab.
Biologics; Rheumatoid arthritis; Ef fi cacy; Safety; Adverse drug reaction
R971+.1;R969.4
A
1672 – 8157(2014)03 – 0134 – 05
2013-09-08
2014-01-09)
邓小虎,男,副主任医师,主要从事风湿病方面的工作。E-mail:dengxh1970@sina.com
赵征,女,主治医师,主要从事风湿病方面的工作。E-mail:sisyzz1979@126.com

