PXR基因多态性与心脏移植术后稳定期环孢素血药浓度的相关性
石秀锦,魏国义,林 阳,钟 逾,张海波,孟 旭,秦 英,李 骁,白玉国,郑青敏,周 洋,贾一新(.首都医科大学附属北京安贞医院药剂科,北京 0009;.毅新兴业(北京)科技有限公司,北京 00080;.首都医科大学附属北京安贞医院心外科,北京 0009)
PXR基因多态性与心脏移植术后稳定期环孢素血药浓度的相关性
石秀锦1,魏国义1,林 阳1,钟 逾2,张海波3,孟 旭3,秦 英1,李 骁1,白玉国1,郑青敏1,周 洋1,贾一新3(1.首都医科大学附属北京安贞医院药剂科,北京 100029;2.毅新兴业(北京)科技有限公司,北京 100080;3.首都医科大学附属北京安贞医院心外科,北京 100029)
目的:探讨心脏移植患者术后口服免疫抑制剂环孢素的血药浓度与PXR基因多态性的相关性。方法:应用飞行时间质谱技术对59例心脏移植术后稳定期患者的PXR基因型进行检测,全自动化学免疫分析仪测定环孢素的血药浓度,并通过统计学分析PXR各单核苷酸多态性(SNP)位点基因型对环孢素血药浓度的影响。结果:PXR基因筛选出的8个Tag SNP位点次要等位基因频率(MAF)与NCBI的dbSNP数据库中中国人的数据相近。对于59名稳定期心脏移植患者PXR基因8个Tag SNP中,仅携带PXR rs1523127(C 24381 A)位点AA型基因的患者血药浓度及校正血药浓度明显低于CA型,CA型又低于CC型患者,差异均具有统计学意义(P < 0.05)。其他7个Tag SNP rs3814056T > G、rs7643645A > G、rs11917714C > T、rs2276705C > A、rs2472681T > C、rs2472682C > A、rs4440154C > T各基因型组间环孢素血药浓度的差异均无统计学意义。结论:PXR rs1523127(C 24381 A)基因型与心脏移植稳定期患者环孢素血药浓度显著相关,提示该SNP可能会在环孢素个体化用药中发挥重要作用。
飞行时间质谱技术;心脏移植;环孢素;血药浓度;孕烷X受体;基因多态性
心脏移植是治疗各种原因所致终末期心脏病的有效方法。免疫抑制治疗是关系到心脏移植术后能否长期生存的关键因素之一[1]。环孢素(cyclosporine A,CsA)因具有较强的免疫活性,已成为广泛用于器官移植术后抗排异反应的基础免疫抑制剂。该药在发挥疗效的同时,表现出明显的药代动力学个体差异以及狭窄的治疗窗。因此,需要对服药患者定时进行CsA血药浓度监测,以保证最佳治疗效果并最大限度地减少排斥反应及毒副作用。目前,临床多根据体质量确定CsA的初始剂量,维持剂量依据CsA全血谷浓度(C0)、峰浓度(C2)及患者情况进行调整。但上述方法难以针对不同个体最佳初始剂量作出准确、有效的判断。随着药物基因组学的发展,通过基因水平检测信息对药物体内代谢强度进行预判已受到广大学者的关注。本研究旨在探讨CsA 代谢酶CYP3A4以及转运体P-糖蛋白(P-gp)编码基因共同的上游调控基因孕烷X受体(pregnane X receptor,PXR)的基因多态性对心脏移植术后稳定期患者CsA血药浓度的影响,旨在为临床合理用药提供参考。
1 对象与方法
1.1 研究对象
选取2004年1月– 2012年12月在北京安贞医院接受心脏移植手术并门诊随访的患者。入选条件为心脏移植术后接受环孢素、吗替麦考酚酯和糖皮质激素三联免疫抑制方案,汉族,术后时间≥6个月,环孢素服用≥2个月,未联合使用CYP3A的诱导剂或抑制剂,且临床相应研究资料以及DNA标本可以获得。依据以上入选条件共筛选了59例心脏移植患者参与该项研究。本研究经我院伦理委员会批准,并与患者或其家属签署知情同意书。
1.2 标本采集与分离
随访时,收集患者清晨服药前静脉血进行血药浓度监测,留取监测后乙二胺四乙酸(EDTA)抗凝的静脉全血2 mL,应用全基因组DNA提取试剂盒(北京天根生化有限公司),按照说明书从1 mL外周血中提取白细胞基因组DNA,溶解于0.1×TE缓冲液中(10 mmol·L-1Tris-HCL,1 mmol·L-1EDTA,pH 8.0),于– 20 ℃冰箱储存备用。使用前经DU 800 spectrophotometer 检测,D(260)/D(280)均在1.6 ~2.0 范围内,DNA浓度均在10 ng·mL-1以上。
1.3 环孢素血药浓度的测定
CsA血药浓度首次测定在患者规律服用CsA 2 ~6 d后进行,术后3个月内每月监测2 ~ 3次,3个月后每月监测1次。若血药浓度过高或偏低,则调整CsA剂量,并于调整剂量后2 ~ 6 d再予测定,直至达到治疗浓度范围。每次均在清晨服药前取外周静脉血2 mL,置于EDTA-K抗凝管,应用AxSYM全自动化学免疫分析仪(美国雅培公司)测定CsA的谷浓度(C0)。CsA血药浓度标准曲线范围为5 ~ 800 μg·L-1。根据个体服药剂量,计算出血药浓度与剂量比,以此作为校正血药浓度。
1.4 标签SNP的选择
使用HapMap数据库的人类全基因组的SNP基因型数据进行标签位点的选择。标签位点筛选遵循连锁不平衡值(r2)> 0.8的原则,即标签位点与所代表的位点之间有足够强的连锁不平衡(r2值> 0.8)[2]。再使用Haploview 4.2程序对从HapMap下载的中国汉族人群(CHB)基因型数据进行标签位点的选择,选择的位点仅限次要等位基因频率(The minor allele frequency, MAF) > 0.01,本研究共从PXR基因相关序列中找到8个Tag SNP。
1.5 SNP质谱分型
应用Sequenom公司的基质辅助激光解吸电离飞行时间质谱系统(MALDI-TOF MS)中的iPLEX试剂盒进行SNP基因型分析[3]。其步骤简述如下:1)多重PCR引物设计与扩增:5 μL反应体系中包括1×反应缓冲液,10 ng基因组DNA,0.5 U热启动Taq DNA聚合酶(HotStarTaq,Qiagen公司),500 μmol·L-1脱氧核糖核苷三磷酸(dNTPs),每个位点100 nmol·L-1上游和下游引物,置于384孔板中,使用ABI-9700 PCR扩增仪,于94 ℃15 min活化DNA 聚合酶后,于94 ℃变性20 s,56 ℃退火30 s,72 ℃延伸60 s,共循环45次。PCR产物用2.0%琼脂糖凝胶电泳检测。2)去除未反应的引物和dNTPs。PCR扩增后,在反应体系中加入2 μL 0.3 U 虾碱性磷酸酶(SAP),于37 ℃下恒温20 min进行多余碱基消减反应,再置于85 ℃放置5 min进行灭活。3)单碱基延伸PCR反应。应用iPLEX试剂盒。调节延伸引物的浓度,降低质谱峰图的背景噪音后,在9 μL反应体系中加入100 μmol·L-1dNTP 0.2 μL、0.05单位的上述DNA聚合酶0.04 μL、及625 ~1 250 nmol·L-1的延伸引物。先置PCR扩增仪94 ℃ 30 s,再进行延伸PCR反应循环:置94 ℃ 5 s,5 ×(52 ℃ 5 s + 80 ℃ 5 s),该循环共200次;最后置72 ℃延伸3 min。置4 ℃保存。4)纯化的延伸反应产物进行MALDITOF-MS分析:上述样品应用6 mg树脂脱盐处理后,应用自动机械臂点样仪转移至Sequenom的384孔质谱芯片上,另在384孔质谱芯片上设置4个孔的重复质控样品。在质谱分型系统中对点样后的质谱芯片进行基因分型。5)数据采集和基因型分析:不同的波谱峰形状代表电荷标记的不同质量。如果产物中存在两个单核苷酸多态性位点,每一个位点有一个等位基因,那么该等位基因是纯合子;如果质谱仪捕捉到4个不同的波谱峰,那么两个单核苷酸多态性是杂合子。通过操作界面Typer 4.0软件包读取质谱峰图,获得基因型数据。
1.6 统计学方法
2 结果
2.1 一般情况
59例心脏移植患者中,男性50例,女性9例,平均年龄(42.47±14.53)岁,平均体质量(67.37± 15.11) kg,平均身高(171.76±8.59) cm。
2.2 PXR基因单核苷酸多态性(SNP)的相关信息
PXR基因SNP的rs编号、染色体位置和等位基因频率见表1。所有位点均通过了Hardy-Weinberg平衡检验(P > 0.05)。本次实验数据PXR 8个Tag SNP位点次要等位基因频率(MAF)与NCBI的dbSNP数据库中中国人的数据相近。

表1 PXR基因8个单核苷酸多态性(SNP)的相关信息Tab 1 Information about 8 genotyped SNP of PXR gene
2.3 PXR基因分型结果及其对心脏移植患者环孢素药物浓度的影响
对于59名稳定期心脏移植患者PXR基因8个Tag SNP中,仅携带PXR rs1523127(C 24381 A)位点AA型基因的患者血药浓度及校正血药浓度明显低于CA型,CA型又低于CC型患者,差异均具有统计学意义(P <0.05)。其他7个Tag SNP rs3814056T > G、 rs7643645A >G、rs11917714C > T、rs2276705C > A、rs2472681T > C、rs2472682C > A、rs4440154C > T各基因型组间环孢素血药浓度的差异均无统计学意义。详见表2。
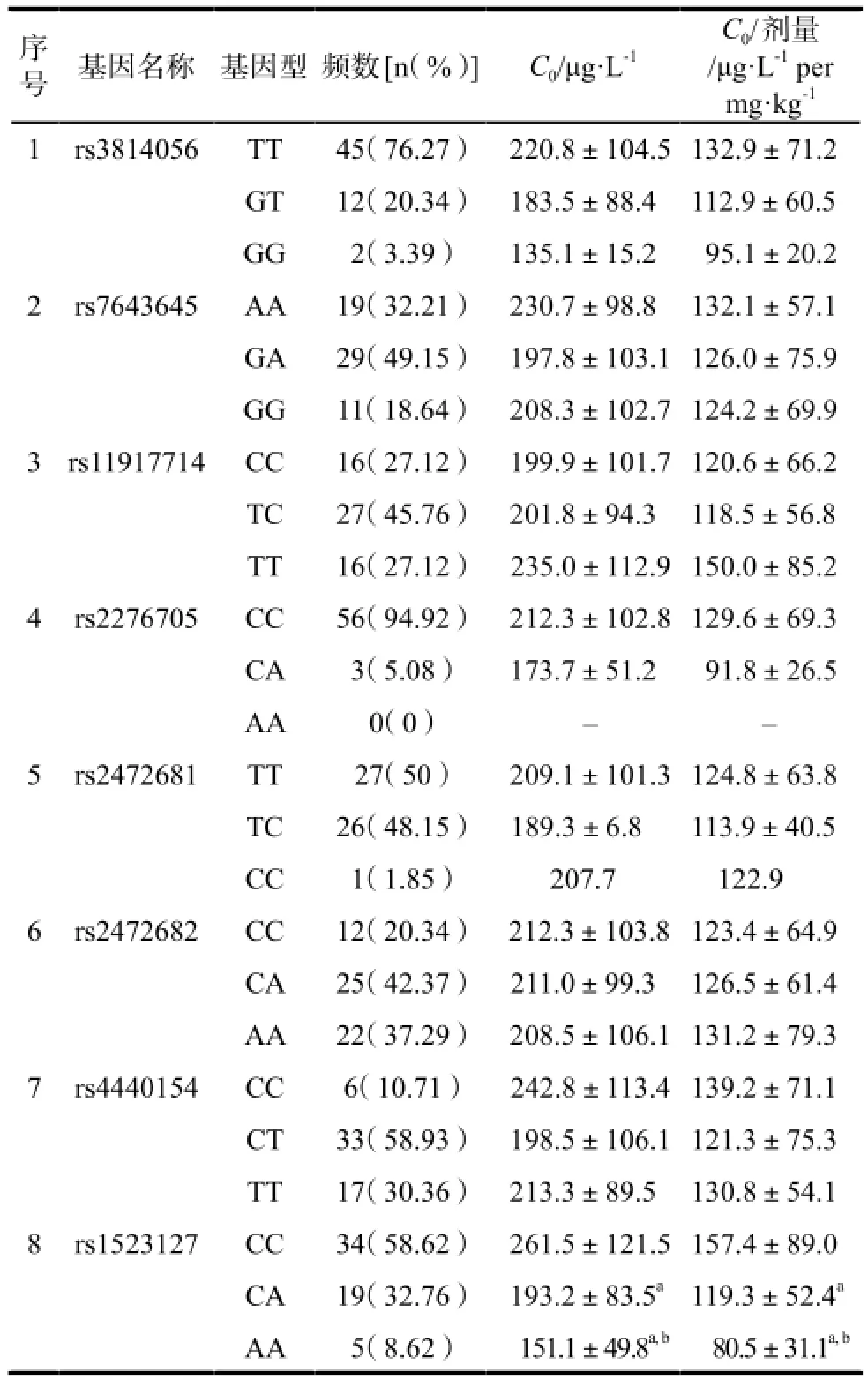
表2 PXR基因8个SNP基因分型及其对心脏移植患者环孢素血药浓度的影响Tab 2 Genotype frequencies of 8 Tags SNP of PXR gene and its in fl uence on the cyclosporine blood concentration of heart transplant patients
3 讨论
环孢素主要经CYP3A4、CYP3A5代谢,同时也是P-gp的底物,CYP3A5呈现显著的个体差异,与CsA 首过清除有紧密关系,多药耐药酶基因1(multidrug resistance gene 1, MDR1)编码CsA的转运蛋白P-gp,其外显子上的突变使得P-gp的表达和功能发生改变[4]。故小肠壁上皮细胞中P-gp活性及CYP3A4、CYP3A5基因多态性对CsA血药浓度有重要的影响[5]。近年来,核受体作为关键的转录调控因子在药物代谢酶及转运蛋白的表达调控中所起的重要作用逐渐被认识。其中, PXR属核受体NR1I亚家族,由NR1I2基因编码,是机体内环境稳态调节的重要环节,能同时调控代谢酶CYP3A4、CYP3A5以及转运体P-糖蛋白等多种基因的表达[6],因此NRlI2的基因多态性也可能通过影响CYP3A4、CYP 3A5、MDRl的表达从而间接影响环孢素的药动学。
本研究结果显示:59例心脏移植受者PXR 8个Tag SNP位点次要等位基因频率(MAF)与NCBI的dbSNP数据库中报道的中国人的次要等位基因频率相近。其中,PXR 7个Tag SNP位点的基因多态性对心脏移植受者CsA血药浓度均无影响;仅PXR rs1523127(C 24381 A)基因多态性对CsA血药浓度有明显影响,拟取得相同的血药浓度,携带突变型纯合子AA型患者要比突变型杂合子AC型和野生型CC型服用更高剂量的CsA。PXR rs1523127(C 24381A)位于5′非编码区(untranslated region,UTR),突变频率为31.2%,与NCBI的dbSNP数据库中报道的中国人的突变频率相近,而C24381A的突变频率在中国健康汉族人与已报道的白人和美国黑人有显著性差异[7]。已有研究表明该位点与CYP3A4的表型及肠道P-gp含量相关[8],进而影响CsA的血药浓度。Press等[9]对33例肾移植患者ABCB1、CYP3A4、CYP3A5和PXR(包括PXR C24381A)基因多态性对CsA药代动力学的影响进行了非线性混合效应模型研究,发现所选基因对CsA清除率没有很大的影响。国内目前未见关于PXR C24381A对环孢素药动学影响的报道。李澎灏等[10]对60例肾移植受者PXR与他克莫司药动学的相关性进行了研究,发现PXR C24381A(rs1523127)基因多态性突变频率为25%,对他克莫司血药浓度亦有明显影响,携带突变型纯合子AA型患者要比突变型杂合子AC型和野生型CC型服用更高剂量的他克莫司,研究结论与本研究一致。由此可见,CsA剂量调整的谷浓度是否会受到PXR C24381A基因多态性的影响,结果存在争议,这可能与实验病例较少,PXR基因多态性存在很大的种族差异性以及该基因并非是影响CsA代谢唯一因素等有关,仍需要对不同种族之间进行大样本对比研究。
药物基因组学为基因导向个体化药物治疗提供了新策略,用基因参数来预测免疫抑制剂的最合适服用初始剂量将会促进药物最佳临床疗效发挥。虽然它不能替代传统TDM,但对基因型探寻可以确定小部分患者对药物的高敏感型或者毒副反应的危险度,最终对于移植受者基因型可以添加到在选择免疫抑制剂方案中的己知危险因素中,为移植患者合理有效的个体化应用免疫抑制剂提供了更多的信息。
[1]郑奇军,蔡振杰,俞世强,等.心脏移植术后的免疫抑制治疗[J].第四军医大学学报,2004,25(10):926-927.
[2]Carlson CS, Eberle MA, Rieder MJ, et al. Selecting a maximally informative set of single-nucleotide polymorphisms for association analyses using linkage disequilibrium[J]. Am J Hum Genet, 2004, 74(1): 106-120.
[3]Buetow KH, Edmonson M, MacDonald R, et al. High-throughput development and characterization of a genomewide collection of gene-based single nucleotide polymorphism markers by chip-based matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Proc Natl Acad Sci U S A, 2001, 98(2): 581-584.
[4]Wang Y, Wang C, Li J, et al. Effect of genetic polymorphisms of CYP3A5 and MDR1 on cyclosporine concentration during the early stage after renal transplantation in Chinese patients cotreated with diltiazem[J]. Eur J Clin Pharmacol, 2009, 65(3): 239-247.
[5]谢宇,宋洪涛,王庆华,等.CYP3A5*3和MDR1 G2677T/A基因多态性对肾移植患者环孢素A血药浓度及疗效的影响[J].中国药学杂志,2011,46(20):1591-1596.
[6]Orans J, Teotico DG, Redinbo MR. The nuclear xenobiotic receptor pregnane X receptor: recent insights and new challenges[J]. Mol Endocrinol, 2005, 19(12): 2891-2900.
[7]Lamba J, Lamba V, Schuetz E. Genetic variants of PXR (NR1I2) and CAR (NR1I3) and their implications in drug metabolism and pharmacogenetics[J]. Curr Drug Metab, 2005, 6(4): 369-383.
[8]Svärd J, Spiers JP, Mulcahy F, et al. Nuclear receptor-mediated induction of CYP450 by antiretrovirals: functional consequences of NR1I2 (PXR) polymorphisms and differential prevalence in whites and sub-Saharan Africans[J]. J Acquir Immune Defic Syndr, 2010, 55(5): 536-549.
[9]Press RR, Ploeger BA, den Hartigh J, et al. Explaining variability in ciclosporin exposure in adult kidney transplant recipients[J]. Eur J Clin Pharmacol, 2010, 66(6): 579-590.
[10]李澎灏,王金平,李雯,等.孕烷X受体基因多态性对肾移植受者他克莫司浓度/剂量比的影响[J].中国临床药理学杂志,2013,29(6):446-448.
Relationship between genetic polymorphisms of PXR and cyclosporine blood concentration of stable heart transplant recipients
SHI Xiu-jin1, WEI Guo-yi1, LIN Yang1, ZHONG Yu2, ZHANG Hai-bo3, MENG Xu3, QIN Ying1, LI Xiao1, BAI Yu-guo1, ZHENG Qing-min1, ZHOU Yang1, JIA Yi-xin3(1. Department of Pharmacy, Beijing Anzhen Hospital Af fi liated to the Capital Medical University, Beijing 100029, China; 2. Bioyong Technologies Inc., Beijing 100080, China; 3. Department of Cardiac Surgery, Beijing Anzhen Hospital Af fi liated to the Capital Medical University, Beijing 100029, China)
Objective:To investigate the correlation between gene polymorphisms of pregnane X receptor (PXR) and cyclosporine blood concentration in heart transplant patients.Methods:MassARRAY was applied to detect the PXR genotypes of 59 stable heart transplant recipients. AxSYM fully-automated chemistry immune analyzer was used to detect the blood concentration of cyclosporine. And then the in fl uence of the genotypes of PXR single nucleotide polymorphism (SNP) on cyclosporine trough blood concentration was analyzed by statistical method.Results:The minor allele frequency (MAF) in 8 tags of PXR SNP of 59 patients obtained in this study was similar with that in NCBI's dbSNP database of Chinese population. The blood concentration and corrected concentration of cyclosporine in PXR rs1523127 (C 24381 A) AA patients were obviously lower than those of CA patients, and those of CA patients were obviously lower than those of CC patients (P < 0.05). There was no statistical difference in the cyclosporine blood concentrations in patients with the other seven PXR Tag SNP (rs3814056T > G, rs7643645A > G, rs11917714C > T, rs2276705C > A, rs2472681T > C, rs2472682C > A, rs4440154C > T).Conclusion:There was signi fi cant correlation between PXR rs1523127 (C24381A) genotype and cyclosporine blood concentration in stable heart transplant recipients, which indicated that this SNP may play an important role in the individual application of cyclosporine.
MassARRAY; Heart transplantation; Cyclosporine; Blood drug concentration; Pregnane X receptor (PXR); Genetic polymorphism
R979.5
A
1672 – 8157(2014)03 – 0152 – 04
2014-02-20
2014-04-08)
魏国义,女,主任药师,研究方向:临床药学与药事管理。E-mail:weiguoyi2013@163.com
石秀锦,女,主管药师,研究方向:临床药学与个体化用药。E-mail:xiujinshi@163.com

