类泛素蛋白与肝癌*
晏 琛 邵江华
原发性肝细胞癌(hepatocellular carcinoma,HCC,以下简称肝癌)是世界上最常见的恶性肿瘤之一,死亡率在恶性肿瘤中位居第三。我国每年肝癌的死亡人数约11万人,占全世界肝癌死亡人数的45%[1-2]。研究表明,肝癌具有多种诱发因素,如肝硬化、乙型肝炎病毒(hepatitis B virus,HBV)和丙型肝炎病毒(hepatitis C virus,HCV)感染、糖尿病以及黄曲霉毒素等[2]。肝癌发生、发展的分子生物学机制非常复杂,至今仍不明确。近年来有大量的研究表明类泛素蛋白(Ubiquitin-like proteins,UBLs)功能失调在人类恶性肿瘤包括肝癌的发生、发展过程中发挥了重要作用,并且可能成为一个新的肿瘤防治靶点[3]。类泛素蛋白发挥功能的重要方式是类泛素化修饰,它们通过对底物蛋白进行翻译后修饰参与到蛋白质降解、蛋白质功能调节以及基因损伤修复等生理过程中[4-5]。因此,阐明类泛素蛋白在肝癌发生发展过程中的作用机制将有助于为临床治疗提供理论基础,制定合理有效的治疗方案。本综述就以下几种类泛素蛋白与肝癌的关系做一阐述。
1 类泛素蛋白的结构及其酶修饰系统
类泛素蛋白是一类蛋白质序列和空间结构与泛素类似的蛋白[6]。它们具有一个或多个泛素样结构域,即三维核心结构-β-抓握折叠和C端甘氨酸-甘氨酸模体,这一结构域是类泛素蛋白结合底物的结构基础[6]。本文中介绍的类泛素蛋白结构[6-7]见图1,表1。
大多数类泛素蛋白可以通过级联酶催化与底物蛋白进行结合,并且其酶修饰系统的成员与泛素化酶修饰系统存在交叉,一般包括4类修饰酶,分别是泛素激活酶E1、泛素缀合酶E2、泛素连接酶E3和解聚酶[6-8]。类泛素化修饰过程以类泛素蛋白C端甘氨酸被E1激活酶激活为开端,随后将类泛素蛋白的一部分链接在E1激活酶的半胱氨酸的巯基上[8]。类泛素蛋白E1激活酶复合物接着与E2酶相互作用,类泛素蛋白被转移到E2缀合酶的特定半胱氨酸上。最后在E3连接酶帮助下,类泛素蛋白选择性的结合底物蛋白或其他大分子。同时现在大部分类泛素化修饰过程中存在解聚酶,它可以将类泛素蛋白与底物蛋白分离,从而使类泛素化修饰成为一个可逆的过程[8]。
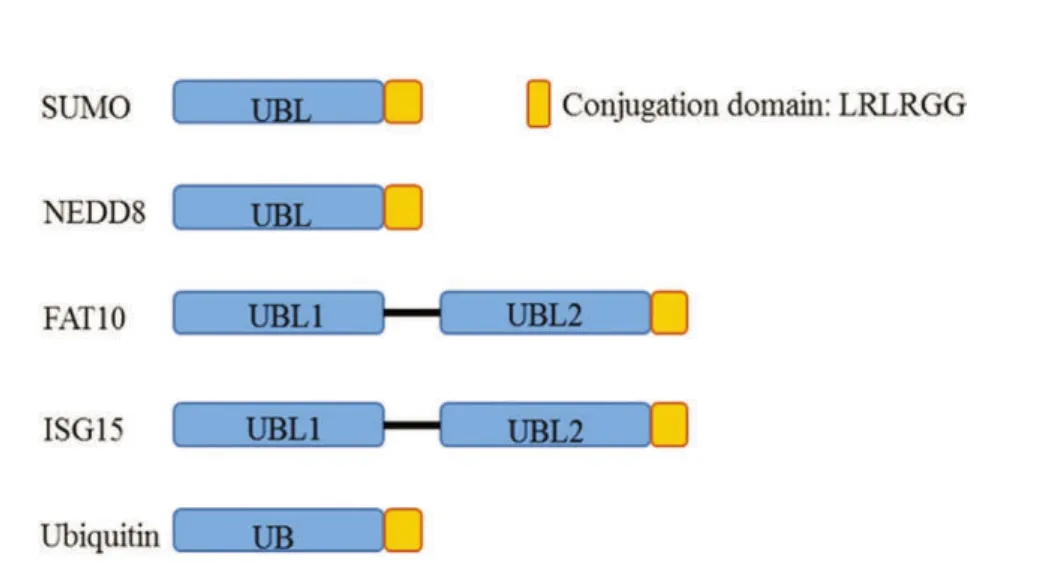
图1 SUMO,NEDD8,FAT10,ISG15与泛素的差异Figure 1 Difference between SUMO,NEDD8,FAT10,ISG15,and Ubiquitin
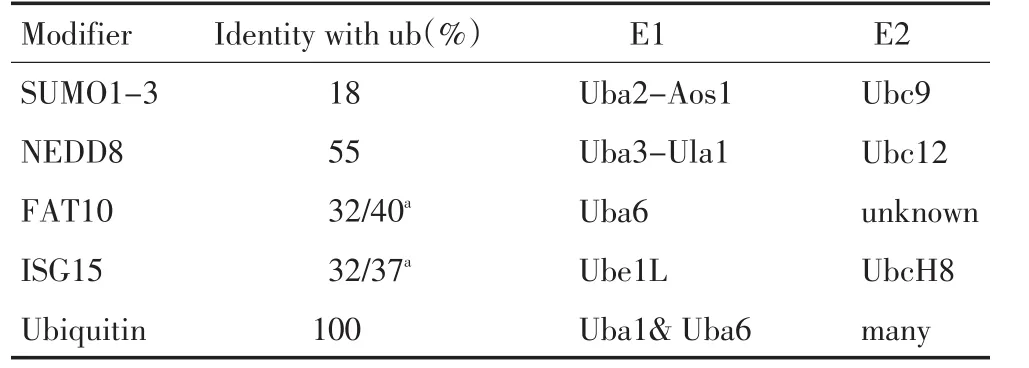
表1 SUMO,NEDD8,FAT10,ISG15与泛素的差异Table 1 Difference between SUMO,NEDD8,FAT10,ISG15,and Ubiquitin
2 类泛素蛋白在肝癌发生、发展中的作用
我国肝癌高发率与HBV病毒感染率高密切相关,同时肝癌细胞拥有很高的增殖和抗凋亡能力,而且肝癌对现有的化疗药物普遍不敏感,使得肝癌治疗更加棘手[9-11]。近年来的研究发现,类泛素蛋白主要参与病毒性肝炎向肝癌的转化、肝癌增殖能力的调节、肝癌新生血管的生成以及化疗敏感性等过程(图2),其中主要有泛素相关小修饰蛋白(Small Ubiquitin-like Modifier,SUMO),神经前体细胞表达发育调控蛋白8(neural precursor cell expressed developmentally down-regulated 8,NEDD8),双泛素(HLA-F adjacent transcript 10,FAT10),干扰素刺激基因15(interferon-stimulated gene 15,ISG15)。
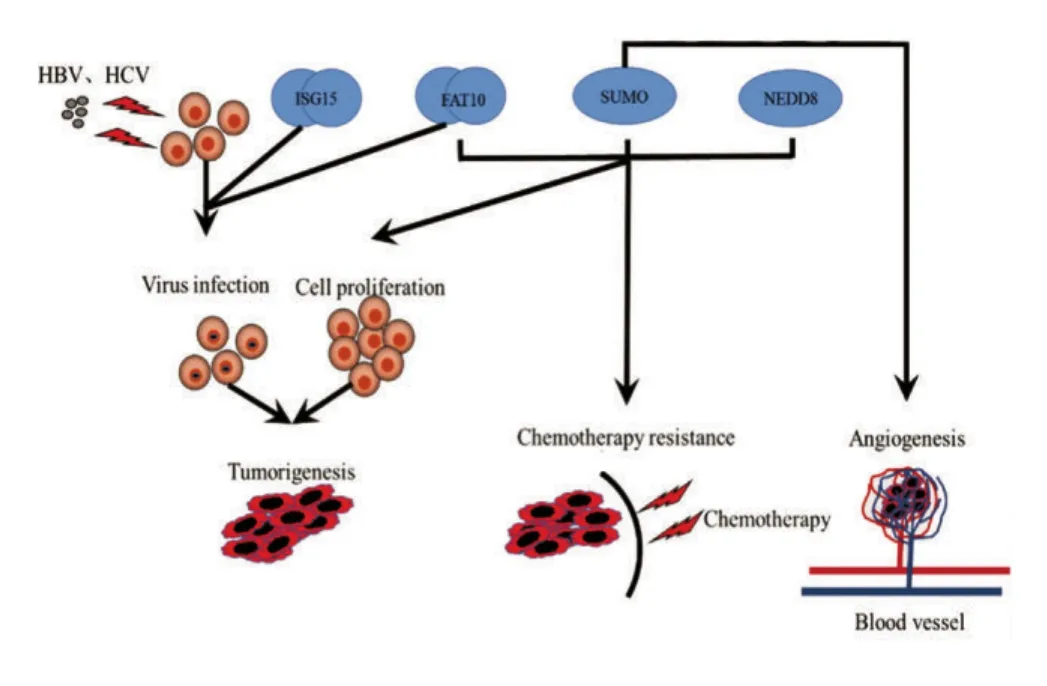
图2 类泛素蛋白在肝癌中的主要作用模式图Figure 2 Primary role of ubiquitin-like proteins in hepatocellular carcinoma
2.1 SUMO蛋白与肝癌的关系
SUMO蛋白由一个泛素样结构域组成,哺乳动物中已经发现四种SUMO蛋白亚型:SUMO1、SUMO2、SUMO3 和 SUMO4[12-13]。SUMO 结 合底物蛋白需要SUMO E1酶 SAE1/SAE2(SUMO-activating enzyme 1/SUMO-activating enzyme 2,SAE1/SAE2)复合体,特异的E2酶Ubc9以及多种E3酶[13]。现在已知6种SUMO解聚酶可以使SUMO蛋白与底物蛋白分离[13]。SUMO蛋白在细胞生理过程中主要参与稳定蛋白,核质转运,转录调节等功能[13]。
在Guo等[14]研究中首次发现在肝癌临床组织标本和肝癌细胞系中SUMO1表达水平普遍升高,并且干扰SUMO1表达可以抑制肝癌SMMC-7721细胞的增殖能力,表明SUMO1可能成为肝癌的潜在治疗靶点。研究者们还发现,肝癌中SUMO化修饰水平普遍增高,并促进肝癌的发生、发展[15]。Shen等[16]的研究中发现,β-连环蛋白的SUMO化修饰增强可以促进肝癌Hep-G2细胞的增殖能力。上述研究表明:SUMO及SUMO化水平在肝癌的增殖中起到促进作用,干扰SUMO可以降低肝癌的增殖能力,为肝癌的治疗提供新的作用靶点。
2.2 NEDD8蛋白与肝癌的关系
NEDD8蛋白由一个泛素样结构域组成,它结合底物蛋白的过程需要NEDD8 E1激活酶(NEDD8-activating enzyme,NAE),特异的E2酶Ubc12、Ube2f以及多种E3酶[17]。NEDD化修饰是一个可逆的过程,现在已知7种NEDD8解聚酶可以使NEDD8蛋白与底物蛋白分离[17]。NEDD8蛋白在细胞生理过程中主要参与稳定蛋白,调节底物蛋白活性以及转录调节等功能[17]。
NEDD8的靶蛋白目前发现有p53、鼠双微体基因(murine double mimute2,MDM2)、希佩尔林道基因(Von Hippel-l indau,VHL)和 Cullin家 族(Cullin-Ring E3 ligases,CRLs),通过调控这些靶蛋白从而影响肿瘤的发生和增殖[17-19]。在肝癌细胞中,NEDD8通过对靶蛋白MDM2调控从而影响肝癌细胞的增殖[20]。HuR蛋白(Hu antigen R,HuR)是一个RNA结合蛋白,主要起到调节细胞分化、增殖和存活的作用[21]。Embade等[20]研究发现NEDD8可以通过MDM2结合HuR蛋白从而抑制HuR降解,使肝癌细胞内HuR蛋白增多,进而促进肝癌细胞的增殖,这表明NEDD8/MDM2/HuR通路可以调节肝癌细胞的增殖能力。
2.3 FAT10蛋白与肝癌的关系
FAT10蛋白由两个泛素样结构域组成,FAT10具有两个E1激活酶UBE1、UBA6,特异的E2酶USE1,但其E3酶以及解聚酶并未见报道[22]。近年来研究表明,FAT10在肿瘤中涉及免疫炎性介导、核质信号转导、染色体稳定和细胞周期调控等功能[22-23]。
研究发现,在90%的肝癌患者中发现FAT10高表达[24]。有研究在药物诱导小鼠肝癌模型中发现高表达FAT10可以促进癌前病变和肿瘤的形成[25-26],并且下调FAT10可以抑制马洛里小体的生成进而抑制肝癌形成。在中国汉族人群中,FAT10基因遗传变异与肝癌的易感性和不良预后密切相关[27]。在进一步研究中发现,FAT10与eEF1A1发生相互作用,通过调节eEF1A1的表达参与到肝癌的发生、发展过程中[28]。HBV病毒感染作为肝癌最常见的危险因素,肝癌合并慢性HBV感染的患者比例在总患者占50%以上[10-11],在Liu等[29]的研究中发现,FAT10高表达在肝癌合并慢性HBV感染的患者中提示预后不良,并且FAT10的表达与肝癌复发和侵袭转移呈正相关。综上所述,研究FAT10在肝癌中的作用有助于明确肝癌的发病机制,并为预测肝癌预后提供潜在的标志物。
2.4 ISG15蛋白与肝癌的关系
ISG15蛋白由两个泛素样结构域组成,ISG15结合底物过程主要涉及4种修饰酶,分别是E1激活酶Ube1L、E2缀合酶UBCH8、E3连接酶Herc5和解聚酶UBP43[30]。ISG15在肿瘤免疫、肿瘤微环境和肿瘤化疗敏感性中都发挥着重要作用[31-33]。
Kim等[34]发现,ISG15酶修饰系统可以调节HBV病毒的复制过程,进而影响慢性乙型肝炎患者向肝癌的发展。同时HCV病毒感染也是肝癌诱发因素之一[35]。Broering等[36]研究发现,ISG15可以作为HCV的前病毒因子,在HCV复制过程中起重要作用,抑制ISG15的功能可以为传统治疗无效的HCV病毒感染提供新的治疗途径。研究还发现ISG15的表达和HCV病毒感染有密切关系[37]。MicroRNA-130a可以抑制HCV病毒复制,其中可能是通过调节ISG15的表达发挥作用[38]。这些研究表明:ISG15蛋白在HBV及HCV病毒感染中的作用很有可能是病毒相关性肝癌的发生机制之一,这可能为病毒相关性肝癌的治疗提供一个新的靶点。
3 类泛素蛋白与肝癌治疗
由于早期肝癌临床症状相对不明显并且缺乏有效的诊断方法,很多患者诊断时就处于晚期,从而丧失了根治性手术治疗的最佳时机[39]。化疗作为恶性肿瘤治疗的一个主要手段,但在肝癌的治疗中并没有显著效果,这主要归因于肝癌对化疗敏感性差,且化疗药物治疗剂量较大、毒副作用明显。以上因素使得肝癌患者的治疗手段受到限制,直到今天都没有系统的治疗方案[40-42]。为了改善肝癌患者的治疗效果,提高肝癌化疗敏感性是一个关键性的问题[43]。索拉非尼作为近年来肝癌靶向治疗的突破,虽然一定程度延长了晚期肝癌患者的生存时间,但是它仍然有很多不足,因此肝癌迫切需要更多有效的治疗手段[39,41]。
Qin等[44]研究发现,SUMO化修饰水平升高与肝癌化疗敏感性差密切相关。Li等[45]的研究发现,E3连接酶多梳蛋白4可以通过改变SUMO化修饰水平,参与到肝癌细胞血管生成过程中。Qian等[46]研究发现,抑制SUMO特异性解聚酶6可以降低肝癌细胞中的SUMO化水平,从而增强肝癌细胞的放疗敏感性。这显示降低SUMO化水平可以抑制肝癌的生长,提高肝癌的治疗效果,为肝癌分子靶向治疗提供了新的靶标。
MLN4924作为一个NEDD8修饰系统的抑制剂在多种恶性肿瘤中已经开始了Ⅰ期临床药物试验,并且已经取得了显著的治疗效果[47-48]。MLN4924主要通过抑制NEDD8的E1激活酶NAE活性,降低NEDD8类泛素化修饰水平,进而通过调节靶蛋白降解和基因损伤修复等功能参与到抗肿瘤作用中[47-48]。MLN4924在肝癌中治疗尚未开展,但Luo等[49]的研究发现MLN4924可以促进肝癌细胞的自噬和凋亡发生,为MLN4924的肝癌临床治疗提供理论依据。
Liu等[29]研究发现,干扰FAT10表达可以提高5-氟尿嘧啶对肝癌细胞的杀伤作用,这说明FAT10蛋白异常高表达在肝癌化疗不敏感中起到了重要作用。干扰FAT10的表达可以作为提高肝癌化疗敏感性的特异靶点。
4 展望
类泛素蛋白在细胞的正常生命活动中充当着重要的角色,然而随着研究的不断深入,类泛素蛋白功能与肝癌的联系已渐渐进入了研究者们的视线。类泛素蛋白不仅可以促进慢性病毒性肝炎患者向肝癌的恶性转化,而且还直接或间接参与肝癌的增殖、凋亡等过程中,这些功能都可以直接影响到肝癌患者的诊治和预后;同时类泛素蛋白与肝癌放化疗敏感性的关系以及在血管新生过程中的作用又使类泛素蛋白可能成为肝癌治疗的新靶点。然而,类泛素蛋白在肝癌增殖、凋亡等过程中的具体机制尚不明确,更多类泛素蛋白在肝癌发生和发展中作用机制的研究可以使其成为一个肝癌防治新靶点提供更多的理论基础。
1 Chung KY,Cheng IK,Ching AK,et al.Block of proliferation 1(BOP1)plays an oncogenic role in hepatocellular carcinoma by promoting epithelial-to-mesenchymal transition[J].Hepatology,2011,54(1):307-318.
2 Marrero JA.Multidisciplinary management of hepatocellular carcinoma:where are we today?[J].Semin Liver Dis,2013,33(Suppl 1):S3-S10.
3 Da SS,Paiva SL,Lukkarila JL,et al.Exploring a new frontier in cancer treatment:targeting the ubiquitin and ubiquitin-like activating enzymes[J].J Med Chem,2013,56(6):2165-2177.
4 Herrmann J,Lerman LO,Lerman A.Ubiquitin and ubiquitin-like proteins in protein regulation[J].Circ Res,2007,100(9):1276-1291.
5 Zhao Y,Brickner JR,Majid MC,et al.Crosstalk between ubiquitin and other post-translational modifications on chromatin during double-strand break repair[J].Trends Cell Biol,2014,24(7):426-434.
6 van der Veen AG,Ploegh HL.Ubiquitin-like proteins[J].Annu Rev Biochem,2012,81:323-357.
7 Hochstrasser M.Origin and function of ubiquitin-like proteins[J].Nature,2009,458(7237):422-429.
8 Vertegaal AC.Uncovering ubiquitin and ubiquitin-like signaling networks[J].Chem Rev,2011,111(12):7923-7940.
9 Forner A,Llovet JM,Bruix J.Hepatocellular carcinoma[J].Lancet,2012,379(9822):1245-1255.
10 Yuen MF,Hou JL,Chutaputti A.Hepatocellular carcinoma in the Asia pacific region[J].J Gastroenterol Hepatol,2009,24(3):346-353.
11 Sherman M.Hepatocellular carcinoma:epidemiology,surveillance,and diagnosis[J].Semin Liver Dis,2010,30(1):3-16.
12 Wilkinson KA,Henley JM.Mechanisms,regulation and consequences of protein SUMOylation[J].Biochem J,2010,428(2):133-145.
13 Cubenas-Potts C,Matunis MJ.SUMO:a multifaceted modifier of chromatin structure and function[J].Dev Cell,2013,24(1):1-12.
14 Guo WH,Yuan LH,Xiao ZH,et al.Overexpression of SUMO-1 in hepatocellular carcinoma:a latent target for diagnosis and therapy of hepatoma[J].J Cancer Res Clin Oncol,2011,137(3):533-541.
15 Tomasi ML,Tomasi I,Ramani K,et al.S-adenosyl methionine regulates ubiquitin-conjugating enzyme 9 protein expression and sumoylation in murine liver and human cancers[J].Hepatology,2012,56(3):982-993.
16 Shen HJ,Zhu HY,Yang C,et al.SENP2 regulates hepatocellular carcinoma cell growth by modulating the stability of beta-catenin[J].Asian Pac J Cancer Prev,2012,13(8):3583-3587.
17 Watson IR,Irwin MS,Ohh M.NEDD8 pathways in cancer,Sine Quibus Non[J].Cancer Cell,2011,19(2):168-176.
18 Russell RC,Ohh M.NEDD8 acts as a'molecular switch'defining the functional selectivity of VHL[J].EMBO Rep,2008,9(5):486-491.
19 Xirodimas DP,Saville MK,Bourdon JC,et al.Mdm2-mediated NEDD8 conjugation of p53 inhibits its transcriptional activity[J].Cell,2004,118(1):83-97.
20 Embade N,Fernandez-Ramos D,Varela-Rey M,et al.Murine double minute 2 regulates Hu antigen R stability in human liver and colon cancer through NEDDylation[J].Hepatology,2012,55(4):1237-1248.
21 Wang H,Zeng F,Liu Q,et al.The structure of the ARE-binding domains of Hu antigen R(HuR)undergoes conformational changes during RNA binding[J].Acta Crystallogr D Biol Crystallogr,2013,69(Pt 3):373-380.
22 Schmidtke G,Aichem A,Groettrup M.FAT10ylation as a signal for proteasomal degradation[J].Biochim Biophys Acta,2014,1843(1):97-102.
23 Ren J,Wang Y,Gao Y,et al.FAT10 mediates the effect of TNF-alpha in inducing chromosomal instability[J].J Cell Sci,2011,124(Pt 21):3665-3675.
24 Lee CG,Ren J,Cheong IS,et al.Expression of the FAT10 gene is highly upregulated in hepatocellular carcinoma and other gastrointestinal and gynecological cancers[J].Oncogene,2003,22(17):2592-2603.
25 Bardag-Gorce F,Oliva J,Li J,et al.SAMe prevents the induction of the immunoproteasome and preserves the 26S proteasome in the DDC-induced MDB mouse model[J].Exp Mol Pathol,2010,88(3):353-362.
26 Oliva J,Bardag-Gorce F,French BA,et al.Fat10 is an epigenetic marker for liver preneoplasia in a drug-primed mouse model of tumorigenesis[J].Exp Mol Pathol,2008,84(2):102-112.
27 Yuan R,Jiang C,Hong K,et al.Genetic variation in the Fat10 gene is associated with risk of hepatocellular carcinoma in a Chinese population[J].Asian Pac J Cancer Prev,2011,12(8):2117-2122.
28 Yu X,Liu X,Liu T,et al.Identification of a novel binding protein of FAT10:eukaryotic translation elongation factor 1A1[J].Dig Dis Sci,2012,57(9):2347-2354.
29 Liu L,Dong Z,Liang J,et al.As an independent prognostic factor,FAT10 promotes hepatitis B virus-related hepatocellular carcinoma progression via Akt/GSK3beta pathway[J].Oncogene,2014,33(7):909-920.
30 Sgorbissa A,Brancolini C.IFNs,ISGylation and cancer:Cui prodest[J].Cytokine Growth Factor Rev,2012,23(6):307-314.
31 Andersen JB,Hassel BA.The interferon regulated ubiquitin-like protein,ISG15,in tumorigenesis:friend or foe[J].Cytokine Growth Factor Rev,2006,17(6):411-421.
32 Jeon YJ,Jo MG,Yoo HM,et al.Chemosensitivity is controlled by p63 modification with ubiquitin-like protein ISG15[J].J Clin Invest,2012,122(7):2622-2636.
33 Tessema M,Yingling CM,Thomas CL,et al.SULF2 methylation is prognostic for lung cancer survival and increases sensitivity to topoisomerase-I inhibitors via induction of ISG15[J].Oncogene,2012,31(37):4107-4116.
34 Kim JH,Luo JK,Zhang DE.The level of hepatitis B virus replication is not affected by protein ISG15 modification but is reduced by inhibition of UBP43(USP18)expression[J].J Immunol,2008,181(9):6467-6472.
35 Kanwal F,Kramer JR,Ilyas J,et al.HCV Genotype 3 is Associated with an Increased Risk of Cirrhosis and Hepatocellular Cancer in a National Sample of U.S.Veterans with HCV[J].Hepatology,2014,60(1):98-105.
36 Broering R,Zhang X,Kottilil S,et al.The interferon stimulated gene 15 functions as a proviral factor for the hepatitis C virus and as a regulator of the IFN response[J].Gut,2010,59(8):1111-1119.
37 Konishi H,Shirabe K,Yoshiya S,et al.Hepatic interferon-gamma-induced protein-10 expression is more strongly associated with liver fibrosis than interleukin-28B single nucleotide polymorphisms in hepatocellular carcinoma resected patients with chronic hepatitis C[J].Hepatol Res,2013,43(11):1139-1147.
38 Li S,Duan X,Li Y,et al.MicroRNA-130a inhibits HCV replication by restoring the innate immune response[J].J Viral Hepat,2014,21(2):121-128.
39 Finn RS.Emerging targeted strategies in advanced hepatocellular carcinoma[J].Semin Liver Dis,2013,33(Suppl 1):S11-S19.
40 Asghar U,Meyer T.Are there opportunities for chemotherapy in the treatment of hepatocellular cancer[J].J Hepatol,2012,56(3):686-695.
41 Di Marco V,De Vita F,Koskinas J,et al.Sorafenib:from literature to clinical practice[J].Ann Oncol,2013,24(Suppl 2):i30-i37.
42 Duffy A,Wilkerson J,Greten TF.Hemorrhagic events in hepatocellular carcinoma patients treated with antiangiogenic therapies[J].Hepatology,2013,57(3):1068-1077.
43 Huikai Li,Qiang Li.Mechanisms of Multidrug-resistance in hepatocellular carcinoma[J].Chin J Clin Oncol,2013,(16):1008-1010.[李慧锴,李 强.肝癌多药耐药机制研究进展[J].中国肿瘤临床,2013,(16):1008-1010.]
44 Qin Y,Bao H,Pan Y,et al.SUMOylation alterations are associated with multidrug resistance in hepatocellular carcinoma[J].Mol Med Rep,2014,9(3):877-881.
45 Li J,Xu Y,Long XD,et al.Cbx4 governs HIF-1alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity[J].Cancer Cell,2014,25(1):118-131.
46 Qian J,Luo Y,Gu X,et al.Inhibition of SENP6-induced radiosensitization of human hepatocellular carcinoma cells by blocking radiation-induced NF-kappaB activation[J].Cancer Biother Radiopharm,2013,28(3):196-200.
47 Blank JL,Liu XJ,Cosmopoulos K,et al.Novel DNA damage checkpoints mediating cell death induced by the NEDD8-activating enzyme inhibitor MLN4924[J].Cancer Res,2013,73(1):225-234.
48 Nawrocki ST,Griffin P,Kelly KR,et al.MLN4924:a novel first-in-class inhibitor of NEDD8-activating enzyme for cancer therapy[J].Expert Opin Investig Drugs,2012,21(10):1563-1573.
49 Luo Z,Yu G,Lee HW,et al.The Nedd8-activating enzyme inhibitor MLN4924 induces autophagy and apoptosis to suppress liver cancer cell growth[J].Cancer Res,2012,72(13):3360-3371.

