参芎注射液防治胸部肿瘤放疗导致放射性肺损伤的实验研究*
周晓红 唐 力 齐亚灵
放疗在肺癌、食管癌等胸部恶性肿瘤的治疗中占有重要的地位,在胸部肿瘤的放射治疗过程中正常肺组织不可避免的受到一定剂量的照射,放射性肺损伤成为影响胸部肿瘤放射治疗疗效的主要剂量限制性因素之一,也是影响胸部肿瘤放疗患者生存质量的重要原因,因此放射性肺损伤的防治尤显重要。活血化瘀中药对放射性肺损伤的预防作用目前得到一定的证实[1-2]。参芎葡萄糖注射液为丹参和川芎嗪组方,其中丹参具有抗血小板聚集、改善肺内微循环和增加肺血流量的作用;川芎嗪具有改善微循环、抑制炎症介质释放,本实验观察了中药参芎葡萄糖注射液对放射性肺损伤的影响,并对大鼠血浆中
TNF-α及TGF-β的含量进行检测,目的在于探究参芎葡萄糖注射液是否能够防治放射性肺损伤并初步探讨其可能的分子机制。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备及试剂 全自动多功能酶标仪(美国伯腾仪器有限公司),GRP-9270型隔水式恒温培养箱,ELEKTA直线加速器,TNF-α及TGF-β1 ELISA试剂盒(上海亚培生物科技有限公司)。参芎葡萄糖注射液(吉林四长制药有限公司)。
1.1.2 动物 SPF级成年雌性SD大鼠105只大鼠,体重(200±14)g(长春市亿斯实验动物技术有限责任公司)饲养期间动物清洁饮食,不限量。
1.2 方法
1.2.1 动物分组及给药方法 大鼠常规饲养1 W后分为7组:N组:生理盐水1 mL/只/d;D组:参芎葡萄糖注射液1 mL/只/d;Z组:全胸单次照射20 Gy+生理盐水1 mL/只/d;Z10组:全胸单次照射10 Gy+参芎葡萄糖注射液1 mL/只/d;Z15组:全胸单次照射15 Gy+参芎葡萄糖注射液1 mL/只/d;Z20a组:全胸单次照射20 Gy,4 W后大鼠腹腔注射参芎葡萄糖注射液1 mL/只/d;Z20b组:全胸单次照射20 Gy+参芎葡萄糖注射液1 mL/只/d。所有药物均经大鼠腹腔注射。于佳木斯市肿瘤医院放疗科加速器室进行实验大鼠的肺组织照射,照射前加速器室用紫外线照射消毒。待照射大鼠应用10%水合氯醛0.3 mL/100g腹腔内注射麻醉后,将大鼠仰卧于照射台上。照射野范围:照射野上界为大鼠前肢两腋窝中点连线,照射野下界为剑突水平,照射面积为4 cm×4 cm,SSD:100。用6MV-X线全胸单次照射20 Gy 45只,15 Gy 15只,10 Gy 15只,剂量率300c Gy/min。照射完毕大鼠送回实验室常规饲养。
1.2.2 取材及指标检测 1)取材:各组大鼠分别于照射后2、4、6、8、10 W,5个时间点取材(3只/组),应用10%水合氯醛0.3 mL/100g腹腔注射麻醉,剪开胸腔,刺破心脏取血1 mL,采血管收集血液,自然凝固30 min,1 000×g,离心15 min,收集上清,-20℃冰箱冻存。取大鼠双侧肺组织,10%福尔马林液固定。2)检测指标:①一般指标:照射后大鼠的进食变化,体重变化,脱毛情况。②肺组织行HE染色,观察病理变化。③ELISA法检测血清中TNF-α和TGF-β1的数值。
1.3 统计学方法
2 结果
2.1 进食及体重变化
照射后大鼠很快出现厌食,体重增长缓慢,至照射后4 W平均体重:照射大鼠为(235±8.5)g,未受照射大鼠平均体重为(287±12.5)g,两组比较,P<0.05。于照射10 d部分大鼠出现照射区脱毛(40/105),见图1。在单纯照射组死亡2只大鼠,死亡时间为照射后4~6W。而其他各组均无死亡大鼠。
2.2 大体及病理变化
由图2、3可见,照射组大鼠从第2 W出现肺组织体积变大,充血水肿。第4 W,部分大鼠肺组织表面出现点状出血点,D组3只均出现点状出血,Z20a组2/3出现,Z20b组2/3出现,Z15组2/3出现,Z10组未出现。照射后8 W,单纯照射组肺组织体积略缩小,肺表面有白色缺血区域,给药组大体较单纯照射组缺血区域减小。照射8~10 W部分大鼠出现胸腔积液,具体结果见表1。HE染色结果(图4、5):2W后,单纯照射组肺组织见急性炎症改变,肺组织充血,肺泡内见少量红细胞,间质见淋巴细胞浸润。照射后4 W,单纯照射组肺泡内红细胞增多,肺泡间隔增厚,可见淋巴细胞及纤维细胞。照射后8W,肺泡间隔增厚明显,大量纤维细胞出现,肺泡腔减少。
2.3 放射性肺损伤结果见表1。
2.4 ELISA检测结果
Z组:TGF-β1,TNF-α血清数值于照射第4W开始增高,并于第6W达到最高值,治疗组Z10,Z15,Z20b也于第4W开始升高,但低于单独照射组(P<0.01),8~10W TGF-β1,TNF-α血清数值以上各治疗组低于单独照射组(P<0.01)。Z20a与Z组数值差异无统计学意义(P>0.05),具体结果见表2。

图1 照射后不同时间点大鼠脱毛情况Figure 1 Rat hair removal at different time points after irradiation

图2 照射2W肺大体标本Figure 2 Gross lung specimen at 2W after irradiation
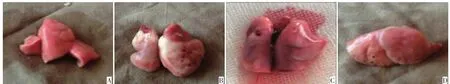
图3 照射4W肺大体标本Figure 3 Gross lung specimen at 4Wafter irradiation

图4 照射4W肺组织病理变化(H&E×400)Figure 4 The pathological changes of lung tissue at 4W after irradiation(H&E×400)
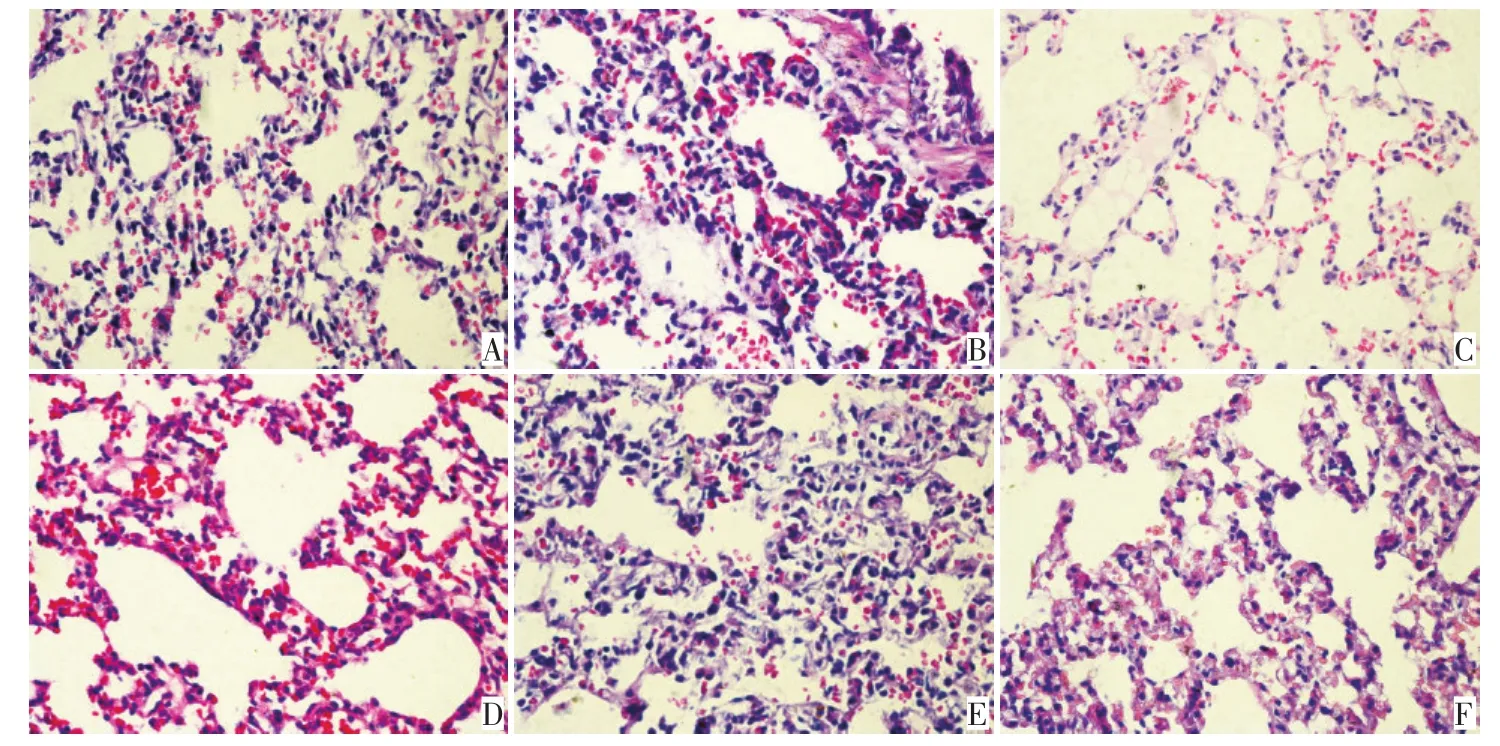
图5 照射10W肺组织病理变化(H&E×400)Figure 5 The pathological changes of lung tissue at 10W after irradiation(H&E×400)

表1 放射后胸腔积液发生率Table 1 Incidence of pleural effusion after radiation

表2 各组TGF-β值,TNF-α值的情况(pg/mL)Table 2 TGF-β and TNF-α levels of each group(pg/mL)
3 讨论
放射治疗是胸部肿瘤的三大主要治疗手段之一,通常疗程为6~7W。胸部放射治疗的主要并发症为急性放射性肺炎及放射性肺纤维化,常发生在放射治疗结束后3~6个月[3]。放射性肺损伤的发生具有多源性,是一个由多因素共同存在,互相影响,综合调控的复杂过程,就其发病机制产生了多种学说理论,主要有肺泡Ⅱ型细胞损伤学说、自由基损伤学说、细胞因子介导学说等。许多细胞因子均被认为与放射性肺损伤密切相关[4],主要可以分成两类,一类是参与局部损伤和炎症反应的因子,以TNF-α最为重要[5]。另一类是参与组织修复和器官纤维化的因子,以转化生长因子β1(TGF-β1)最为重要。TGF-β1是一种多功能细胞因子,被公认为纤维化形成与发展的启动枢纽,是关键性细胞因子。细胞间粘附分子ICAM-1等也参与调控的复杂过程[6-8]。因此可以通过检测细胞因子的表达来预测和早期发现放射性肺损伤的发生[8-9]。
目前针对放射性肺损伤采用的治疗原则是防大于治、防治结合。对于肺部有慢性基础疾病患者,一方面在放疗中根据个体特点制定合理规范的放射治疗计划,根据剂量体积直方图(DVH)等相关参数调整照射野角度和个数、照射体积和剂量,尽量避免或减少不利因素[10],美国放射肿瘤学协作组在一个前瞻性的研究中发现,V20的大小不仅与放射性肺炎的发生率相关,而且与放射性肺炎的严重程度明显相关[11]。患者在照射到一定剂量后应及时调整治疗靶区,调整剂量,充分考虑自身免疫性疾病、吸烟、糖尿病以及全身状况等因素在放射性肺纤维化中的作用等,目前发生急性放射性肺炎后主要应用肾上腺皮质激素,辅以抗感染、吸氧、止咳、平喘等对症治疗。该方法虽然可以暂缓症状,但对肺纤维化疗效不佳且副作用较大,不宜行预防给药或长期使用,其他药物如秋水仙碱、阿米福汀及细胞因子抑制剂等的治疗均有报道[12-13];另一方面在放射治疗前和放射治疗过程中采用清热解毒,养阴清肺,活血化瘀等方法预防或减轻放射性肺损伤[14]。中药治疗也有报道,如有研究显示在给肺纤维化模型大鼠腹腔注射当归提取液后,病理切片显示当归治疗后肺泡炎及肺间质纤维化明显减轻[15],其机理尚未完全明确。参芎葡萄糖注射液为丹参和川芎嗪组方,其中丹参具有抗血小板聚集、改善肺内微循环和增加肺血流量的作用;川芎嗪具有改善微循环、抑制炎症介质释放,抑制纤维母细胞亢进的胶原合成作用。因此本实验在放疗开始时同时大鼠腹腔注射参芎葡萄糖注射液,实验结果显示,未用药组照射后大鼠很快出现厌食,体重增长缓慢,脱毛等。照射组大鼠从第2W出现肺组织体积变大,充血水肿。第4W,部分大鼠肺组织表面出现点状出血点,D组均出现点状出血,Z20a组2/3出现,Z20b2/3出现,Z15组2/3出现,Z10组0/3出现。照射后8W,单纯照射组肺组织体积略缩小,肺表面有白色缺血区域,给药组大体较单纯照射组缺血区域减小。照射8~10W间有部分大鼠出现胸腔积液。HE结果显示,2W后,单纯照射组肺组织见急性炎症改变,肺组织充血,肺泡内见少量红细胞,间质见淋巴细胞浸润。照射后4W,单纯照射组肺泡内红细胞增多,肺泡间隔增厚,见淋巴细胞及纤维细胞。照射后8W,肺泡间隔增厚明显,大量纤维细胞出现,肺泡腔减少。ELISA结果显示,单独照射组血清中TNF-α和TGF-β1因子的含量明显高于各给药组。实验结果提示,参芎葡萄糖注射液能预防放射性肺损伤的发生,减轻肺炎的急性渗出,充血水肿等病理改变,机理与该药物能降低血浆TNF-α和TGF-β1值有关;发生放射性肺炎后给药能减缓症状,但不能逆转已经形成的肺炎病理变化。
1 Ding HJ,Dou YQ.Progress of traditional Chinese medicine in the treatment and research of radiation pneumonia[J].Chinese Journal of information on traditional Chinese medicine,2010,17(2):99-100.[丁慧娟,窦永起.放射性肺炎中医药防治研究进展[J].中国中医药信息杂志,2010,17(2):99-100.]
2 Cai HB,Luo RC.Prevent ion an d therapy of radiation-induced pulmonary injury with raditional Chinese medicine[J].Di Yi Jun Yi Da Xue Xue Bao,2003,23(9):B958-B960.
3 Lv JJ,Li QY,Zuo FX.Clinical observation of effect of Ligustrazine on preventing and treating radiation-induced lung injury[J].Basic and clinical tumor,2010,23(5):401-402.[吕晶晶,李庆云,左凤霞.川芎嗪对放射性肺损伤防治作用的临床观察[J].肿瘤基础与临床,2010,23(5):401-402.]
4 Gu XZ.Radiation therapy of tumor[M].Fourth Edition,Beijing:Beijing Medical University and Chinese Peking Union Medical College Joint Press,2008:518-519.[谷铣之,主编.肿瘤放射治疗学[M].第4版.北京:北京医科大学中国协和医科大学联合出版社,2008:518-519.]
5 Rube CE,Uthe D,Schmid KW,et al.Dose dependent induction of transforming growth factor β(TGF-β)in the lung tissue of fibmsisprone mice after thoracic irradiation[J].Int J Radiat Oncol Biol Phys,2000,47(4):1033-1042.
6 Graves PR,Siddiqui F,Anscher MS,et al.Radiation pulmonary toxicity:from mechanisms to management[J].Semin Radiat Oncol,2010,20(3):201-207.
7 Ghafoori P,Marks LB,Vujaskovic Z,et al.Radiation-induced lung injury assessment,management,and prevention[J].Oncology,2008,22(1):37-47.
8 Brass DM,Hoyle GW,Poovey HG,et al.Reduced tumor necrosis Factor-alpha and transforming growth factor-beta 1 expression in the lungs of inbred mice that fail to develop fibroproliferative lesions consequent to asbestos exposure[J].Am J Pathol,1999,154(3):853-862.
9 Rubin P,Johnston CJ,Williams JP,et al.A perpetual cascade of cytokines post-irradiation leads to pulmonary fibrosis[J].Int J Rad Oncol Biol Phys,1995,33(1):99-109.
10 Barriger RB,Forquer JA,Brabham JG,et al.A Dose-volume analvsis of radiation pneumonitis in Non-small Cell Lung Cancer patients treated with stereotactic body radiation therapy[J].Int J Radiat Oncol Biol Phys,2012,82(1):457-462.
11 Tsujino K,Hirota S,Endo M.et al.Predictive value of pneumonitis after concurrent chemoradiation for lung cancer[J].Int J Radiat Oncol Biol Phys,2003,55(1):110-115.
12 Feng QF,Vujaskovie Z,Brizel DM,et al.Experimental study on the protective effect of amifostine on radiation-induced lung injury[J].Chinese Journal of Radiation Oncology,2001,10:250-254.[冯勤付,Vujaskovie Z,Brizel DM,等.阿米福汀对放射性肺损伤保护作用的实验研究[J].中华放射肿瘤学杂志,2001,10:250-254.]
13 Li YQ,Zhou X,Zhang T,et al.Influence of Amie amifostine on adverse reaction of lung cancer radiotherapy[J].Modern Medical Oncology,2010,18(4):708-710.[李永强,周 翔,张 霆.阿米福汀对肺癌放疗中不良反应的影响[J].现代肿瘤医学,2010,18(4):708-710.]
14 Yamashita H,Kobayashi-Shibata S,Terahara A,et al.Prescreening based on the presence of CT-scan abnormalities and biomarkers(KL-6 and SP-D)may reduce severe radiation pneumonitis after stereotactic radiotherapy[J].Radiat Oncol,2010,5:32.
15 Wang XB,Experimental study on the effect of Angelica on radiation injury in rats[J].Traffic medicine,2011,25(1):24-27.[王小博,当归治疗大鼠放射性肺损伤的实验研究[J].交通医学,2011,25(1):24-27.]

