活化血管内皮细胞检测与非小细胞肺癌抗血管生成治疗疗效的相关性研究*
魏熙胤 王 晶 臧凤琳 张 飞 刘竹君 张翠翠 李 凯
抗血管生成联合化疗可明显延长非小细胞肺癌(non small cell lung cancer,NSCLC)的无进展生存期和总生存期而广泛用于临床。但此类药物的特点在于抑制肿瘤生长,而非迅速缩小瘤体,在以肿瘤体积变化为基础的评价体系中,其效果常被低估。因而,寻找有效的评估标志物已成为重要研究方向。抗血管生成药物的主要靶点为血管内皮细胞(circulating endothelial cells,CECs)。Beaudry等[1]证实荷瘤动物CECs变化与血管内皮抑素的抑瘤效果显著相关。CECs的主要来源包括骨髓中的血管内皮前体细胞和周围血管壁上的活化内皮细胞(activated CECs,aCECs)。其变化反应抗血管与促血管生成因子相互拮抗的最终结果,可能成为评估抗血管生成的有效标志物[2]。本研究应用流式细胞术检测NSCLC中aCECs数量,分析aCECs与抗血管生成疗效的关系,以期寻找反映抗血管生成疗效的标志物。
1 材料与方法
1.1 一般资料
入组标准:经组织学或细胞学确诊、局部晚期或转移性NSCLC患者、未行化疗或仅接受一线治疗。其他条件包括:病灶单径≥1 cm;身体状况评分标准(ECOG)≤2分;预计生存期≥3个月;无生物制剂等药物过敏史;患者自愿参加并签署知情同意。排除标准:未控制的急性感染或脑转移;严重心脏病史;明显出血倾向;既往应用恩度治疗等。选取2009年3月至2011年12月本院收治的142例NSCLC患者,均经病理组织学或细胞学检查确诊,其中男性88例,女性54例,年龄25~75岁。腺癌77例,鳞状细胞癌49例,其他类型16例。TNM临床分期:ⅢB期53例,Ⅳ期89例。另选取30例健康志愿者作为健康对照组,仅采外周血行CECs检查而不行治疗。此项研究经天津医科大学伦理委员会批准。
1.2.1 治疗方法 化疗组71例:长春瑞滨联合顺铂(NP方案):长春瑞滨25 mg/m2,第1、8天;顺铂25 mg/m2,第2~4天。联合组71例:NP方案联合重组人血管内皮抑制素(恩度):恩度7.5 mg/m2、第1~14天连续给药,伴随上述NP方案。所有药物的给药方式均为静脉滴注,21~28天为1个周期,共6个周期,至有明确进展或出现不能耐受毒副作用时出组。
1.2.2 疗效评定 依实体瘤疗效评价标准判定治疗效果,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progression disease,PD)[3]。患者于化疗前、化疗期间每2个周期检测强化CT、MRI或PET-CT,对SD及以上疗效4周后确认,必要时随时检查。肿瘤进展时间(time to progression,TTP)为从随机开始至疾病进展的时间。疗效经由独立的疗效评估委员会再评估。
1.2.3 流式细胞术检测aCECs 治疗前3天内及每个周期治疗后3天内取1 mL静脉血,流式细胞术检测研究对象血清aCECs水平和基线范围:1)各取抗凝全血0.1 mL,分别加入实验管和同型对照管。实验管中加入FITC标记小鼠抗人CD105 10 μL、PE标记小鼠抗人CD146 10 μL、PE-Cy5标记小鼠抗人CD45 10 μL,对照管中分别加入FITC标记小鼠IgG1 10 μL、PE标记小鼠IgG1 10 μL、PE-Cy5标记小鼠IgG2a 10 μL,避光孵育30~45 min。所有试剂均购自美国贝克曼库尔特公司。2)向上述管中各加入红细胞裂解液Opti-Lyse C 0.5 mL,孵育15 min,加PBS常规清洗,离心后弃上清,加入0.5 mL鞘液,振荡混匀待测。3)以标准荧光微球常规校准仪器的变异系数并稳定在2以内,运用逻辑设门方法(图1)确定目标细胞,收集10万个细胞,根据细胞发出的荧光测定表达率并计算CD45-CD105+CD146+细胞数[4-5]。4)计算aCECs的变化差值:差值=治疗后值-治疗前值。
1.2 方法

图1 逻辑设门:在左图中采集10万个外周血细胞为研究背景;中图纵坐标为CD45,横坐标为CD146,其中左上相限和右上相限为CD45阳性细胞即白细胞予以排除,右下相限为CD146单阳性细胞;右图纵坐标为CD146,横坐标为CD105;右图右上相限为CD146、CD105双阳性细胞即活化血管内皮细胞(CD45-CD146+CD105+)Figure 1 Gating logic:The left illustration shows the gate used to exclude the platelets,dead cells,and debris.We collected 100,000 peripheral blood cells for study.In the middle illustration,the ordinate was CD45,and the abscissa was CD146.The upper left quadrant and upper right quadrant exhibit leukocytes,which were excluded,and the lower right quadrant illustrates CD146+cells.The ordinate of the right illustration was CD146,and the abscissa was CD105.The upper right quadrant shows CD45+CD146+CD105+cells,namely,aCECs
1.3 统计学分析
采用SPSS 18.0统计软件进行数据处理,对计量指标计算均值、标准差、中位数、最小值、最大值,对分类指标计算各类别的例数及百分数。因aCECs为非正态分布,故取自然对数ln使之正态化后再进行计算。Cox回归分析模型分析疾病进展风险比(hazards ratio,HR)、评价各因素对TTP、OS的影响。在Cox回归中将aCECs差值按≤0分、0~10分、11~100分、>100分为4个亚层,分别定义为aCECs1、aCECs2、aCECs3、aCECs4。双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 疗效
2.1.1 短期疗效 2个周期后联合组CR 0例,PR 10例,SD 48例,ORR、CBR分别为14.1%和81.7%;化疗组CR 0例,PR 2例,SD 51例,ORR、CBR分别为2.8%和74.6%;两组间差异无统计学意义(P>0.05)。
2.1.2 远期疗效 随访至2012年12月,联合组与化疗组中位TTP分别为7.3个月和5.3个月(P=0.038)。
2.2 aCECs治疗中的变化及意义
2.2.1 基线情况 健康对照组基线范围为(45,12~215)/105细胞,ln aCECs(1.7±0.3);化疗组基线范围为(67,25~335)/105细胞,ln aCECs(4.4±1.7);联合组基线范围为(75,35~390)/105细胞,ln aCECs(4.7±1.5)。对照组性别、年龄与临床试验患者间比较差异无统计学意义,aCECs数量明显低于治疗组(P=0.006)。两试验组间aCECs比较差异无统计学意义(P>0.05),且与性别、年龄、病理类型及临床分期均不相关(P>0.05)。
2.2.2 治疗中的变化 1)化疗组aCECs变化:治疗后第1、2、3、4个周期aCECs分别为(105,65~404)/105细胞,ln aCECs(4.5±1.8);(175,125~470)/105细胞,ln aCECs(5.0 ±1.5);(254,205~714)/105细 胞 ,ln aCECs(5.2± 1.9)和(110,150~480)/105细 胞 ,ln aCECs(4.8±1.9)。其中第3个周期数值与基线相比,明显升高(P=0.040)。2)联合组aCECs变化:除常规化验外,联合组患者于第 8、29、50、71天加验aCECs。结果显示:治疗前、第8天、第1个周期后、第29天、第2个周期后、第50天、第3个周期后、第71天、第4个周期后aCECs分别为(77,42~314)/105细胞,ln aCECs(4.3±1.1);(178,50~425)/105细胞,ln aCECs(5.2±1.7);(46,9~522)/105细胞,ln aCECs(4.6±1.2);(181,78~727)/105细胞,ln aCECs(5.2±1.5);(126,62~256)/105细胞,ln aCECs(5.0±1.3);(322,106~467)/105细胞,ln aCECs(5.5±0.9);(100,44~131.3)/105细胞,ln aCECs(4.6±1.3);(465,117~851)/105细胞,ln aCECs(5.9±1.2)和(180,68~744)/105细胞,ln aCECs(5.3±1.3)。其中,第8天、第29天、第2个周期后、第50天、第71天、第4个周期后aCEC均较基线明显升高(P<0.05),而其余联合组各取血点aCECs变化较基线差异均无统计学意义(P>0.05)。
2.2.3 aCECs数量与疗效的相关性 化疗组PD患者与非PD患者aCECs基线分别为(75,40~352)/105细胞,ln aCECs(4.2±1.6)和(55,25~290)/105细胞,ln aCECs(4.3±1.4)。联合组PD患者与非PD患者aCECs分别为(59,25~110)/105细胞,ln aCECs(3.8±1.7)和(65,24~285)/105细胞,ln aCECs(4.3±1.8)。不同治疗组内PD与非PD患者的aCECs数量比较差异均无统计学意义。通过比较治疗前、后aCECs变化发现,PD患者与非PD患者在化疗或联合治疗后,aCECs均较治疗前有所升高,但仅PD患者aCECs数量变化差异有统计学意义(化疗组,P=0.041;联合组,P=0.020)。
化疗联合恩度治疗患者非PD与PD组aCECs数值分别为(65,40~190)/105细胞,ln aCECs(4.2±1.3)和(75,50~214)/105细胞,ln aCECs(3.8±1.5),两者差异亦无统计学意义(P>0.05)。但在不同治疗方式中,PD患者于治疗后aCECs升高差异均有统计学意义(P<0.05)。
2.2.4 两组不同疗效患者aCECs波动情况 1)化疗组中PD病例平均治疗2个周期,治疗前aCECs为(75,40~352)/105细胞,ln aCECs(4.2±1.6);2个周期后为(170,150~570)/105细胞,ln aCECs(5.3±1.7),较基线明显升高(P=0.041)。非PD病例平均治疗3个周期,治疗前 aCECs为(55,25~290)/105细胞,ln aCECs(4.3±1.4);第3个周期后为(45,10~300)/105细胞,ln aCECs(4.6±1.5),aCECs升高与基线相比差异有统计学意义(P=0.033)。2)联合组中PD病例平均治疗2个周期,治疗前及1、2个周期后aCECs值分别为(59,25~100)/105细胞,ln aCECs(3.8±1.7);(155,55~300)/105细胞,ln aCECs(4.6±1.6);(240,70~680)/105细胞,ln aCECs(5.2±1.8),治疗后较基线升高差异均有统计学意义(P<0.05)。非PD病例平均治疗3个周期,治疗前、后aCECs变化差异无统计学意义(P>0.05)。
2.2.5 aCECs与TTP的相关性 相关性研究显示,在联合组中治疗后aCECs的变化差值与TTP间呈负相关(r=-0.351,P=0.039),而化疗组两者间无任何相关性(r=-0.205,P=0.372,图2)。Cox回归结果显示aCECs的差值是反映联合组TTP的重要因素(表1)。
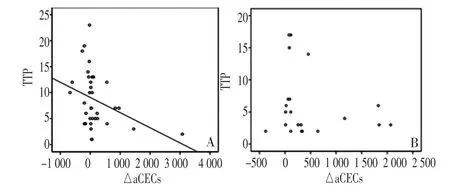
图2 aCECs差值与TTP的相关性Figure 2 Correlation between△aCECs and TTP
3 讨论
晚期NSCLC患者的治疗以化疗为主,但双药含铂方案平均生存时间仅为7~9个月,而且肿瘤复发仍难以避免[6]。抗血管生成药物与化疗联合首次将其平均生存期延长至1年以上[7]。其中,血管内皮抑素作用效果最为确切,多个临床试验已证明其对双药联合化疗有明显的增效作用[8]。但此类药物的靶点是肿瘤血管,在短时间内多无法迅速缩小肿瘤体积,单靠测量肿瘤大小往往会低估药物的疗效,临床急需寻找有效的早期标志物,以尽早评价肿瘤对抗血管治疗的反应。本研究组对此问题进行了研究,并初步推测aCECs在抗血管生成疗效的评判中具有重要价值。

表1 aCECs差值与NSCLC患者TTP间的相关性Table 1 Correlation between△aCECs and TTP
3.1 aCECs的流式检测标记
CECs是外周血中可检测到的血管内皮细胞总称,在正常人血中含量极少,但在炎症、免疫应答、肿瘤等疾病状态下数量明显增加。CECs起源于现有血管壁的成熟内皮细胞和骨髓的内皮祖细胞,以及由肿瘤细胞转化成的有功能的内皮细胞。成熟的CECs经促血管生成因子激活后,进入血液循环并转变为活化血管内皮细胞(activated CECs,aCECs),迁移至肿瘤处参与形成新生血管。aCECs升高可直接反应促血管与抗血管生成因子的对抗平衡,监测其水平可能有助于预测抗血管生成疗效[9-10]。本研究组曾应用流式细胞术检测外周血中的aCECs,将CD45-CD146+CD105+作为其界定标志[4-5,9]。本研究表明,与健康对照者比较,以CD45-CD146+CD105+界定的aCECs在肺癌患者中明显升高,初步验证了本研究前期基础实验所确定的aCECs标记的可靠性。
3.2 aCECs在治疗中的动态变化
aCECs的动态变化一直存在争议。Beuadry等[1]研究VEGFR抑制剂ZD6474时发现,ZD6474可以使CECs升高,同时微血管密度下降、瘤体减小。Li等[11]发现经沙利度胺联合多西紫杉醇治疗后,前列腺癌中凋亡CECs和aCECs均表现升高趋势。Kawaishi等[12]观察到经紫杉醇联合卡铂治疗后肺癌患者第8天及第22天aCECs较治疗前下降。本研究组观察到化疗联合恩度治疗非小细胞肺癌有效病例中aCECs的数目显著下降[9]。故在有效的抗血管生成联合化疗过程中,aCECs应呈现“先升后降”的数量变化趋势。首先,恩度抑制基质金属蛋白酶(matrix metalloproteinases,MMPs),使肿瘤血管基底膜降解减少、血管通透性下降,降低局部组织间质液压,使膨胀的血管收缩,血管内壁上的内皮细胞被“挤脱”下来于血循环中,致使aCECs数目升高。随后,细胞毒药物诱导aCECs凋亡,而随着肿瘤体积缩小,肿瘤血管生长因子(TAFs)及aCECs越来越少。因此aCECs开始的升高反映了肿瘤血管床面积的缩小,最终的下降则提示CECs凋亡和肿瘤新生血管能力的削弱。本研究化疗组和联合组治疗中aCECs均有升降,说明CECs在治疗中始终处于动态升、降状态,正是“血管正常化”导致其上升和诱导凋亡导致其下降动态的平衡表现[13]。有研究提出,“血管正常化”作用仅出现于抗血管生成治疗后的1~2周,是一过性的,后面即转入抑制肿瘤血管而导致其退缩和“血管缺乏化”[14-15]。本研究认为,由于治疗中的多次、周期性用药,两种作用应是交替共存的,治疗有效者的aCECs也表现为下降中的反复波动。而随着治疗延长,肿瘤细胞生物活性不断降低、TAFs减少,瘤内血管床面积和CE-Cs也会最终明显降低并稳定。
3.3 aCECs与疗效的关系
本研究中化疗组及联合组PD患者治疗后aCECs数量均较治疗前升高(P=0.041,P=0.020),其差值的变化方向(上升或下降)与幅度可以反映疗效的优劣。有效治疗使肿瘤缩小、内皮细胞凋亡,aCECs必然最终下降。反之,若治疗无效,新血管不断生长,aCECs也会不断升高。对其一过性的升高或降低需结合临床及CT检查结果评价,适时调整治疗方案。相关性研究显示联合组aCECs治疗前、后的变化差值与TTP间呈明显负相关(r=-0.351,P=0.039),提示经过长时间的有效治疗后,aCECs最终将会下降并保持在较低水平。
综上所述,在晚期NSCLC患者的外周血中可以检测到aCECs,在肿瘤进展时其呈持续上升,而治疗有效时则呈波动下降趋势,对此部分病患者继续治疗可获得长期肿瘤稳定。短时间内的“血管正常化”可引起CECs的一过性升高。aCECs有望用于判定NSCLC抗血管生成联合化疗效果。
1 Beaudry P,Force J,Naumov GN,et al.Differential effects of vascular endothelial growth factor receptor-2 inhibitor ZD6474 on circulating endothelial progenitors and mature circulating endothelial cells:implications for use as a surrogate marker of antiangiogenic activity[J].Clin Cancer Res,2005,11(9):3514-3522.
2 Mancuso P,Bertolini F.Circulating endothelial cells as biomarkers in clinical oncology[J].Microvasc Res,2010,79(3):224-228.
3 Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
4 Mancuso P,Burlini A,Pruneri G,et al.Resting and activated endothelial cells are increased in the peripheral blood of cancer patients[J].Blood,2001,97(11):3658-3661.
5 Ali AM,Ueno T,Tanaka S,et al.Determining circulating endothelial cells using Cell Search system during preoperative systemic chemotherapy in breast cancer patients[J].Eur J Cancer,2011,47(15):2265-2272.
6 Schiller JH,Harrington D,Belani CP,et al.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N Engl J Med,2002,346(2):92-98.
7 Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2542-2550.
8 Han B,Xiu Q,Wang H,et al.A multicenter,randomized,double-blind,placebo-controlled study to evaluate the efficacy of paclitaxel-carboplatin alone or with endostar for advanced non-small cell lung cancer[J].J Thorac Oncol,2011,6(6):1104-1109.
9 Wang J,Xiao J,Wei X,et al.Circulating endothelial cells and tumor blood volume as predictors in lung cancer[J].Cancer Sci,2013,104(4):445-452.
10 Li B,Bao WA,Hu FJ,et al.A Phase-Ⅱclinical study on endostar in combination with chemotherapy for metastatic nasopharyngeal carcinoma[J].Chin J Clin Oncol,2012,39(24):2022-2025.[李 斌,包婺安,胡福军,等.恩度联合化疗治疗转移性鼻咽癌的Ⅱ期临床研究[J].中国肿瘤临床,2012,39(24):2022-2025.]
11 Li H,Raia V,Bertolini F,et al.Circulating endothelial cells as a therapeutic marker for thalidomide in combined therapy with chemotherapy drugs in a human prostate cancer model[J].BJU Int,2008,101(7):884-888.
12 Kawaishi M,Fujiwara Y,Fukui T,et al.Circulating endothelial cells in non-small cell lung cancer patients treated with carboplatin and paclitaxel[J].J Thorac Oncol,2009,4(2):208-213.
13 Tong RT,Boucher Y,Kozin SV,et al.Vascular normalization by vascular endothelial growth factor receptor 2 blockade induces a pressure gradient across the vasculature and improves drug penetration in tumors[J].Cancer Res,2004,64(11):3731-3736.
14 Li N,Zheng D,Wei X,et al.Effects of recombinant human endostatin and its synergy with cisplatin on circulating endothelial cells and tumorvascular normalization in A549 xenograft murine model[J].J Cancer Res Clin Oncol,2012,138(7):1131-1144.
15 Winkler F,Kozin SV,Tong RT,et al.Kinetics of vascular normalization by VEGFR2 blockade governs brain tumor response to radiation:role of oxygenation,angiopoietin-1,and matrix metalloproteinases[J].Cancer Cell,2004,6(6):553-563.

