信号素4D影响直肠癌裸鼠移植瘤的血管新生*
丁晓洁 李 多 黄新伟 付娟娟 潘 玥 陈俊英孙强明
结直肠癌是消化系统常见的恶性肿瘤,西方国家发病率较高,死亡率可达33%,在发达国家位居癌症死亡率第二位[1-2]。在东南亚也是位居第四的常见恶性肿瘤[3]。随着人口老龄化、生活水平和饮食结构的变化,结直肠癌发病率呈现上升趋势[4]。
实体瘤的生长和转移依赖血管新生,以保证向快速分裂的恶性细胞运输氧气、养分并清除代谢废物。因此,通过抑制新血管生成,切断肿瘤血供,抑制肿瘤生长、发展及转移,代表了近年来治疗肿瘤的新策略[5]。血管内皮生长因子(VEGF)及其受体(VEGFR)因其在肿瘤血管生成中的重要作用,已成为抗肿瘤生物治疗的一个重要靶点。然而,anti-VEGF治疗的效果在直肠癌患者中表现出较大的个体差异性,并且肿瘤细胞对anti-VEGF治疗已逐渐产生抗性[6-7],目前对于肿瘤抗anti-VEGF治疗的机制研究尚不够深入。
肿瘤介导血管生成的信号传导是一个复杂的、多因素网络系统,当一条信号通路被抑制后,肿瘤可能启动一条或多条血管新生补救途径。信号素(Semaphorins)和其受体神经丛素(Plexins)作为神经系统中轴突导向分子而被发现。在个体发育过程中,血管新生和神经系统的生长非常相似。有研究证明,信号素4D(Sema4D)通过其受体神经丛素-B1(Plexin-B1)能诱导血管生成[8]。Sema4D 是一个150kD的跨膜糖蛋白,在某些类型的肿瘤中高表达[9]。其受体Plexin-B1表达于血管内皮细胞表面[8]。推测在一些肿瘤中,Sema4D和VEGF在诱导血管新生应答方面有非常相似的作用,干扰Sema4D信号通路将可能通过抑制血管新生来减缓肿瘤生长。
1 材料与方法
1.1 材料
慢病毒包装细胞293T,直肠癌细胞株HCT-116,人脐静脉内皮细胞HUVEC,由中国医学科学院医学生物学研究所保存;DMEM培养基、胎牛血清购自美国Hylcone公司;转染试剂Lipofectamine 2000购自美国Invitrogen公司;聚凝胺polybrene购自美国Sigma公司;Western底物购自美国Millipore公司;Matrigel购自美国BD Biosciences公司;Transwell嵌套(8 μm孔径)购自美国Corning公司;BCA试剂盒及HRP-DAB显色试剂盒购自北京TIANGEN公司;SPF级BALB/c裸鼠6只,4~5周龄雌性,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001;Gateway慢病毒包装系统来自美国马里兰大学John Basile博士的惠赠;小鼠抗人Sema4D购自美国BD公司;小鼠抗人β-actin购自美国Santa Cruz公司;羊抗小鼠IgG,HRP标记购自美国KPL公司;大鼠抗小鼠CD31购自美国BD公司;Dylight 488羊抗大鼠IgG购自美国Jackson公司。
1.2 方法
1.2.1 细胞培养 DMEM含10%FBS,37℃、5%CO2培养箱内培养。
1.2.2 慢病毒包装 将6×106个293T细胞,铺到10 cm2培养皿中,待细胞融合度达70%~80%。将pVSVG包膜质粒,pSPAX结构质粒及PWPI Sema4D shRNA干扰质粒或PWPI eGFP对照慢病毒质粒按比例混合,依操作说明与转染试剂Lipofectamine 2000混匀,转染293T细胞。24 h后换培养基,随后的48、72 h收获含慢病毒的上清,-80℃保存。
1.2.3 用重组慢病毒感染目的细胞 慢病毒培养上清于冰上化冻,与完全培养基等体积混匀,加polybrene至8 μg/mL。HCT-116达到60%融合度时感染,过夜更换培养基。感染72 h收获细胞,取样用于Western blot检测,其余用于后续实验。
1.2.4 Western blot 提细胞总蛋白,BCA法测定蛋白浓度,调整一致,样品经电泳转膜,5%脱脂奶粉封闭1 h。一抗(1:1 000)分别为:小鼠抗人Sema4D、小鼠抗人β-actin 4℃孵育过夜,二抗羊抗小鼠IgG(1:5 000)37℃ 1 h,暗室显影。
1.2.5 Transwell迁移实验 经对照组和干扰组HCT-116细胞处理的无血清DMEM作诱导物,阳性对照:DMEM含10%FBS;阴性对照:无血清DMEM。HUVEC细胞悬于无血清DMEM作为迁移细胞,约1×106个/mL。每组4孔培养10h取出固定、HE染色。膜扫描后用NIH Image软件分析不同实验组HUVEC细胞迁移率。
1.2.6 移植瘤模型的建立 消化对照慢病毒和干扰慢病毒感染的直肠癌细胞,无血清DMEM重悬为1×107/mL,与等体积Matrigel在冰上混匀。对照组和干扰组分别接种于裸鼠左、右侧腋窝皮下,含细胞2×106/侧。每周测量瘤体长径(a)和短径(b),计算肿瘤体积(V),公式V=ab2/2。
1.2.7 免疫组织化学检测Sema4D水平 取出移植瘤,固定包埋。石蜡切片经脱蜡水化,抗原修复。1%BSA 37℃封闭1 h,一抗小鼠抗人SEMA4D(1:100)37℃ 1 h,二抗羊抗小鼠IgG(1:200)37℃ 1 h,显色。
1.2.8 免疫荧光检测血管生成情况 CD31作为内皮细胞标记,广泛用于评估血管生成。移植瘤做8 μm冰冻切片,4%中性甲醛固定10 min。1%BSA 37℃封闭1 h,一抗大鼠抗小鼠CD31(1:100稀释)37℃ 1 h,二抗羊抗大鼠IgG(1:200)避光37℃1 h,荧光显微镜观察。每组选12张切片,每个移植瘤至少一张,其余随机。用NIH Image软件分析比较2组照片中的血管密度。
2 结果
2.1 慢病毒感染能有效干扰细胞Sema4D的表达
慢病毒感染能够使外源片段整合到宿主细胞的染色体上,实现长期稳定的表达。而由于外源片段插入的随机性,慢病毒感染的效果需要验证。Western blot检测证实:在细胞总蛋白浓度一致的前提下,Sema4D在不感染组与对照病毒感染组间无明显差异,而干扰组则显著下调(图1)。说明Sema4D shRNA慢病毒感染直肠癌细胞HCT-116,特异性的干扰Sema4D的表达,而对照慢病毒对目的蛋白水平无明显影响。
2.2 Transwell结果显示干扰Sema4D减弱靶细胞诱导内皮细胞迁移的能力
Sema4D经基质金属蛋白酶剪切,其胞外部分释放到环境中,与血管内皮细胞上的受体结合,诱导血管内皮细胞迁移[10]。血管内皮细胞运动迁移是血管形成过程的关键步骤之一。结果显示下调Sema4D表达量的HCT-116诱导HUVEC迁移的能力减弱,略高于阴性对照(图2)。
2.3 移植瘤模型显示干扰Sema4D的表达能减缓裸鼠皮下移植瘤生长的速度
接种细胞1周后对照组皮下可见明显瘤块,瘤体近圆形或椭圆形,有不规则凹凸。移植瘤表面血管丰富,无溃疡出现。干扰组在3~4周可陆续观察到大小不等的瘤块。30 d收获移植瘤,接种成功率100%。对照组血供丰富且瘤体和周围的组织发生粘连较重,而干扰组相对血供较少。同一宿主的移植瘤,对照组比干扰组更有竞争优势,二者差异表达的基因Sema4D可能在这一竞争优势的差异上有所贡献。诱导血管新生的能力是移植瘤竞争优势中的一个重要指标,因为在体内癌细胞的养分主要来自宿主血供。比较同一个宿主的2个移植瘤,对照组大于干扰组的现象很明显;但是个别宿主的干扰组移植瘤也较大,接近某些宿主的对照组。总体上干扰组的生长速度和移植瘤体积依然明显小于对照组。通过个体和整体两方面比较,来衡量表达Sema4D对HCT-116细胞成瘤的贡献(图3,4)。
2.4 慢病毒感染稳定干扰移植瘤中Sema4D的表达
免疫组织化学染色显示:移植瘤中对照组Sema4D表达水平高于干扰组。慢病毒不仅有效抑制了目的蛋白在细胞系中的表达,也能稳定降低其在移植瘤中的表达水平(图5)。进一步验证了慢病毒载体能够实现持久稳定的干扰。
2.5 干扰Sema4D的表达能降低移植瘤内血管密度
免疫荧光显示:对照组瘤内血管网络丰富,血管形态不规则,干扰组瘤内血管较稀少。通过相对荧光强度比较,干扰组血管密度比对照组低约40%(图5)。瘤内血管密度代表了所有血管新生调节因子和信号通路的效应总和,比单独检测一个生长因子或信号通路更能反映实际情况。因此也是衡量肿瘤血管新生功能的常用指标,有研究显示肿瘤微血管密度与患者预后有一定相关性[11]。
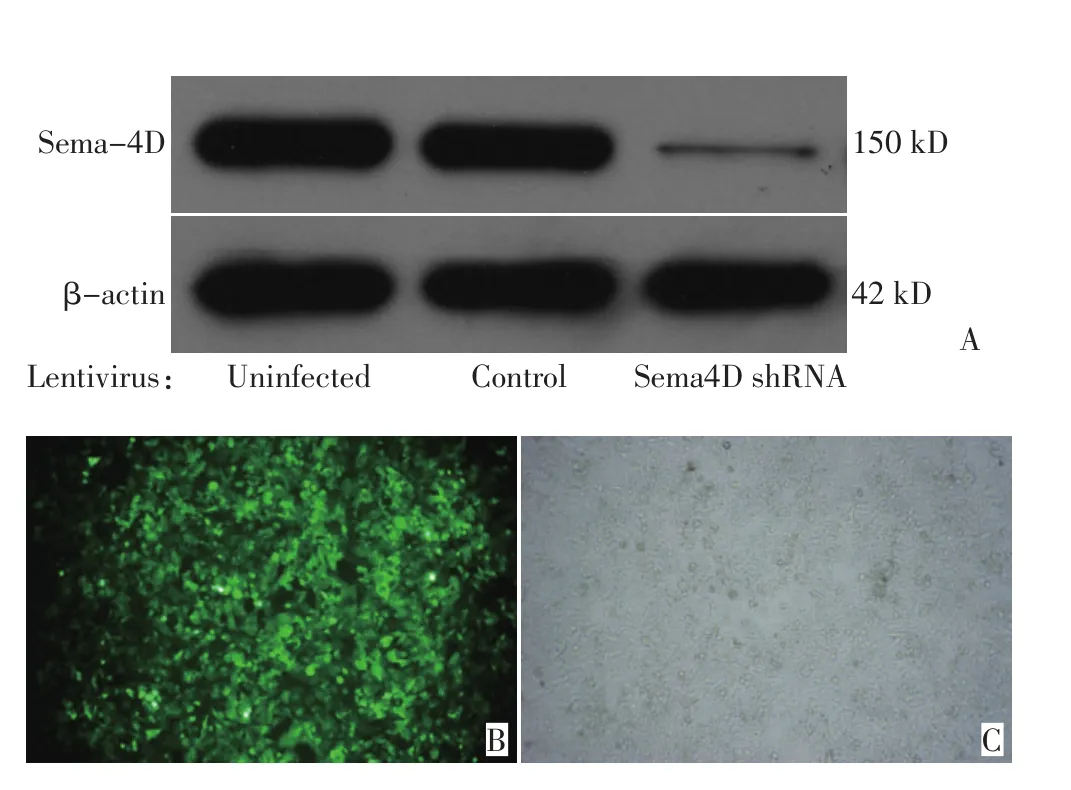
图1 慢病毒转导后的HCT-116(×100)Figure 1 HCT-116 infected by lentivirus(×100)

图2 Transwell迁移实验(×100)Figure 2 Migration assay

图3 移植瘤生长曲线Figure 3 Growth curves of the transplanted tumors
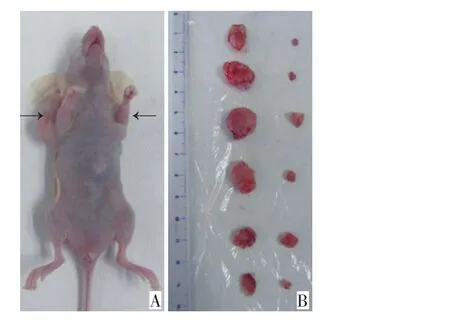
图4 荷瘤裸鼠及2组移植瘤Figure 4 Tumor-bearing nude mouse and colorectal cancer xenografts
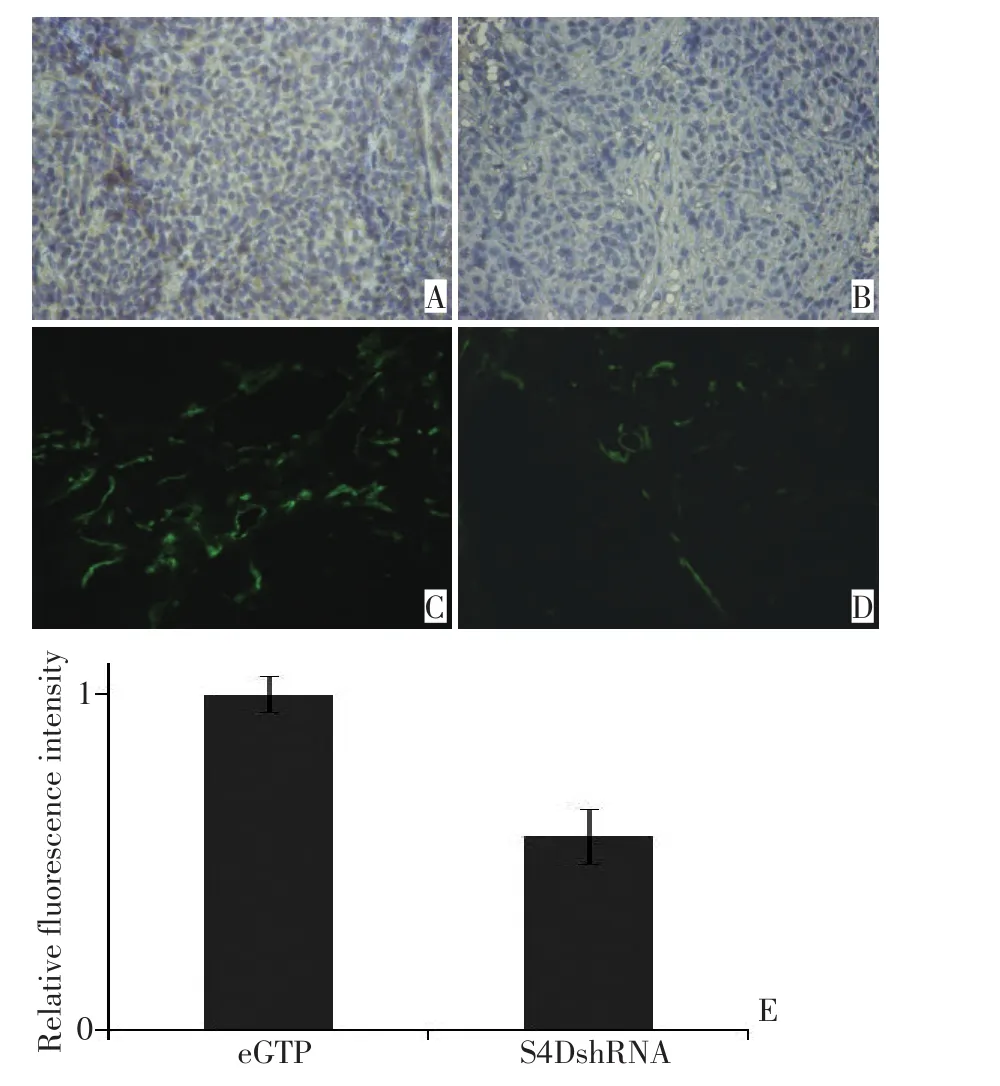
图5 免疫组织化学检测2组移植瘤中Sema4D的表达(×200)及免疫荧光检测血管密度(×200)Figure 5 Immunohistochemistry analysis for Sema4D and immunofluorescence for vascular density×200
3 讨论
抗血管生成疗法以促血管新生信号分子为靶点,机制应包括阻断新血管网络的形成,调整已有供血网络,重塑血管壁,降低肿瘤微血管密度、血管体积和血管网灌注量[5]。这一系列效应减少向癌细胞输送养分,从而抑制癌细胞增殖和肿瘤生长。同时,抗血管新生疗法还可以减少无功能的瘤体血管,降低肿瘤组织间隙液压,促进化疗药物更有效的输送到肿瘤内部,增进化疗效果[12-13]。在实际治疗中,许多化疗药物和抗血管生成的药物联合使用效果更佳。目前肿瘤治疗中已有很多阻断VEGF信号通路的策略,包括VEGF中和抗体,低分子量VEGF受体酪氨酸激酶抑制剂(TKIs),可溶性VEGF陷阱(VEGF-Trap)等。其中贝伐单抗,靶分子为VEGF-A的重组人源化IgG1单克隆抗体,已成为治疗转移性直肠癌的标准方案之一[5,12]。
在原有基础上,进一步诱导并构建新的血管网络,保证肿瘤生长代谢所需的丰富血供为实体瘤生长的限速关卡[14]。瘤体缺氧微环境就是诱导血管新生的“开关”。缺氧诱导因子HIF-1是其中的一个核心调节元件。HIF-1是由α、β两个亚基组成的二聚体,HIF-1β为组成型表达的核蛋白,HIF-1α则受微环境氧压影响。在氧充足的条件下,HIF-1α经脯氨酸羟化酶在Pro402或Pro564位羟基化后,与E3泛素连接酶作用而后经蛋白酶体降解。由于HIF脯氨酸羟化酶活性依赖于Fe2+和O2,低氧水平会导致HIF-1α的累积并与HIF-1β组成有活性的二聚体,进而开启下游一系列目的基因的转录。其中的一条重要通路包括VEGF及其受体家族成员。VEGF可由癌细胞或瘤体基质细胞分泌,其中VEGF-A及其受体VEGFR-2被认为在调节血管新生方面起主要作用[15-16]。
血管新生是一个多因素共同调节的复杂过程。在肿瘤血管生成的调控网络中,抑制主要信号通路,将可能导致其他补救途径的活化。进而引发针对治疗的抗性,以及随后的肿瘤再生长或复发[6]。其次,由于肿瘤诱导血管生成的过程有别于正常生理状态下的血管新生,某些肿瘤诱导血管发生并不依赖于VEGF。临床数据显示,针对VEGF的抗血管新生治疗仅在部分患者中显示疗效[7]。有研究表明[15,17]众多分子参与调节不依赖于VEGF的血管新生信号通路,包括成纤维细胞生长因子(FGF)、白介素8(IL-8)、白介素1b(IL-1b)、表皮生长因子(EGF)、胰岛素样生长因子1(IGF-1)等,这一系列因素都可能影响肿瘤对anti-VEGF治疗的敏感性。
多个国外科研小组包括本文的研究团队均证实,肿瘤细胞表达的信号素4D(Sema4D)通过结合其位于血管内皮细胞上的受体神经丛素-B1(Plexin-B1),能诱导血管新生进而促进肿瘤生长[18-19]。临床样本显示Sema4D在结直肠癌、头颈鳞癌、前列腺癌、乳腺癌等多种癌组织中高表达[9]。已有研究通过体外和体内试验观察:在VEGF通路被阻断后,肿瘤细胞在缺氧诱导因子(HIF)的调控下代偿性地高表达Sema4D,在培养细胞和裸鼠体内均表现出强烈的促血管新生功能,并且Sema4D和VEGF在诱导血管新生应答方面有非常相似的作用[19]。由于Sema4D在诱导血管新生中的作用,干扰Sema4D信号通路将可能通过抑制血管新生来阻止肿瘤生长或转移。临床实际中采用多种药物联合化疗,因为方案中的药物搭配针对不同靶蛋白或信号通路,更能有效抑制癌细胞的增殖和肿瘤生长,同时也能尽量避免抗药性的产生。在实际治疗中,联合使用多种抗血管新生药物而非单一阻断VEGF信号通路,或许是一种更为有价值的治疗策略。
因此,根据每个肿瘤患者的实际情况,设计有针对性的个性化治疗方案,或许是未来抗血管新生疗法的发展方向。只有深入研究肿瘤细胞之间以及肿瘤细胞和宿主细胞之间的信号调节网络,才有可能通过对细胞间信号网络的干预影响肿瘤微环境,进而使肿瘤和宿主间的动态平衡向有利于宿主的方向偏移。研究结果将对改进靶向血管新生的肿瘤治疗方案提供重要的理论和实践依据。
1 Hoffman RM,Espey DK,Rhyne RL,et al.Colorectal cancer incidence and mortality disparities in new Mexico[J].J Cancer Epidemiol,2014,Epub2014 Jan 2.
2 Kekelidze M,D'Errico L,Pansini M,et al.Colorectal cancer:Current imaging methods and future perspectives for the diagnosis,staging and therapeutic response evaluation[J].World J Gastroenterol,2013,19(46):8502-8514.
3 Kokki I,Papana A,Campbell H,et al.Estimating the incidence of colorectal cancer in South East Asia[J].Croat Med J,2013,54(6):532-540.
4 Nimptsch K,Malik VS,Fung TT,et al.Dietary patterns during high school and risk of colorectal adenoma in a cohort of middle-aged women[J].Int J Cancer,2014,134(10):2458-2467.
5 Bellou S,Pentheroudakis G,Murphy C,et al.Anti-angiogenesis in cancer therapy:Hercules and hydra[J].Cancer Lett,2013,338(2):219-228.
6 Ellis LM,Hicklin DJ.Pathways mediating resistance to vascular endothelial growth factor-targeted therapy[J].Clin Cancer Res,2008,14(20):6371-6375.
7 Casanovas O,Hicklin DJ,Bergers G,et al.Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors[J].Cancer Cell,2005,8(4):299-309.
8 Basile JR,Barac A,Zhu T,et al.Class IV semaphorins promote angiogenesis by stimulating Rho-initiated pathways through plexin-B[J].Cancer Res,2004,64(15):5212-5224.
9 Basile JR,Castilho RM,Williams VP,et al.Semaphorin 4D provides a link between axon guidance processes and tumor-induced angiogenesis[J].Proc Natl Acad Sci U S A,2006,103(24):9017-9022.
10 Basile JR,Holmbeck K,Bugge TH,et al.MT1-MMP controls tumor-induced angiogenesis through the release of semaphorin 4D[J].J Biol Chem,2007,282(9):6899-6905.
11 Pastushenko I,Vermeulen PB,Carapeto FJ,et al.Blood microvessel density,lymphatic microvessel density and lymphatic invasion in predicting melanoma metastases:systematic review and meta-analysis[J].Br J Dermatol,2014,170(1):66-77.
12 Gerger A,LaBonte M,Lenz HJ.Molecular predictors of response to antiangiogenic therapies[J].Cancer J,2011,17(2):134-141.
13 Jain RK,Duda DG,Clark JW,et al.Lessons from phase III clinical trials on anti-VEGF therapy for cancer[J].Nat Clin Pract Oncol,2006,3(1):24-40.
14 Moserle L,Casanovas O.Anti-angiogenesis and metastasis:a tumour and stromal cell alliance[J].J Intern Med,2013,273(2):128-137.
15 Pugh CW,Ratcliffe PJ.Regulation of angiogenesis by hypoxia:role of the HIF system[J].Nat Med,2003,9(6):677-684.
16 Shibuya M,Claesson-Welsh L.Signal transduction by VEGF receptors in regulation of angiogenesis and lymphangiogenesis[J].Exp Cell Res,2006,312(5):549-560.
17 Mizumaki Y,Jo WS,Duerr EM,et al.Induction of interleukin-8 preserves the angiogenic response in HIF-1 alpha-de fi cient colon cancer cells[J].Nat Rev,2005,11(9):992-997.
18 Zhou H,Yang YH,Binmadi NO,et al.The hypoxia-inducible factor-responsive proteins semaphorin 4D and vascular endothelial growth factor promote tumor growth and angiogenesis in oral squamous cell carcinoma[J].Exp Cell Res,2012,318(14):1685-1698.
19 Zhou H,Binmadi NO,Yang YH,et al.Semaphorin 4D cooperates with VEGF to promote angiogenesis and tumor progression[J].Angiogenesis,2012,15(3):391-407.

