Fbxw7通过降解c-Myc和Cyclin E诱导胃癌细胞凋亡和生长阻滞
曾长青 黄良祥 黄海啸 陈林昊 郑 羽 池良杰
胃癌(gastric cancer)起源于胃壁最表层的黏膜上皮细胞,其中腺癌约占90%。全世界每年大约新发胃癌100余万,中国占42%,死亡约80万,中国占35%,是胃癌发病率和死亡率最高的国家之一,发病率和死亡率均是世界平均水平2倍多[1]。Fbxw7(F-box and WD repeat domain-containing 7;也称 Fbw7、SEL-10、hCdc4和hAgo)是Skp1-Cul1-F-box(SCF)类泛素连接酶E3复合体中特异性识别底物的关键因子,能够靶向降解Cyclin E,c-Myc,c-Jun和Notch等癌蛋白,是一种广泛的抑癌基因[2]。在许多种人类恶性肿瘤中都发现Fbxw7表达缺失,同时,研究证实下调Fbxw7基因表达可以促进肿瘤细胞增殖[3],而在肝癌细胞中过表达Fbxw7可以诱导细胞凋亡[4]。本实验初步探讨Fbxw7在胃癌发生、发展中的作用,为胃癌治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1 组织标本 胃癌及对应癌旁组织来源于福建省立医院手术切除标本共20例,其中男14例,女6例,年龄31~68(50±3.5)岁。所有患者术前均未行放、化疗,所有组织标本经术后病理学证实为胃腺癌。所有标本于术中离体30 min内取材,经10%福尔马林溶液固定,石蜡包埋、切片备用。
1.1.2 细胞培养 胃腺癌细胞系MGC-803和AZ521均购自于中国科学院生物化学与细胞生物学研究所,MGC-803表达Fbxw7相对较低,AZ521表达Fbxw7相对较高。细胞培养于含100 mL/L胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中,置于37℃、50 mL/L CO2细胞培养箱中,饱和湿度下培养。稳定传代2~3代后,取对数生长期细胞进行实验。
1.1.3 主要试剂 DMEM培养基、青/链霉素和0.25%胰蛋白酶购自Gibco公司;胎牛血清购自浙江天杭生物科技有限公司;二甲基亚砜(DMSO)和苯甲基磺酰氟(PMSF)购自Sigma公司;β-巯基乙醇购自Boehinger公司;ECL化学发光试剂盒和PVDF膜购自Millipore公司;BCA蛋白定量试剂盒购自Pierce公司;质粒小提试剂盒和慢病毒包装试剂盒购自QIAGEN公司;Fbxw7抗体购自Abcam公司;c-Myc和Cyclin E抗体购自CST公司;β-actin抗体购自Santa Cruz公司;免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司;噻唑蓝(MTT)购自Roche公司。
1.2 方法
1.2.1 免疫组织化学染色 对石蜡块进行4 μm连续切片制片。经过脱蜡过程后,进行热抗原修和内源性过氧化物酶灭活,100 mL/L山羊血清封闭,1∶100稀释的Fbxw7一抗4℃孵育过夜。以PBS取代一抗为阴性对照。滴加生物素标记的山羊抗鼠二抗工作液,滴加辣根酶标记的链霉卵白素工作液,滴加DAB显色,苏木苏轻度复染,梯度脱水至透明。显微镜下观察、成像系统拍照。采用染色强度联合阳性细胞百分比进行评分:染色强度分为4等级:0分,阴性;1分,弱阳性;2分,中度;3分,强阳性;阳性细胞百分比分级如下:阳性细胞≤5%为0分,6%~25%为1分,26%~50%为2分,51~75%为3分,>75%为4分。染色强度和阳性细胞百分比评分相乘≥1分则认为Fbxw7蛋白阳性表达[3]。
1.2.2 质粒转染 Fbxw7过表达质粒、空白对照质粒(EV)、Fbxw7 shRNA和阴性对照shRNA(NT-shRNA)由Kanae Yumimoto教授惠赠(Department of Molecular and Cellular Biology,Medical Institute of Bioregulation,Kyushu University)。质粒转染按照 Effectene®Transfection Reagent说明书操作。
1.2.3 Western blot检测 取转染48 h后的细胞,弃培养基,使用RIPA裂解液提取总蛋白,BCA法测定总蛋白浓度。12%聚丙烯酰胺凝胶电泳1.5 h,4℃下110 V电压湿转1.5 h。5%脱脂奶粉(TBST溶解)室温封闭,加入1∶1 000稀释的Fbxw7、c-Myc和Cyclin E抗体以及1∶10 000稀释的β-actin抗体,4℃孵育过夜,加入适当(1∶2 500)浓度的二抗,室温孵育2 h。暗室内浸入ECL液显色,并使胶片曝光,全自动X光洗片机洗片。
1.2.4 MTT法检测细胞增殖 离心、收集转染12 h的细胞,,调节细胞密度约为2×105/mL,以200 μL/孔接种于96孔板。96孔板的左上孔设为空白孔,每组设6个复孔。加5 mg/mL MTT溶液20 μL/孔,继续避光培养4 h,弃上清,加DMSO 150 μL/孔,37℃振摇孵育20 min至颗粒溶解。酶标仪上测定各孔490 nm的吸光度(OD490),分析各组细胞活性。
1.2.5 流式细胞术 细胞转染48 h后,用磷酸盐缓冲液(PBS)洗涤细胞1次,再用胰酶消化液解离细胞,1 500 r/min离心5 min,弃上清液收集细胞。用PBS重新悬浮细胞,并计数。取1~5×105细胞悬浮液,1 500 r/min,5 min离心后弃上清液,加入500 μL的1×结合缓冲液。加入5 μL Annexin V-FITC,再加入10 μL碘化丙啶,移液器轻轻吹打混匀。室温下避光反应5~15 min,在1 h内进行流式细胞仪检测。
1.3 统计学分析
2 结果
2.1 Fbxw7在胃癌组织中低表达
免疫组织化学法检测Fbxw7在20例胃癌及对应癌旁组织中的表达水平,结果发现Fbxw7在胃癌组织中的表达水平(1.24±0.23)显著低于对应的癌旁组织(7.68±2.13)(n=20,t=8.456,P=0.004);Fbxw7蛋白主要定位在细胞质和胞膜中(图1)。

图1 Fbxw7在胃癌及对应癌旁组织中的免疫组织化学染色 (SP×400)Figure1 Immunohistochemical staining of Fbxw7 in gastric cancer tissues and normal tumor-adjacent tissues (SP×400)
2.2 过表达Fbxw7下调c-Myc和Cyclin E蛋白表达
采用Fbxw7过表达质粒转染MGC-803细胞,Western blot检测转染48 h后的MGC-803细胞中Fbxw7及其靶蛋白c-Myc和Cyclin E的表达,结果显示Fbxw7蛋白表达明显升高并伴随c-Myc和Cyclin E明显降低(图2)。
2.3 过表达Fbxw7降低细胞增殖能力
采用MTT法连续检测Fbxw7过表达细胞的增殖能力,结果显示相对于空质粒(EV)转染细胞组,Fbxw7过表达后MGC-803细胞增殖能力显著减弱(P<0.05,图3)。
2.4 过表达Fbxw7诱导细胞凋亡
MGC803细胞转染Fbxw7过表达质粒48 h后,采用流式细胞术检测细胞凋亡变化,结果显示Fbxw7过表达组细胞凋亡较空质粒(EV)组显著增加(P<0.05,图4)。
2.5 敲低Fbxw7导致c-Myc和Cyclin E蛋白蓄积
Fbxw7 shRNA转染AZ521细胞48 h后,Western blot检测Fbxw7及其靶蛋白c-Myc和Cyclin E的表达,结果显示Fbxw7蛋白表达明显降低并伴随c-Myc和Cyclin E蛋白蓄积(图5)。
2.6 敲低Fbxw7增强细胞增殖能力
采用MTT法连续检测敲低Fbxw7对细胞增殖能力的影响,结果显示相对于阴性对照(NT-shRNA)转染细胞组,敲低Fbxw7后AZ521细胞增殖能力显著增强(P<0.05,图6)。

图2 MGC-803细胞过表达Fbxw7导致c-Myc和Cyclin E蛋白表达下调Figure2 Fbxw7 overexpression leads to downregulation of c-Myc and Cyclin E protein expression in MGC-803 cells
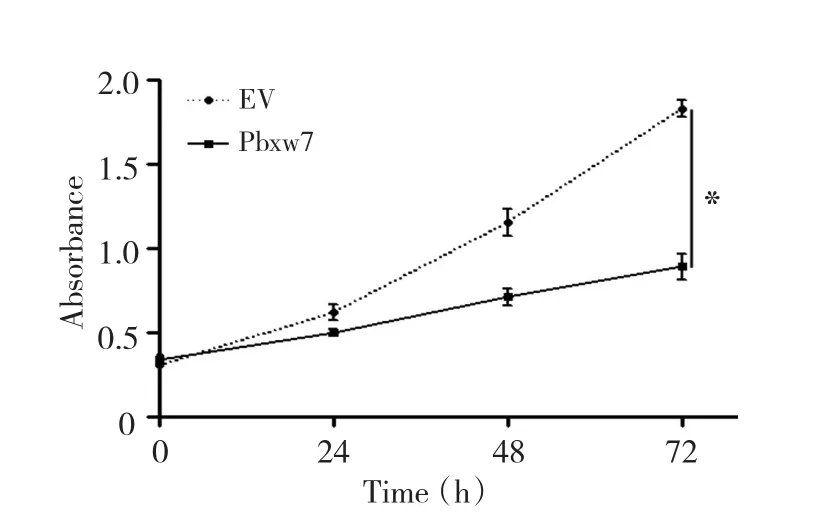
图3 过表达Fbxw7降低MGC-803细胞增殖能力Figure3 Fbxw7 overexpression decreases MGC-803 cell proliferation
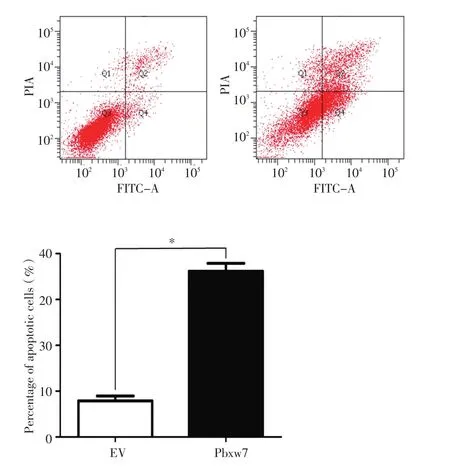
图4 过表达Fbxw7诱导MGC-803细胞凋亡Figure4 Fbxw7 overexpression induces MGC-803 cell apoptosis
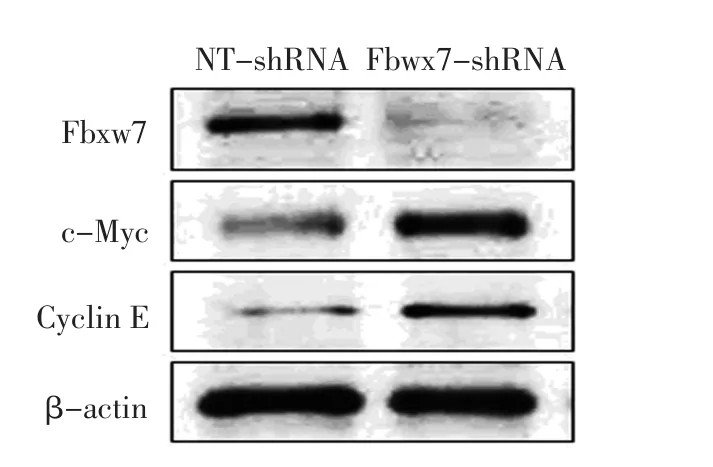
图5 敲低AZ521细胞中Fbxw7表达导致c-Myc和Cyclin E蛋白表达上调Figure5 Fbxw7 knockdown leads to accumulation of c-Myc and Cyclin E protein in AZ521 cells

图6 敲低Fbxw7增强AZ521细胞增殖能力Figure6 Fbxw7 knockdown increases AZ521 cell proliferation
2.7 敲低Fbxw7减少细胞凋亡
AZ521细胞转染Fbxw7 shRNA 48 h后,采用流式细胞术检测细胞凋亡变化,结果显示Fbxw7 shRNA组细胞凋亡较阴性对照(NT-shRNA)组显著减少(P<0.05,图7)。

图7 敲低Fbxw7减少AZ521细胞凋亡Figure7 Fbxw7 knockdown decreases AZ521 cell apoptosis
3 讨论
靶蛋白的泛素化是由功能连续的三个酶介导的:泛素激活酶(E1)、泛素载体蛋白酶(E2)和泛素连接酶(E3)。泛素化底物被26S蛋白酶体选择性的识别和降解[5]。SCF类E3复合体是泛素连接酶(E3)中的一类,由环指蛋白(ring-box 1,Rbx1;也称Roc1和Hrt1)、支架蛋白(cullin1,Cul1)、衔接蛋白(S-phase kinase-associated protein 1,Skp1)和一个 F-box蛋白组成,其中F-box蛋白类决定底物特异性[6]。Fbxw7是F-box蛋白家族的一员,对漂亮新小杆线虫进行遗传分析时,Fbxw7作为LIN-12介导(Notch介导)信号通路的负调节因子首次被发现。Fbxw7在哺乳动物细胞中也与Notch家族蛋白类相互作用,促进其泛素依赖的更新[7]。而且Fbxw7靶向降解数个控制哺乳动物细胞周期进程的蛋白,包括CyclinE、c-Myc和c-Jun,同时 SREBPs(sterol regulatory element binding protein)、mTOR(mammalian target of rapamycin)和PGC-1α(PPARγ-coactivator-1α)等不直接参与细胞周期调控的蛋白也通过Fbxw7靶向降解[8]。
CyclinE、c-Myc、c-Jun和Notch都是原癌基因的产物,Fbxw7能促进这些癌蛋白的降解,因此被认为是一种广泛的肿瘤抑制因子[9]。Yakobori等[10]发现Fbxw7低表达与胃癌淋巴结转移、肿瘤大小和不良预后相关,而且Fbxw7低表达合并p53突变的胃癌患者具有不同的预后不良,提示协同破坏p53和Fbxw7促进肿瘤患者预后不良。另外6%前列腺癌中存在Fbxw7基因位点修饰,Fbxw7亚型差异表达与前列腺癌高分期和复发呈负相关[11]。另外一个团队也证实Fbxw7突变导致的Cyclin E高表达在胰腺癌发展中发挥决定性作用[12]。这些结果提示Fbxw7在多种人类肿瘤发生中作为肿瘤抑制基因发挥功能。本研究应用免疫组织化学技术发现Fbxw7在胃癌组织中的表达明显低于对应的癌旁组织,这与之前的相关报道一致[10,13-15]。在许多种人类恶性肿瘤中都发现Fbxw7表达缺失,包括急性T细胞型淋巴细胞白血病、胆管上皮癌、胰腺癌、肝癌、食管鳞状细胞癌、结肠癌、前列腺癌、乳腺癌和子宫内膜癌[3]。p53可以直接调控Fbxw7表达[16],但0~77%的胃癌组织中存在p53突变[17],而且研究表明6%胃癌组织中存在Fbxw7基因突变[9],以上两种机制可能是导致胃癌中Fbxw7低表达的原因。Fbxw7调控多种癌蛋白的表达,但在胃癌中其具体的调控靶点和相关通路尚不清楚,国外研究证实应用特异性Fbxw7 siRNA下调Fbxw7基因表达可以导致c-Myc和Cyclin E蓄积并促进胃癌细胞增殖[13]。本研究在胃癌MGC-803细胞中过表达Fbxw7,结果发现Fbxw7下调c-Myc和Cyclin E蛋白表达水平,抑制细胞增殖并诱导细胞凋亡,而在AZ521细胞中转染Fbxw7 shRNA后,导致c-Myc和Cyclin E蛋白蓄积,并伴随细胞增殖能力增强和凋亡减少。c-Myc在有丝分裂信号通路和细胞生长过程中发挥重要作用,并参与细胞凋亡信号通路,Cyclin E是细胞周期调控的关键组分,两者在胃癌组织中都表达失调[18-19]。结合以上结论推测Fbxw7在胃癌中作为肿瘤抑制因子发挥功能,其可能通过调节c-Myc和Cyclin E的表达介导胃癌细胞的增殖和凋亡调控。
1 Ye YJ,Guo P,Wang S.Multidisciplinary Management of Gastric Cancer:Present and Future Status[J].Chin J of Clin Oncol,2012,39(20):1475-1480[.叶颖江,郭 鹏,王 杉.胃癌综合治疗的现状与展望[J].中国肿瘤临床,2012,39(20):1475-1480.]
2 Zhou ZY,Tu KS,Zhang J,et al.Expression of Fbxw7 and its correlation with cell proliferation in human hepatocellular carcinoma[J].Chin J of Cell and Mole Imm,2012,28(12):1303-1306[.周振宇,涂康生,张 竞,等.Fbxw7在肝癌中的表达及与肝癌细胞增殖相关性研究[J].细胞与分子免疫学杂志,2012,28(12):1303-1306.]
3 Tu K,Zheng X,Zan X,et al.Evaluation of Fbxw7 expression and its correlation with the expression of c-Myc,cyclin E and p53 in human hepatocellular carcinoma[J].Hepatol Res,2012,42(9):904-910.
4 Tu K,Zheng X,Zhou Z,et al.Recombinant human adenovi-rus-p53 injection induced apoptosis in hepatocellular carcinoma cell lines mediated by p53-Fbxw7 pathway,which controls c-Myc and cyclin E[J].PLoS One,2013,8(7):e68574.
5 Han SS,Sun H.Research advances in UbcH10 and Its relationship with cancer[J].Chin J of Clin Oncol,2011,38(14):867-869.[韩少山,孙昊.UbcH10与肿瘤关系研究进展[J].中国肿瘤临床,2011,38(14):867-869.]
6 Welcker M,Clurman BE.FBW7 ubiquitin ligase:a tumour suppressor at the crossroads of cell division,growth and differentiation[J].Nat Rev Cancer,2008,8(2):83-93.
7 Kim MY,Jung J,Mo JS,et al.The intracellular domain of Jagged-1 interacts with Notch1 intracellular domain and promotes its degradation through Fbw7 E3 ligase[J].Exp Cell Res,2011,317(17):2438-2446.
8 Tu K,Zheng X,Yin G,et al.Evaluation of Fbxw7 expression and its correlation with expression of SREBP-1 in a mouse model of NAFLD[J].Mol Med Report,2012,6(3):525-530.
9 Akhoondi S,Sun D,von der Lehr N,et al.FBXW7/hCDC4 is a general tumor suppressor in human cancer[J].Cancer Res,2007,67(19):9006-9012.
10 Yokobori T,Mimori K,Iwatsuki M,et al.p53-Altered FBXW7 expression determines poor prognosis in gastric cancer cases[J].Cancer Res,2009,69(9):3788-3794.
11 Liu Y,Ren S,Castellanos-Martin A,et al.Multiple novel alternative splicing forms of FBXW7 α have a translational modulatory function and show specific alteration in human cancer[J].PLoS One,2012,7(11):e49453.
12 Calhoun ES,Jones JB,Ashfaq R,et al.BRAF and FBXW7(CDC4,FBW7,AGO,SEL10)mutations in distinct subsets of pancreatic cancer:potential therapeutic targets[J].Am J Pathol,2003,163(4):1255-1256.
13 Huang GQ,Zhang CQ,Peng XC,et al.The Expression and Significance of CDC4 and cyclin E in Gastric Cancer[J].Life Science Research,2011,15(4):339-344.[黄国全,张才全,彭小超,等.胃癌中CDC4和cyclinE的表达及临床意义[J].生命科学研究,2011,15(4):339-344.]
14 Li XL,Wang GJ,Pei YX,et al.Expressions of FBXW7 and Cyclin E proteins in gastric carcinoma tissue[J].J of zhengzhou university(Medical Sciences),2012,47(4):494-496.[李向垒,王贵吉,裴迎新,等.胃癌组织中F框/WD-40域蛋白7和Cyclin E蛋白的表达[J].郑州大学学报(医学版),2012,47(4):494-496.]
15 Zhang Q,Wang GJ,Pei YX,et al.The clinical significance of expression of FBXW7 and SRC-3 in gastric carcinoma[J].J of Shandong university(Health Science),2011,49(12):66-69.[张 琪,王贵吉,裴迎新,等.FBXW7和SRC-3在胃癌中的表达及临床意义[J].山东大学学报(医学版),2011,49(12):66-69.]
16 Jian-Hua Mao,Jesus Perez-losada,Di Wu,et al.Fbxw7/Cdc4 is a p53-dependent,haploinsufficient tumour suppressor gene[J].Nature,2004,432(9):775-779.
17 Fenoglio-Preiser CM,Wang J,Stemmermann GN,et al.TP53 and gastric carcinoma:a review[J].Hum Mutat,2003,21(3):258-270.
18 Zhang L,Hou Y,Ashktorab H,et al.The impact of C-MYC gene expression on gastric cancer cell[J].Mol Cell Bio,2010,344(1-2):125-135.
19 Gou Y,Shi Y,Zhang Y,et al.Ribosomal protein L6 promotes growth and cell cycle progression through upregulating cyclin E in gastric cancer cells[J].Bio Bio Res Com,2010,393(4):788-793.

