SHMT1多态性与ALL儿童HD-MTX不良反应的关系*
丁 慧 岳丽杰 于 洁 谢 偲 杨春兰 任艳飞 刘 畅
急性淋巴细胞白血病(acute lymphocytic leukemia,ALL)是最常见的儿童癌症,占全部儿童恶性肿瘤的30%[1-2]。随着化学治疗的进步,目前儿童ALL的生存率已达80%~90%。叶酸拮抗剂甲氨蝶呤(methotrexate,MTX)是儿童ALL主要的化疗药物,现已广泛应用于其巩固治疗及髓外白血病的防治,并且在治疗过程中取得了显著疗效。然而,部分个体在用药过程中缺乏疗效或产生严重的不良反应而未能达到预期效果。因此,如何提高大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)的药效并降低其不良反应成为当前治疗儿童ALL的焦点话题。国外有人对MTX代谢的关键酶之一丝氨酸羟甲基转移酶1(serine hydroxymethyltransferase 1,SHMT1)基因多态性与MTX不良反应的关系做了研究,但其结果存在争议。国内少见到该方面的报道。本实验以深圳地区汉族ALL患儿为研究对象,进一步探讨SHMT1多态性与HD-MTX疗效及不良反应的关系,以期为MTX更有效地应用于临床提供依据。
1 材料与方法
1.1 研究对象
深圳市儿童医院2003年3月至2011年6月收治的51例ALL儿童,且均为中国汉族儿童。男35例,女16例,发病年龄6个月~13岁,平均(5.07±2.83)岁。包括47例B-ALL和4例T-ALL,其中高危10例,中危18例,标危23例。所有患儿经细胞形态学、免疫学和细胞遗传学诊断及分型,其诊断参照国内儿童ALL诊断标准[3]。
该51例ALL儿童包括43例依照GZ-2002-ALL化疗方案(广东省改良的BFM-2002-ALL化疗方案)化疗患儿和8例依照GD-2008-ALL化疗方案化疗患儿,均接受HD-MTX加四氢叶酸钙(calcium folinate,CF)预防髓外白血病。标、中危(T-ALL除外)患儿HD-MTX用量2~3 g/m2,T-ALL和高危患儿HD-MTX用量5 g/m2。所有患儿化疗前查肝肾功能、血常规、心电图、心肌酶谱等均达化疗要求。HD-MTX用药前预防呕吐治疗,同时每晚睡前口服6-巯基嘌呤25 mg/m2·d;用药当天及其后3 d大量补液,充分水化及碱化尿液,以减小肾功能损害;用药结束后36 h开始行CF解救,减小MTX不良反应。化疗期间用0.1%洗必泰溶液漱口及0.05%利凡诺坐浴,预防口腔黏膜及肛周感染。化疗结束后复查各项常规检查。
1.2 方法
1.2.1 MTX不良反应评价指标 于HD-MTX用药后2周内或实行下一轮化疗前观察其不良反应,并参照世界卫生组织制订的《抗癌药物急性及亚急性毒性反应分度标准》(WHO标准)进行评估。0度表示无毒性,1度及2度代表轻度毒性,3度及4度代表严重毒性。抗肿瘤药物应用过程中,出现1、2度不良反应在允许范围内;出现3度不良反应时,应停止化疗,并进行对症处理及调整用药剂量;出现4度不良反应时,应立即停止化疗及进行救治。为此,本研究中将HD-MTX用药后患儿出现的不良反应按0、1、2、3和4度共5组进行统计。
1.2.2 样本采集 经深圳市儿童医院医学伦理委员会批准,患儿监护人知情同意并签字后,于化疗及输血前抽取1.5 mL患儿骨髓液,EDTA抗凝。用QIAamp®RNA Blood Mini Kit提取mRNA后再经Reverse Transcriptase XL试剂盒逆转录获得cDNA,然后以cDNA为模板扩增目的基因。
1.2.3 SHMT1多态性检测 用Primer 5.0软件自行设计扩增全长SHMT1 cDNA全编码区和3`-非翻译区的引物以及覆盖该片段的巢式PCR引物,用PCR扩增、变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)筛查出突变样本后,针对DGGE筛查的突变位点大致cDNA位置设计出测序引物。测序引物:上游引物为5'-GTCAGAGCCACCCTGAAA G-3',下 游 引 物 为 5'-AGCCTGGTTGATTCTCACA C-3',扩增片段长772 bp。PCR扩增体系和扩增条件同文献[4]。
PCR扩增产物检测:取5 μL扩增产物与1 μL 6×上样缓冲剂混合后,于2%琼脂糖80 V电泳20 min。经凝胶成像系统成像并拍照,与100 bp对照,出现清晰目的条带者送英潍捷基(上海)公司进行测序。测序结果经Chromas软件分析。
1.3 统计学分析
用SPSS 13.0软件进行分析数据分析。用基因计数法统计SHMT1多态性位点的基因型及等位基因频率,用χ2检验分析51例ALL儿童SHMT1多态性是否符合Hardy-Weinberg遗传平衡及其与HD-MTX不良反应的关系。P<0.05为差异有统计学意义。
2 结果
2.1 HD-MTX不良反应发生情况
HD-MTX产生的不良反应表现为骨髓抑制(血红蛋白、中性粒细胞、血小板等减少)、肝功能损害、口腔黏膜炎、神经系统症状及恶心、呕吐等消化道症状。本组临床资料中,其严重不良反应主要表现在骨髓抑制和肝功能损害,消化道反应、口腔黏膜炎及神经系统症状多在可允许范围内,未发现明显肾功能损害(表1)。
2.2 筛查及测序结果
DNA测序结果与DGGE筛查结果一致。51例ALL患儿中,rs3783(C>G)、rs1979276(C>T)、rs12952556(A>G)及rs1979277(C>T)四个基因位点基因型分布情况相同,即为相同的野生、杂合或纯合基因型,且分布频率符合Hardy-Weinberg遗传平衡(χ2=1.768,P=0.184)。野生基因型44例,占86.2%;杂合基因型6例,占11.8%;纯合基因型1例,占2.0%。因此,本文章对SHMT1多态性与MTX不良反应关系的分析均以rs1979277(C1420T)为代表。此外,本实验为分析ALL儿童SHMT1多态性的病例对照研究,该多态性在深圳地区正常中国汉族儿童中的分布、与儿童ALL易感性关系的分析、实验中的DGGE筛查图像及测序图谱另有文章发表[5]。
2.3 SHMT1 rs1979277多态性与MTX不良反应的关系
基于样本数量有限及MTX不良反应的严重程度,分别对51例ALL患儿SHMT1 rs1979277多态性与发生中性粒细胞减少和肝功能损害的病例进行统计学分析。同时由于决定是否开始新一轮HD-MTX化疗的中性粒细胞最低值是0.5×109/L,即《抗癌药物急性及亚急性毒性反应分度标准》3与4度不良反应分界值,故将发生中性粒细胞减少的病例分<4度和4度两组进行分析。经分析发现,rs1979277多态性与发生4度中性粒细胞减少发生风险无关(P>0.05);rs1979277 CT、TT基因型具有保护作用,可降低肝功能损害的发生风险(P<0.05,表2、表3)。

表1 51例ALL儿童HD-MTX用药后产生的不良反应 例(%)Table1 Toxicities in 51 ALL children treated with HD-MTX (n%)

表2 51例ALL儿童SHMT1rs1979277与HD-MTX引起的中性粒细胞减少的关系 例(%)Table2 Relationship between SHMT1 rs1979277 and HD-MTX-related neutropenia in 51 cases with childhood ALL (n%)
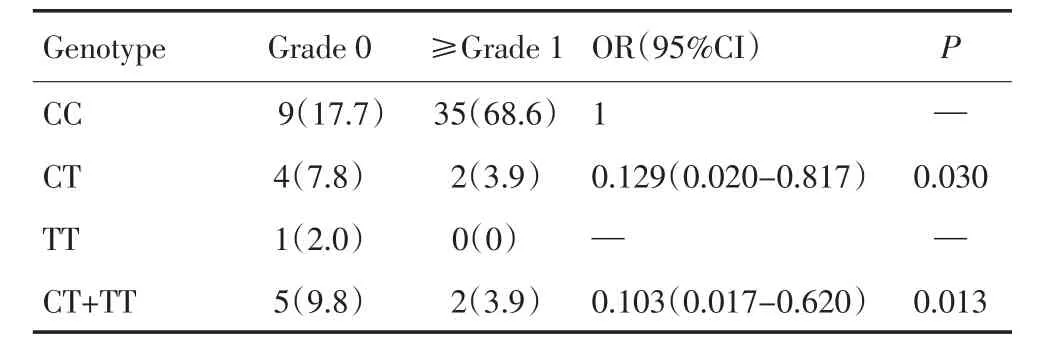
表3 51例ALL儿童SHMT1rs1979277与HD-MTX引起的肝功能损害的关系 例(%)Table3 Relationship between SHMT1 rs1979277 and HD-MTX-related hepatotoxicity in 51 cases with childhood ALL (n%)
3 讨论
叶酸是维持细胞正常功能的必需营养素,其正常代谢为RNA和DNA合成原料嘌呤和嘧啶的合成、DNA及蛋白质的甲基化等提供一碳供体。MTX通过竞争性抑制叶酸代谢而抑制RNA及DNA合成,进而导致细胞死亡发挥药理作用。然而,在用药过程中,MTX呈现较低的化疗指数,患者对该药的治疗反应存在差异,约1/3患者的治疗失败归因于缺乏疗效或严重不良反应[6],HD-MTX化疗常常由于严重不良反应而减少用药剂量或停止用药。本研究中,HD-MTX不良反应表现为血红蛋白、中性粒细胞及血小板减少,肝功能损害,口腔黏膜炎,消化道及神经系统症状。其中以中性粒细胞减少和肝功能损害最为严重,其他症状多在可允许范围内。尽管在用药过程中均采取了相应的防护及治疗措施,但是不同个体间MTX药效和不良反应的差异性仍是目前临床治疗面临的一大难题。
个体间药效的差异性涉及多种因素,包括患者个人因素(年龄、性别、种族、合并症),疾病特异因素(疾病的持续时间、严重程度、活动状况)及基因因素。Yen-Revollo等[7]提出药物代谢酶基因多态性可以解释大部分用药个体间药效和不良反应的差异性。SHMT1作为MTX产生药效的关键酶之一,其最常见基因多态性位点rs1979277(C1420T)得到科研工作者的极大关注。既往研究提出,与SHMT 1420CC和TT基因型相比,CT基因型ALL患儿HD-MTX应用过程中产生较低的肝脏毒性[8]。与之相反,Owen等[9]研究MTX治疗的关节炎患者提出,SHMT1 C1420T多态性与MTX药效和不良反应无关,Stamp等[10]认为SHMT C1420T与MTX代谢产物聚谷氨酸浓度无关,一定意义上亦肯定了Owen等研究结果。此外,有人认为基因多态性所致酶活性的改变只在应用小剂量MTX时发挥调节作用,不适用ALL时HD-MTX化疗的调节[11]。本研究中,rs1979277为代表分析SHMT1多态性,其结果显示CT和TT基因型降低HD-MTX肝脏毒性而与中性粒细胞减少无关。由于rs1979277、rs3783、rs1979276及rs12952556的分布情况相同,本研究尚不能定论SHMT1 rs1979277多态性与HD-MTX不良反应具有相关性。但由此可推测,此四个多态性位点联合作用下,ALL儿童HD-MTX用药后中性粒细胞减少的发生风险无显著变化,它们中的一个或几个基因位点可能降低肝功能损害的发生风险。
最新研究报道,携带SHMT1内含子rs9909104 TC基因型的ALL儿童较TT基因型者生存率降低[12],MTX化疗失败可能与化疗前患者叶酸水平相关[13]。据此可以推测,叶酸代谢酶基因内含子的多态性及患者体内叶酸水平可能影响MTX化疗的疗效及不良反应。探讨叶酸代谢酶基因多态性与MTX疗效及不良反应的关系,应加强此两方面内容的研究。
总之,本研究实验路线成熟,实验结果可靠,之前课题组成员对HD-MTX药效及不良反应的研究亦取得一定成绩[14-15]。现首次对中国汉族ALL儿童SHMT1多态性与HD-MTX不良反应的关系作出分析:ALL儿童接受HD-MTX化疗后产生的严重不良反应主要表现为中性粒细胞减少和肝功能损害;rs1979277、rs3783、rs1979276及rs12952556联合作用对中性粒细胞减少无显著影响,但其中一个或几个基因位点可能降低肝脏毒性的发生风险。基于单核苷酸多态性因种族及地区不同而存在差异,而本研究仅针对中国深圳地区汉族儿童,且样本数量有限,为确定SHMT1多态性能否成为判断HD-MTX不良反应的可靠预测因子,仍需要大量临床研究,旨在最大限度降低患者用药后的个体差异,使不良反应的发生风险维持在可接受的水平,同时产生最大药效。
1 Koppen IJ,Hermans FJ,K aspers GJ.Folate related gene polymorphisms and susceptibility to develop childhood acute lymphoblastic leukaemia[J].Br J Haematol,2010,148(1):3-14.
2 Johnston WT,Lightfoot TJ,Simpson J,et al.Childhood cancer survival:A report from the United Kingdom Childhood Cancer Study[J].Cancer Epidemiol,2010,34(6):659-666.
3 Yang TY,Zhang ZN,Shen T.Standard of the blood disease diagnosis and therapeutical effect[M].Version 2,Beijing:Sciences Press,1998:168-214.[杨天楹,张之南,沈 悌.主编.血液病诊断及疗效标准[M].第 2版,北京:科学出版社,1998:168-214.]
4 Zhang HH,Yue LJ,Yuan XL,et al.A novel missense mutation(T191G)identified in γ-glutamyl hydrolase gene[J].Chin J Clin Oncol,2012,39(4):185-188.[张洪洪,岳丽杰,袁秀丽,等.GGH基因多态性研究及一个新的错义突变T191G的发现[J].中国肿瘤临床,2012,39(4):185-188.]
5 Ding H,Yue LJ,Yu J,et al.Correlations of single nucleotide polymorphisms of C1420T and 3 loci located in 3'-untranslated region of serine hydroxymethyltransferase 1 gene with susceptibility to pediatric acute leukemia[J].Chin J Clin Lab Sci,2013,31(10):778-781[.丁 慧,岳丽杰,于 洁,等.丝氨酸羟甲基转移酶1基因C1420T位点和3'非翻译区3个位点单核苷酸多态性与儿童急性白血病易感性的关系[J].临床检验杂志,2013,31(10):778-781.]
6 Salliot C,van der Heijde D.Long-term safety of methotrexate monotherapy in patients with rheumatoid arthritis:a systematic literature research[J].Ann Rheum Dis,2009,68(7):1100-1104.
7 Yen-Revollo JL,Van Booven DJ,Peters EJ,et al.Influence of ethnicity on pharmacogenetic variation in the Ghanaian population[J].-Pharmacogenomics J,2009,9(6):373-379.
8 Huang L,Tissing WJ,de Jonge R,et al.Polymorphisms in fo late-related genes:association with side effects of high-dose methotrexate in childhood acute lymphoblastic leukemia[J].Leukemia,2008,22(9):1798-1800.
9 Owen SA,Hider SL,Martin P,et al.Genetic polymorphisms in key methotrexate pathway genes are associated with response to treatment in rheumatoid arthritis Patients[J].Pharmacogenomics J,2013,13(3):227-734.
10 Stamp LK,Chapman PT,O'Donnell JL,et al.Polymorphisms within the folate pathway predict folate concentrations but are not associated with disease activity in rheumatoid arthritis patients on methotrexate[J].Pharmacogenet Genomics,2010,20(6):367-376.
12 Lautner-Csorba O,A,DJ,et al.Roles of genetic polymorphisms in the folate pathway in childhood acutelymphoblastic leukemia evaluated by Bayesian relevance and effectanalysis[J].PLoS One,2013,8(8):e69843.
13 Kodidela S,Suresh Chandra P,Dubashi B.Pharmacogenetics of methotrexate in acute lymphoblastic leukaemia:why still at the bench level[J]Eur J Clin Pharmacol,2013,[Epub ahead of print].
14 Yang CL,Yue LJ,Yu J,et al.Correlation between the polymorphism of thymidylate synthase gene and the toxicity of high dose MTX in childhood acute lymphoblastic leukemia[J].Chin J Clin Oncol,2013,40(7):384-388.[杨春兰,岳丽杰,于洁,等.胸苷酸合成酶基因多态性与ALL儿童HD-MTX不良反应的相关性[J].中国肿瘤临床,2013,40(7):384-388.]
15 Zheng MM,Yue LJ,Chen XW,et al.Relationship between themethylenetetrahydrofolate reductase gene polymorphism and adverse reactions of high-dose methotrexate in children with acute lymphocytic leukemia[J].Chin J Contemp Pediatr,2013,15(3):201-206.[郑苗苗,岳丽杰,陈小文,等.急性淋巴细胞白血病患儿MTHFR基因多态性与大剂量甲氨蝶呤不良反应的关系[J].中国当代儿科杂志,2013,15(3):201-206.]

