替吉奥或奥沙利铂联合紫杉醇脂质体治疗进展期胃癌的临床分析
马晴晴 曲颜丽 唐 勇
胃癌是我国发病率最高的癌症之一,大多数患者确诊时已是晚期,治疗主要以化疗为主。目前国际上缺乏针对晚期胃癌的标准化疗方案,基于此点,本研究回顾性分析了118例进展期胃癌患者的临床资料,观察并总结了替吉奥或者奥沙利铂联合紫杉醇脂质体一线治疗进展期胃癌的疗效与不良反应,以期为晚期胃癌化疗提供新的依据。
1 材料与方法
1.1 材料
1.1.1 临床资料 纳入118例研究对象为2011年5月至2013年2月新疆医科大学附属肿瘤医院收治的进展期及术后复发的胃癌患者,均经病理组织学确诊,随机分为A组(紫杉醇脂质体+替吉奥组)和B组(紫杉醇脂质体+奥沙利铂组)。A组:男性41例,女性20例;年龄31~76岁,中位年龄49岁;胃体癌22例,胃窦癌15例,胃底贲门及结合部癌24例;高分化腺癌3例,中低分化腺癌54例,印戒细胞癌4例;ⅢC期13例,Ⅳ期48例;根治术后复发16例,行剖腹探查及姑息手术6例,初次诊断为晚期失去手术机会39例。B组:男性39例,女性18例;年龄27~78岁,中位年龄47岁;胃体癌20例,胃窦癌13例,胃底贲门及结合部癌24例;高分化腺癌3例,中低分化腺癌49例,印戒细胞癌5例;ⅢC期11例,Ⅳ期46例;根治术后复发18例,行剖腹探查及姑息手术4例,初次诊断即为晚期失去手术机会35例。
全组入选患者化疗前血常规、生化、凝血、心电图等均基本正常,Karnofsky评分均≥60分,行胸部、腹部、盆腔CT增强扫描记录病灶基线水平。全部患者接受化疗2~9个周期,其性别、年龄、Karnofsky评分、原发灶部位、病理类型、分化程度以及TNM分期等临床资料经统计学分析,差异无统计学意义(P>0.05),资料具有可比性。
1.1.2 评价标准 每2个化疗周期按实体肿瘤疗效评价标准(RECIST 1.1)判定两组的近期疗效,观察指标:客观有效率(ORR)=完全缓解(CR)率+部分缓解(PR)率,疾病控制率(DCR)=客观有效率(ORR)+病变稳定(SD)率,疾病进展时间(TTP),生存期(OS);疾病进展时间指从接受治疗开始至第1次记录疾病进展的时间,生存期指从接受治疗开始至死亡或随访截止时间。观察比较两类方案的不良反应,根据WHO抗癌药物急性及亚急性毒性反应分度标准分为0~Ⅳ度。
1.2 治疗方法
A组:紫杉醇脂质体135 mg/m2,d1,8,静脉滴注,替吉奥胶囊80 mg/(m2·d),分2次口服,d1~d14;B组紫杉醇脂质体135 mg/m2,d1,8,静脉滴注,奥沙利铂130 mg/m2,d1,静脉滴注。化疗前常规使用5-HT3受体抑制剂止吐治疗,紫杉醇脂质体使用前30 min进行以下预处理:静脉注射地塞米松5 mg、肌肉注射苯海拉明40 mg、静脉注射西米替丁100 mg。化疗前后检查血常规、肝肾功能等,如出现异常,予相应处理。以上两种方案均21天为1个周期,至少完成2个周期。
1.3 随访及统计学方法
采用电话随访或门诊随访,末次随访时间为2013年7月31日。生存期(OS)为患者确诊时间至死亡或最后随访的时问,失访患者生存期计算至末次随访日。采用SPSS 17.0统计软件,组间比较采用χ2检验,Kaplan-Meier法进行生存分析,Log-rank公式检验,P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效
118例患者均可评价疗效。两组均无CR患者。A组61例患者中PR 19例,SD 27例,PD 15例;B组57例中PR 17例,SD 24例,PD 16例;两组的客观有效率ORR分别为31.1%、29.8%(P=0.876),疾病控制率DCR分别为75.4%、71.9%(P=0.668)。两组结果比较差异无统计学意义,近期疗效相似。
2.2 疾病进展时间及生存期
A 组中位疾病进展时间(mTTP)为 4.2(1.5~16.7)个月,95%CI 4.2~5.7个月;B组mTTP为3.8(1.03~8.63)个月,95%CI 3.6~4.5个月。经Log-rank检验,差异无统计学意义(P=0.230)。
A组中位生存时间(mOS)为10.5(3.67~17.3)个月,B组为8.9(4.2~13.9)个月,A组95%CI为9.9~11.4个月,B组为7.9~9.1个月。经Long-rank检验,差异有统计学意义(P=0.006,图1)。
2.3 不良反应
两组化疗不良反应主要以Ⅰ~Ⅱ度骨髓及消化道毒性为主。B组Ⅲ~Ⅳ度腹泻及外周神经毒性较A组严重(P<0.05),其他不良反应在两组间未见明显差异(表1)。
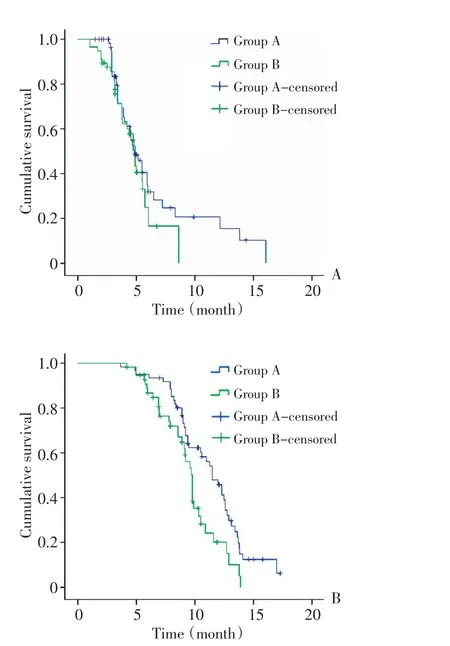
图1 118例进展期胃癌患者的TTP和OS曲线Figure1 Median time to progression(A)and overall survival(B)curves of 118 patients with advanced gastric cancer

表1 118例进展期胃癌患者化疗后不良反应 例(%)Table1 Adverse reactions of 118 advanced gastric cancer patients treated with different chemotherapeutic regimens (n%)
3 讨论
胃癌是危害人类健康的主要恶性肿瘤之一,晚期胃癌虽然是不可治愈的,但在消化道肿瘤中对化疗比较敏感,与最佳支持治疗(BSC)相比,规范化疗确实可以缓解患者临床症状,延长生存期,从而起到姑息性治疗的作用,因此化疗已成为晚期胃癌综合治疗中必不可少的重要组成部分。晚期治疗主要是化疗和靶向治疗。其化疗有单药、两药联合、三药联合等方式,临床中较为广泛应用的是两药联合[1]。
紫杉醇是一种G/M期特异性的化疗药物,由于其在水中及许多药用溶剂中的溶解性较低,需用聚氧乙烯蓖麻油和乙醇作溶剂。聚氧乙烯蓖麻油是一种表面活性剂,容易引起严重的过敏反应,因此患者用药前须接受皮质激素和抗组胺类药物预处理,即便如此仍有超过2%的严重过敏反应发生。近年来紫杉醇已被开发为脂质体制剂,大幅降低了紫杉醇溶剂聚氧乙烯蓖麻油引起过敏风险[2]。Xu等[3]对比研究了紫杉醇脂质体及紫杉醇治疗晚期胃癌的疗效及不良反应,发现两药的疾病控制率无明显差异,但脂质体化疗后恶心呕吐、过敏反应等发生明显较少,值得在晚期胃癌治疗中推广应用。替吉奥胶囊是替加氟、吉美嘧啶和奥替拉西钾的复方制剂[4],按1∶0.4∶1(摩尔比值)组成,替加氟是5-FU的前体药物,在肝脏经细胞色素P450系统作用生成5-FU,具有优良的口服生物利用度,半衰期长达12 h;吉美嘧啶是二氢嘧啶脱氢酶的强效抑制剂,能够阻止5-FU的降解;奥替拉西钾能够特异性抑制肠道黏膜细胞内乳清酸核糖转移酶,阻断5-FU的磷酸化,减轻其引起的消化道毒性。S-1代谢后能延长血液和肿瘤组织中5-FU的药效时间,其半衰期为(13.1±3.1)h,平均滞留时间为(13.2±1.7)h,从而取得了与5-FU持续静脉输注类似的疗效。在日本该药已用于治疗晚期胃肠道恶性肿瘤。Kunisaki等[5]一项替吉奥联合多西他赛作为晚期胃癌一线治疗的研究显示,mPFS及mOS分别延长至8.0个月和17.3个月,生存获益良好。一项关于晚期胃癌的替吉奥、多烯紫杉醇和顺铂三药联合的研究[6]提示ORR 75%、DCR 83.9%,患者的PFS和OS分别延长至6.5个月和15.5个月。S-1无论单药还是联合治疗进展期胃癌,均显示了良好的抗肿瘤活性[7-8]。奥沙利铂是第三代铂类化疗药物,以DNA为作用靶点,铂原子与DNA形成链内交联、链间交联及蛋白质交联,进而损伤DNA。由于奥沙利铂化学结构与顺铂不同,较顺铂有更广谱的抗癌活性,且肾毒性及消化道反应明显减轻,使得铂类药物可以应用于体质较弱的晚期胃癌及老年患者[9-11],其突出的剂量限制性毒性为外周神经毒性,累计量达800 mg/m2时出现功能障碍者达10%~15%,在停药后12~13周逐渐恢复,呈可逆性。
国内外针对5-FU类联合紫杉醇及铂类三药治疗晚期胃癌的疗效肯定,但其发生Ⅲ~Ⅳ度化疗毒性率明显较两药联合增加[12-13],这限制了该方案在大多数晚期胃癌或老年患者中的应用。近年来多个针对紫杉类联合替吉奥或者奥沙利铂的临床研究显示这两种化疗方案较三药联合疗效相当,且不良反应降低[14-15]。
基于这些研究成果,本研究对比了紫杉醇脂质体联合替吉奥或者奥沙利铂治疗进展期胃癌的疗效及不良反应,发现两种方案均有较好的近期和远期疗效,两者的近期疗效及疾病进展时间无显著性差异,紫杉醇脂质体联合替吉奥方案的中位生存期较联合奥沙利铂明显;两者的骨髓及主要消化道毒性无显著性差异,但紫杉醇脂质体联合奥沙利铂组的Ⅲ~Ⅳ度腹泻及外周神经毒性较联合替吉奥明显。本研究入组均为进展期胃癌患者,且两组大部分患者均存在一个或多个远处器官转移,入组时一般情况较差,观察时间较短,mOS值及mTTP时间略短,但本研究保证了两组临床资料的可比性,进而消除了一些组间混杂因素的干扰,数据较为可靠。由于该研究观察时间较短,本课题组将开展进一步研究,扩大病例数,对患者1、3、5年生存率进行观察,为改善进展期胃癌患者的疗效提供依据。
1 BA Y.Development of adjuvant treatment of gastric cancer[J].Chin J Clin Oncol,2013,40(15):879-882.[巴一.胃癌辅助治疗现状和进展[J].中国肿瘤临床,2013,40(15):879-882.]
2 Zhang L,Li YH,Wang CX,et al.Preparation of liposomal paclitaxel and its toxicity and antitumor effect[J].Chin Pharm J,2013,48(6):446-449[.张 兰,李彦辉,王彩霞,等.紫杉醇脂质体的制备及初步毒性、药效学研究[J].中国药学杂志,2013,48(6):446-449.]
3 Xu X,Wang L,Xu HQ,et al.Clinical comparison between paclitaxel liposome(Lipusu®)and paclitaxel for treatment of patients with metastaticgastric cancer[J].Asian Pac J Cancer Prev,2013,14(1):2591-2594.
4 Shirasaka T,Nakano K,Takechi T,et al.A Antitumor activity of 1 M tegafur-0.4 M 5-chloro-2,4-dihydroxypyridine-1 M potassium oxonate(S-1)against human colon carcinoma orthotopically implanted into nude rats[J].Cancer Res,1996,56(11):2602-2606.
5 Kunisaki C,Takahashi M,Ono HA,et al.Biweekly Docetaxel and S-1 combination chemotherapy as first-line treatment for elderly patients with advancedgastric cancer[J].Anticancer Res,2013,33(2):697-704.
6 Luo H,Yu Z,Gao H,et al.Efficacy and tolerability of docetaxel and cisplatin plus S-1 for advanced gastric cancer[J].J BUON,2013,18(1):154-161.
7 Koizumi W,Narahara H,Hara T,et al.S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial):a phaseⅢtrial[J].Lancet Oncol,2008,9(3):215-221.
8 Zhang XL,Jia WL.Clinical study of S1 capsule in the treatment of elderly patients with advanced gastric[J].J Modern Oncol,2011,19(6):1189-1190[.张星霖,贾伟丽.替吉奥胶囊治疗老年晚期胃癌的临床观察[J].现代肿瘤医学,2011,19(6):1189-1190.]
9 Chen Y,Zuo J,Liu Y,et al.Inhibitory effects of miRNA-200c on chemotherapy-resistance and cell proliferation of gastric cancerSGC7901/DDP cells[J].Chin J Cancer,2010,29(12):1006-1011.
10 Xu L,Qu XJ,Liu YP,et al.Cisplatin enhances TRAIL-induced apoptosis in gastric cancer cells through clustering death receptor 4 into lipid rafts[J].Chin J Oncol,2011,33(7):484-488[.徐 玲,曲秀娟,刘云鹏,等.顺铂通过促进死亡受体4在脂筏内聚集增强肿瘤坏死因子相关凋亡诱导配体对胃癌MGC803细胞凋亡的作用[J].中华肿瘤杂志,2011,33(7):484-488.]
11 Pan ZH,Su A,Wang X,et al.Clinical Observation of oxaliplatin plus capecitabine with subsequent capecitabine maintenance chemotherapy for patients with advanced gastric cancer[J].Chin J Clin Oncol,2012,39(20):1552-1555.[潘战和,苏安,王馨,等.草酸铂联合卡培他滨一线化疗后卡培他滨维持治疗晚期胃癌[J].中国肿瘤临床,2012,39(20):1552-1555.]
12 Li JH,Li B,Jiang HR,et al.Weekly regimen of paclitaxel liposome combined with cisplatin and 5-fluorouracil continuous infusion in the treatment of advanced gastric carcinoma[J].Chin J Oncol,2011,33(3):229-231.[李建璜,李斌,蒋海荣,等.紫杉醇脂质体联合顺铂及5-氟尿嘧啶治疗晚期胃癌的临床观察[J].中华肿瘤杂志,2011,33(3):229-231.]
13 Lin RB,Fan NF,Guo ZQ,et al.A phaseⅡstudy of 5-fluorouracil/leucovorin in combination with paclitaxel and oxaliplatin as first-line treatment forpatients with advanced gastric cancer[J].J Chemother,2008,6(5):744-748.
14 Chang ZG,Xu QX.Paclitaxel combinde with oxaliplatin in the treatment of elderly patients with advanced gastric cancer[J].J Modern Oncol,2012,20(8):1669-1671.[常占国,徐全晓.紫杉醇联合奥沙利铂治疗老年晚期胃癌[J].现代肿瘤医学,2012,20(8):1669-1671.]
15 Fushida S,Kinoshita J,Kaji M,et al.PhaseⅠ/Ⅱ study of intraperitoneal docetaxel plus S-1 for the gastric cancer patients with peritoneal carcinomatosis[J].Cancer Chemother Pharmacol,2013,71(5):1265-1272.

