KAI1/CD82和Gli1在胃腺癌组织中的表达及其临床意义
齐 琦 武世伍 承泽农 郭 飞
(1蚌埠医学院组织胚胎学教研室233030;2蚌埠医学院病理学教研室,蚌埠医学院第一附属医院病理科233000;3蚌埠医学院第一附属医院影像科233000)
KAI1/CD82基因是1995年发现的肿瘤转移抑制基因[1],属于4次跨膜超家族(transmembrane 4 superfamily,TM4SF)成员,它通过改变细胞与细胞外基质的黏附力及细胞间相互作用,抑制肿瘤细胞脱离原发灶,从而起到抑制肿瘤转移的作用[2,3],广泛表达于多种组织。胶质瘤相关癌基因蛋白-1(Gli1)是Hh信号转导通路中的一个重要的核转录因子,在多种肿瘤组织中高表达,对肿瘤的恶性增殖、侵袭和转移起重要作用。本研究通过检测96例GAC组织标本中KAI1/CD82和Gli1蛋白的表达,旨在探讨其表达与胃腺癌(gastric adenocarcinoma,GAC)的临床病理特征的关系,希望能够找到早期预测GAC患者浸润与转移的指标。
材料和方法
1.材料与方法
1.1 一般资料 收集2007年1月~2009年7月蚌埠医学院第一附属医院病理科存档GAC组织石蜡包埋标本96例(患者术前均未行放、化疗和其它抗肿瘤治疗)和癌旁胃组织20例,所有病例均有完整的临床和病理资料。其中男性69例,女性27例;年龄28~83岁,中位年龄61.3岁,选取的胃癌组织包括高分化腺癌18例,中分化腺癌45例和低分化腺癌33例;其中有淋巴结转移病例50例,无淋巴结转移病例46例。根据2002国际抗癌联盟(UICC)制定的TNM 标准进行分期,其中Ⅰ期4例,Ⅱ期60例,Ⅲ期30例,Ⅳ期2例。对照组20例选取距离肿瘤组织>5cm,且经病理HE染色证实为正常胃黏膜组织。
1.2 试剂 鼠抗人KAI1/CD82单克隆抗体,兔抗人Gli1多克隆抗体均购自美国SantaCruz,ElivisionTMplus试剂盒及DAB显色试剂盒均购于福州迈新生物技术开发公司。
1.3 实验方法采用免疫组化ElivisionTMplus法将石蜡标本经4?倕m厚连续切片,烤干,脱蜡,水洗。免疫组化步骤根据试剂盒说明书进行操作。采用已知阳性片作对照,以PBS液代替一抗作空白对照。
1.4 免疫组织化学结果判定KAI1/CD82蛋白主要分布在细胞膜和浆中,Gli1蛋白主要分布在细胞核和浆中,均以出现黄色或棕黄色颗粒为阳性。染色结果的评分,按每张切片的阳性细胞数百分率及着色深浅。根据阳性细胞百分率判定:每张切片随机选取10个高倍镜视野(×400),分别计数100个细胞,阳性细胞百分比计分,<10%为0分;10%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。根据染色强度:无色为0分,淡黄色1分,黄色为2分,棕褐色3分。两项得分相乘,并取10个高倍视野的平均值为最终评分:阴性(0~1)、弱阳性(2~4)、阳性(5~8)、强阳性(>9),大于2分视为阳性结果[4]。2位病理医生采用独立双盲法来判定免疫组织化学结果。
1.5 统计学分析 采用χ2和Spearman等级相关检验。
结 果
2.1 KAI1/CD82蛋白在GAC组织中的表达及其与临床病理的关系 KAI1/CD82蛋白阳性颗粒呈棕黄(褐)色,在正常胃黏膜组织中,主要位于胞膜和胞浆(图1:A);在GAC组织中,主要表达于GAC细胞膜,胞浆中也有一定的表达(图1:B,C,D)。KAI1/CD82蛋白的表达与患者的性别、年龄、肿瘤的位置和大小无相关性(P>0.05)。在GAC病例组中,KAI1/CD82蛋白的阳性率为38.5%(37/96),比正常对照胃组织的表达率90%(18/20)明显减少(P<0.01)(表1)。Ⅰ~Ⅱ期病例组 KAI1/CD82虽然高表达,但较正常对照组表达水平下降,阳性表达率51.6%,Ⅲ~Ⅳ期病例组KAI1/CD82表达水平进一步下调,其阳性表达率为12.5%,两者之间差异具有统计学意义(P<0.001);在GAC高分化组、中等分化组以及低分化组中KAI1/CD82的阳性表达率分别为88.9%,35.6%和15.2%,呈现明显的递减趋势,差异有统计学意义(P<0.001);GAC中浸润至浆膜较浸润至肌层及以上KAI1/CD82的阳性表达明显减低(P<0.01);KAI1/CD82蛋白的阳性表达与淋巴结的转移也有关(P<0.005)(表2)。
2.2 Gli1在GAC组织中的表达及其与临床病理的关系 Gli1蛋白阳性颗粒主要位于细胞核和细胞浆中,呈黄色或棕黄色。本对照组未见Gli1蛋白表达(图1:E),在GAC组织中Gli1蛋白的阳性率为68.8%(66/96)(图1:F,G,H)。Gli1蛋白的表达与患者的性别、年龄、肿瘤的位置和大小无相关性(P>0.05),但随着分化越差、浸润越深、临床分期越晚及淋巴结发生转移,蛋白的阳性表达率越高(表2)。
2.3 KAI1/CD82及Gli1在GAC组织中表达的相关性分析
Spearman等级相关性分析显示,KAI1/CD82和Gli1的表达呈负相关 (rs=0.343,P<0.005)。

表1 KAI1/CD8和GLI1在GAC组织和正常胃组织中的表达Table 1 Expression of KAI1/CD82 and Gli1 in GAC tissues and normal gastric tissues
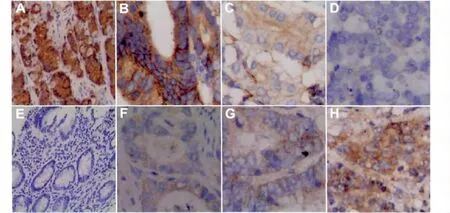
图1 KAI1/CD82和Gli1在GAC中的阳性染色以及对照组中的染色。A:对照组中KAI1/CD82表达阳性(Elivision TM×100);B、C、D:胃腺癌组织中 KAI1/CD82表达(B为高分化腺癌,C为中分化腺癌,D为低分化腺癌;Elivision TM×400);E:对照组中Gli1表达阴性(Elivision TM×100);F、G、H:胃腺癌组织中Gli1表达(F为高分化腺癌,G为中分化腺癌,H为低分化腺癌;Elivision TM×400)Fig1:Positive staining of KAI1/CD82 and Gli1 in GAC tissues and staining in the control group.A:Positive staining of KAI1/CD82 in the control group(A is normal gastric tissues,Elivision TM×100);B、C、D:Positive staining of KAI1/CD82 in GAC tissues(B is well differentiation andenocarcinoma,C is mediate differentiation andenocarcinoma,D is poor differentiation andenocarcinoma,Elivision TM×400);E:Negative staining of Gli1 in the control group(E is normal gastric tissues,Elivision TM×100);F、G、H:Positive staining of Gli1 in GAC tissues(F is well differentiation andenocarcinoma,G is mediate differentiation andenocarcinoma,H is poor differentiation andenocarcinoma,Elivision TM×400)
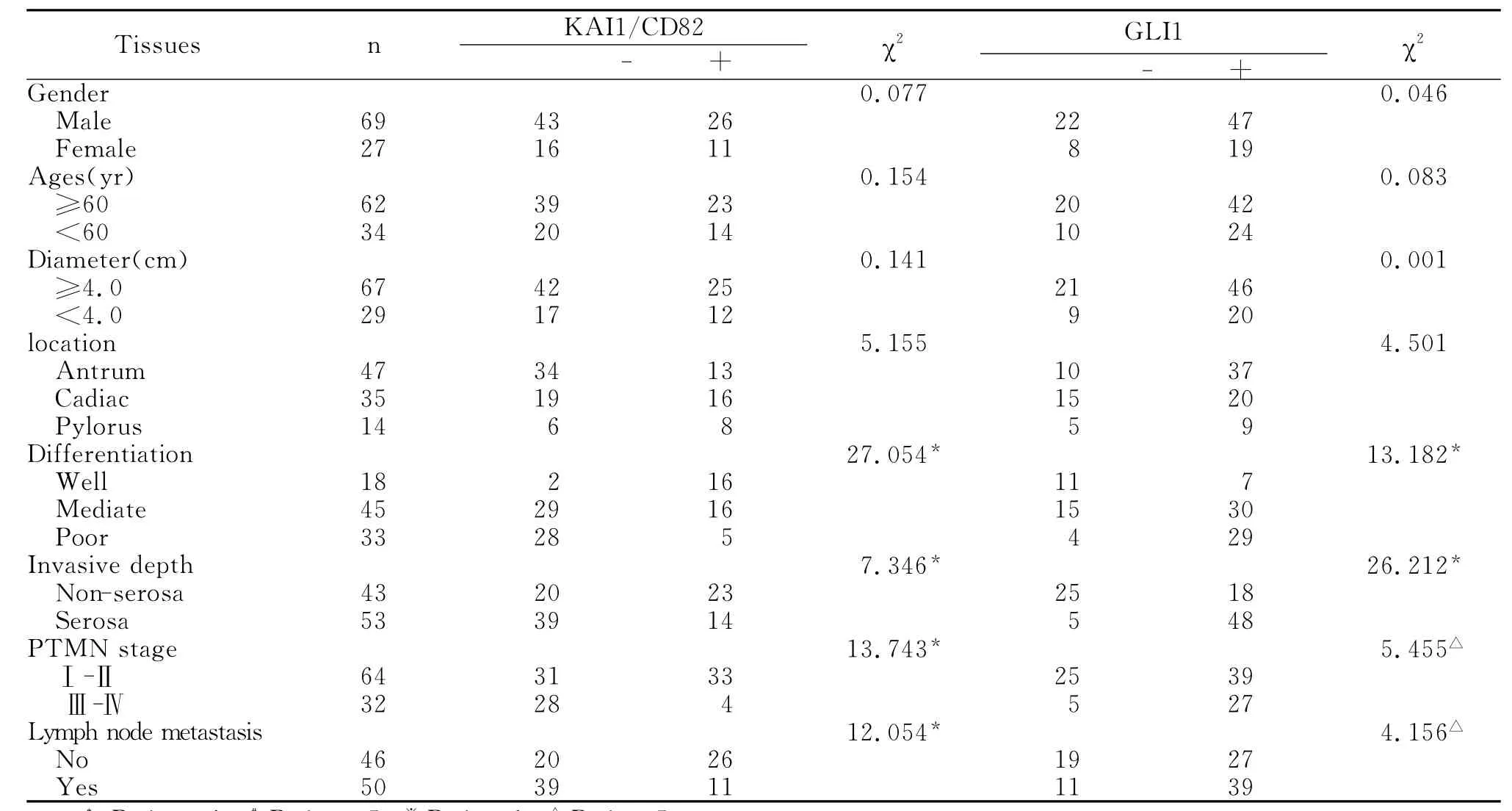
表2 GAC组织中KAI1/CD8和GLI1的表达与临床病理因素的关系Table 2 Correlation of KAI1/CD8 and GLI1 expression to clinicopathologic characteristics in gastric andenocarcinoma tissues

表3 GAC组织中KAI1/CD8和GLI1的关系Table 3 Relationship of KAI1/CD8 and GLI1 expression in gastric andenocarcinoma tissues
讨 论
肿瘤的浸润与转移是一个多步骤的复杂过程,有多种基因参与,其中许多肿瘤抑制基因也参与了调控。GAC的发生、发展,也是众多因子相互协调并共同作用的结果。随着组织芯片技术以及蛋白质组学的发展,越来越多的肿瘤相关基因被发现,他们可能促进或抑制肿瘤生长,促进或抑制癌细胞的扩散和转移,因此,寻找能够预测GAC发生发展的分子生物学标志物,对GAC的早期正确诊断、治疗以及预后评估具有重要意义。
KAI1/CD82是新近发现的一个肿瘤转移抑制基因,它是Dong等[5]在研究前列腺癌时发现的,最初被认为是前列腺癌特异性的转移抑制基因。后来相继发现并报道在肺癌、胰腺癌、乳腺癌、大肠癌等多种恶性肿瘤中出现KAI1/CD82表达水平的下调或缺失。本研究采用免疫组织化学方法检测KAI1/CD82蛋白在GAC组织及正常胃组织中的表达,发现KAI1/CD82蛋白在正常胃黏膜组织中高表达,在Ⅰ~Ⅱ期GAC组织中其表达水平出现下调,并且随着肿瘤的分化越差、临床分期越高、浸润加深,其阳性表达率也越低,差异有统计学意义(P<0.05);在发生淋巴结转移的GAC组织中其阳性表达率也明显降低,这与国内外学者[6-8]研究的结果相一致。这均提示KAI1/CD82基因缺失或表达异常降低与胃癌的发生、发展、侵袭以及转移密切相关。肿瘤组织中KAI1/CD82基因表达缺失或下调使KAI1/CD82基因的正常功能减弱或消失,失去了抑制肿瘤侵袭与转移的功能。
Gli1是Hedgehog信号转导通路的下游转录调控因子之一,有研究表明人类多种肿瘤的发生发展以及转移与 Hh信号通路异常激活密切相关[9-11]。近年来有研究发现Hedgehog信号通路与肿瘤的血管形成有关,而血管的生成为促进肿瘤的侵袭和转移提供了必需的途径。本研究结果显示,Gli1蛋白在GAC组织中的表达水平比在正常组织中明显升高,差异有统计学意义;肿瘤分化越差、临床分期越晚、浸润越深,其表达水平也越高,其差异有统计学意义,并且在伴随淋巴结转移的肿瘤中其表达较未发生淋巴结转移的肿瘤高,差异有统计学意义,与文献报道[12,13]一致。本研究结果提示Gli1在肿瘤组织中呈现的高表达状态,在GAC的发展、侵袭及转移中起到重要作用。
Spearman相关分析显示在GAC组织中,KAI1/CD82蛋白的表达与Gli1蛋白的表达呈显著的负相关性。当肿瘤组织生长到1mm3时,就会诱导新生血管形成,否则就会停止生长,而Gli1基因表达增高时会增强肿瘤细胞诱导的新生血管形成能力,这些新生血管的内皮细胞不完整或有缺陷;而此时KAI1/CD82基因表达降低或缺失会导致肿瘤细胞彼此之间的黏附力降低,在血流的冲击下,很容易离开原发肿瘤并穿过不完整的内皮细胞,最终导致淋巴结转移甚至远处转移[14]。
综上所述,通过在GAC组织中检测KAI1/CD82和Gli1蛋白的表达,发现Gli1蛋白高表达和KAI1/CD82蛋白表达降低或缺失时,GAC的肿瘤细胞更易发生侵袭及转移。因此,可以通过早期联合检测KAI1/CD82和Gli1蛋白的表达,作为评估GAC患者肿瘤侵袭和淋巴结转移的指标。
[1]Jackson P,Marreiros A,Russell PJ.KAI1 tetraspanin and metastasis suppressor.Int J Biochem Cell Biol,2005,37(3):530-534
[2]Knoener M,Krech T,Puls F,et al.Limited value of KAI1/CD82 protein expression as a prognostic marker in human gastric cancer.Dis Markers,2012,32(6):337-342
[3]Wei X,Liu S,Wang X,et al.CD82 expression alters with human endometrial cycles and affects the uterine endometrial receptivity in vitro.ExpBiol Med (Maywood),2012,237(3):254-262
[4]冯亚光,魏正强,曾绍兵等.Gli1和Foxm1在胃癌中的表达及其临床意义.中国肿瘤临床,2012,39(7):377-381
[5]Dong JT,Lamb PW,Rinker-Schaeffer CW,et al.KAI1/CD82,a metastasis suppressor gene for prostate cancer on human Chromosome11p11.2.Science,1995,268(5212):884-886
[6]Hinoda Y,Adachi Y,Takaoka A,et al.Decreased expression of the metastasis suppressor gene KAI1 in gastric cancer.Cancer Lett,1998,129(2):229-234
[7]Zheng HC,Wang MC,Li JY,et al.Expression of maspin and kai1 and their clinicopathological significancein carcinogenesis and progression of gastric cancer.Chin Med Sci J,2004,19(3):193-198
[8]Zheng HC,Tsuneyama K,Cheng C,et al.Expression of KAI1 and tenascin,and microvessel density are closely correlated with liver metastasis of gastrointestinal adenocarcinoma.J Clin Pathol,2007,60(1):50-56
[9]Ruizi Altaba A,Sánchez P,Dahmane N.Gli and hedgehog in cancer:tumours,embryos and stem cells.Nat RevCancer,2002,2(5):361-372
[10]Theunissen JW,de Sauvage FJ.Paracrine Hedgehog Signaling in cancer.Cancer Res,2009,69(15):6007-6010
[11]Lum L and Beachy PA.The Hedgehog Response Network:Sensors,Switches,and Routers.Science,2004,304(5678):1755-1759
[12]Yanai K,Nagai S,Wada J,et al.Hedgehog signaling pathway is a possible therapeutic target for gastric cancer.J Surg Oncol,2007,95(1):55-62
[13]Kim JH,Shin HS,Lee SH,et al.Contrasting activity of Hedgehog and Wnt pathways according to gastric cancer cell differentiation:relevance of crosstalk mechanisms.Cancer Sci,2010,101(2):328-335
[14]武世伍,承泽农,俞岚等.CD82/KAI1和 HIF-1α在非小细胞肺癌中的表达及其与血管生成拟态的关系.中国肺癌杂志,2011,14(12):918-925

