ROCK特异性抑制剂Y27632对缺氧后少突胶质前体细胞分化的影响
李彩红 江 霞 喻志源 陈 雪 王 伟 骆 翔
(华中科技大学同济医学院附属同济医院神经内科,武汉430030)
少突胶质前体细胞(Oligodendrocyte precursor cells,OPCs,)是上世纪80年代初发现的神经胶质细胞[1],在成年CNS中占据所有胶质细胞数目的5%-8%左右。其在机体生理及病理上发挥多重作用,生理状态下可分化为神经元、少突胶质细胞、星形胶质细胞等不同的细胞系;参与形成髓鞘;与神经元通过突触发生密切联系[2-5]。病理状态下能够参与形成胶质瘢痕;调控少突胶质细胞应答神经纤维损伤,促进髓鞘再生;影响轴突生长;抑制轴突传导[6-9]等。Rho/ROCK通路被称为肌动蛋白细胞骨架的调节器,也是细胞形态异质性的调节器[10]。目前越来越多的证据表明,Rho/ROCK在神经系统疾病的发生发展中具有重要作用,如树突棘的形态发生、生长锥的形态、轴突的生长和导向延伸、肌球蛋白收缩、突触的数量和塑形、细胞的增殖和分化等[11]。ROCK在缺氧诱导的少突胶质前体细胞分化中的作用尚不清楚,本研究应用ROCK特异性抑制剂Y27632,观察Y27632特异性抑制ROCK对OGD损伤后少突胶质前体细胞分化的影响,探索ROCK通路在少突胶质前体细胞分化中的作用。
材料和方法
1.主要试剂及仪器
多聚赖氨酸、胰蛋白酶、DAPI购自美国sigma公司;胎牛血清、N2 supplement(100×)、B27 supplement(50×)购自美国 GIBCO公司;DMEM/F12培养基、DMEM/HIGH GLUCOSE培养基购自美国Hyclone公司;Rat-FGF-Basic、Human PDGF-AA、Rat-CNTF购自Peorotech公司;T3购自Invitrogen公司;Triton-X100购自武汉博士德生物工程有限公司;小鼠抗大鼠O4抗体、兔抗大鼠NG2抗体、兔抗大鼠MBP抗体、小鼠抗大鼠A2B5抗体购自美国Millipore公司,兔抗ROCK2多克隆抗体购自美国Santa Cruz公司;CY3标记羊抗兔IgG、FITC标记的羊抗小鼠IgG购自美国Jackson公司;180℃高温干烤箱;高压蒸汽灭菌器超净工作台;涡旋振荡器;电子移液枪台式低温离心机;CO2恒温培养箱;37℃恒温摇床;正、倒置荧光显微镜;实验动物为SPF级出生3 d内SD大鼠乳鼠,由华中科技大学同济医学院动物中心提供。
2.大鼠少突胶质前体细胞(OPCs)培养及诱导分化
根据文献介绍振摇并差速贴壁法分离纯化培养OPCs[12]。取3 d内新生的SD大鼠乳鼠的全脑,剔除脑膜,经过消化、过滤、离心步骤后,细胞接种到用多聚赖氨酸包被的培养瓶中。在37℃5%CO2培养箱培养10 d左右,原代混合胶质细胞长满。封闭培养瓶,置于37℃恒温摇床180 rpm预摇1 h,弃上清,以去除小胶质细胞。继续37℃恒温摇床振摇180 rpm,过夜(约18 h),将OPCs从混合胶质细胞中摇下,通过差速贴壁法去除小胶质细胞和星形胶质细胞,离心后重悬,获得纯化的OPCs。细胞接种于铺有盖玻片(多聚赖氨酸预包被)的24孔板(用于免疫组化),或直径60 mm培养皿(用于 Western blot检测)中;OPCs接种后隔天换液(OPCs培养基:DMEM/F12,含 1×N2,1×B27,10 ng/ml PDGF-AA,10 ng/ml FGF-Basic),接种后3 d干预(换液为分化培养基:DMEM/F12,含1×N2,1×B27,10 ng/ml CNTF,30 ng/ml T3)。
3.细胞OGD干预及分组
细胞接种后3 d,将细胞分为对照组、对照+Y27632组、OGD组、OGD+Y27632组四组;OGD干预前各加药组更换含10μmol/l Y27632培养基孵育1h(Y27632浓度参照[13]);弃培养基,PBS清洗,OGD组更换为DMEM培养基(无糖无血清),OGD+Y27632组更换为含10μmol/l Y27632DMEM培养基,置于37℃5%CO2,1%O2缺氧培养箱中孵育2 h,对照组和对照+Y27632组置于正常培养箱;OGD结束后各组细胞用PBS清洗后换回OGD前培养基,取OGD2h后再灌4 d细胞观察。
4.细胞免疫荧光化学染色
取待固定细胞爬片PBS漂洗5 min,3次;用4℃冰箱预冷的4%多聚甲醛室温固定30 min;倾去固定液,PBS漂洗5 min,3次;0.2%Triton/PBS液室温透膜15 min;PBS漂洗5 min,3次;加封闭液(10%BSA-PBS),室温封闭60 min;加预先用抗体稀释液(5%BSA-PBS)按比例稀释的一抗,4℃冰箱中孵育过夜;PBS漂洗5 min,3次,;加入按1∶200稀释的二抗(CY3-抗兔,FITC-抗鼠),室温避光孵育60 min;加DAPI工作液(用PBS稀释),室温染色8 min;PBS漂洗5 min,3次;50%甘油封片,于荧光显微镜下观察。各一抗工作浓度为:小鼠抗大鼠A2B5抗体1∶200;兔抗大鼠NG2抗体1∶100;兔抗大鼠MBP抗体1∶200;小鼠抗大鼠O4抗体1∶200;兔抗大鼠ROCK2抗体1∶200;用PBS替代一抗作为免疫细胞化学染色的阴性对照。
5.Western blot检测
取OGD干预后0 h和4 d后各组细胞,用含cocktail(10%v/v)的细胞裂解液冰上裂解并超声破碎,离心后获得蛋白上清。将20μg蛋白样品通过12%SDS-聚丙烯酰胺凝胶电泳,并转移到PVDF膜上,5%脱脂奶粉-TBST封闭1 h后,孵育兔抗大鼠MBP抗体(1∶1000)4℃过夜,洗膜,加入IRDye 800或 Alexa Fluor 800标记的IgG二抗(1∶5000),室温孵育1 h,TBST漂洗后Odyssey红外成像仪器扫描PVDF膜。
6.统计学处理
结 果
1.少突胶质前体细胞(OPCs)培养鉴定
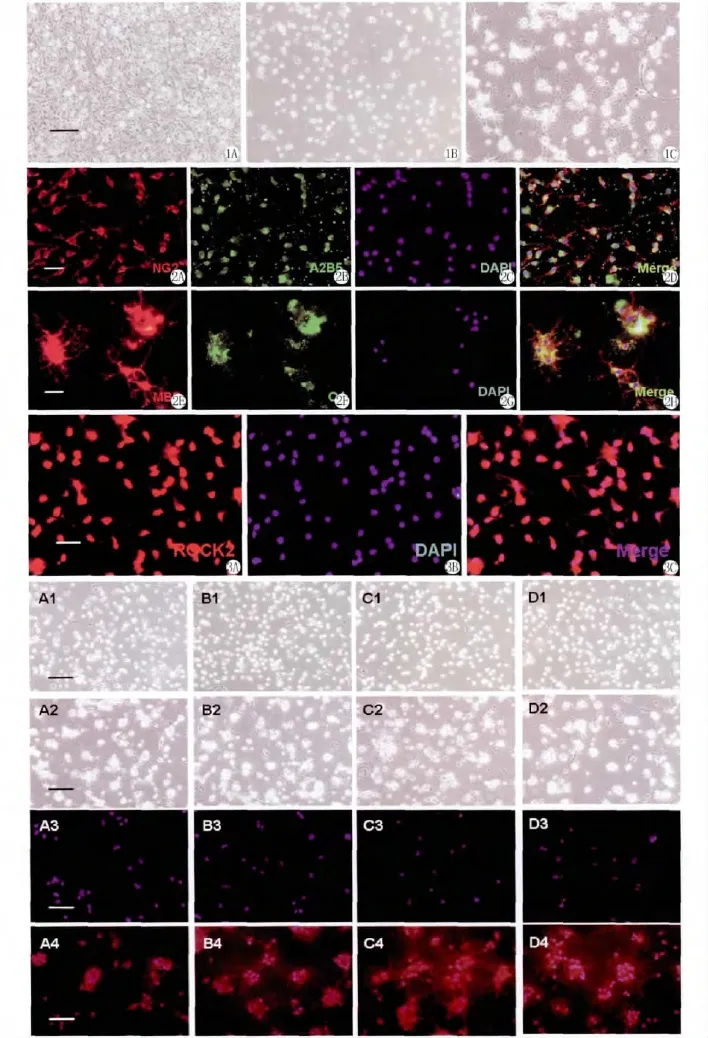
原代混合胶质细胞培养10 d左右有分层现象,下层为融汇成片的星形胶质细胞,上层为胞体小、折光性较强的小胶质细胞和OPCs,(图1A)。经过振摇并差速贴壁法纯化的OPCs呈梭形、椭圆形或三角形,有双极突起,部分为三个突起或者多个突起(图1B)。免疫荧光组化显示,95%以上的细胞表达OPCs特异性标志物A2B5和NG2(图2)。用分化培养基替换OPCs培养基诱导分化后3 d,原OPCs突起增多变长,交织成网状(图1C),免疫荧光染色结果显示,经诱导分化的细胞表达成熟前期及成熟的少突胶质细胞OLs特异性蛋白O4和MBP(图2),表示OPCs被定向诱导分化形成了OLs。
2.少突胶质前体细胞(OPCs)中ROCK2的表达
正常培养的OPCs经过ROCK2和DAPI行免疫荧光双标后,可见所有细胞均呈ROCK2免疫反应阳性。ROCK2免疫阳性荧光主要位于胞浆及突起(图3)。
3.Y27632对OGD损伤后OPCs分化的影响
各处理组干预后显微镜下观察(图4):处理当天细胞形态无明显变化,仍为双极性,4 d后细胞突起明显增多变长,呈分化状态;免疫荧光染色(图4)显示处理当天细胞几乎不表达MBP,4 d后细胞表达MBP增多;Western blot结果显示(图5),处理当天细胞不表达MBP,4 d后细胞表达MBP增多,在4 d组中,单纯OGD处理较对照组MBP表达明显增多,加药组比不加药组MBP表达也明显增多。
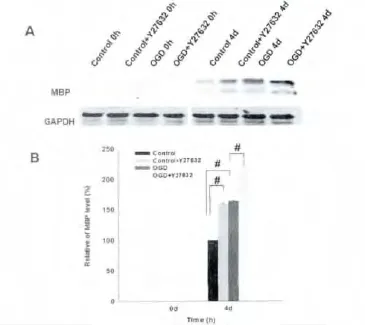
图5 Y27632对于OGD后少突胶质前体细胞表达MBP的影响A:Western blot图片显示各组的MBP表达,B:各组MBP表达量的统计图(n=5;#P<0.01)。Fig.5 Effects of Y27632 on the expression of MBP following OGD A:Representative Western blot shows the changes in MBP expression in response to treatment,B:Statistical analysis of MBP expression(n=5;#P<0.01).
讨 论
脑缺血缺氧性损伤不但影响灰质同时导致白质受损,引起一系列的神经功能缺损症状。白质受损与少突胶质细胞系的坏死和凋亡密切相关[14]。白质损伤发生脱髓鞘改变后,成熟的少突胶质细胞自身不能修复。髓鞘再生需要内源性的少突胶质前体细胞 (Oligodendrocyte precursor cells,OPCs,即NG2细胞)募集分化成为产生髓磷脂的少突胶质细胞[15]。OPCs分化为成熟的OLs需经过一系列特定阶段,包括增殖状态的OPCs(表达NG2和A2B5标志物,具有双极或三极形态),未成熟OLs(表达O4标志物,具有多极形态),最后是成熟的OLs(表达 MBP标志物)[16]。
Rho/ROCK通路被称为肌动蛋白细胞骨架的调节器,它普遍存在于机体各组织细胞中,其介导的信号通路参与细胞的收缩、粘附、迁移、增殖、细胞骨架的形成等[17],Rho A/ROCK通道激活后可以影响细胞的增殖、分化、基因表达、细胞骨架的组装、转录因子的激活、细胞周期的调节等生物学行为[18]。少突胶质前体细胞(OPCs)在发育为少突胶质细胞(即OLs)之前其细胞骨架需要经过一系列变化,包括细胞突起增多及延长,ROCK通路与这些变化有着密切的联系。但ROCK通路对OGD损伤后OPCs的分化影响尚不清楚。
我们的研究发现,给予少突胶质前体细胞OGD 2 h干预后OPCs细胞表达MBP量较正常细胞增多,促进 OPCs的分化,与 Xiong等[19]和 Thomas等[20]的研究一致。分析可能原因:OGD 2 h损伤后成熟少突胶质细胞受损凋亡,髓鞘脱失,OPCs反应代偿性分化发育为少突胶质细胞,促进髓鞘再生。同时我们的研究发现特异性抑制ROCK不但可以促进正常OPCs的分化,同时可以促进OGD损伤后OPCs分化,提示ROCK信号通路对OPCs的分化起负向调控作用。Wang等[21]研究表明ROCK信号通道通过使 MLC(myosin light chain)磷酸化后激活NMⅡ(nonmuscle myosinⅡ),从而抑制少突胶质前体细胞的分化。我们推测Y27632特异性抑制ROCK,使MLC磷酸化减少,抑制NMⅡ的激活,从而促进OGD后OPCs分化。
综上所述,ROCK信号通路在OPCs分化的过程中有重要的调控作用,通过对该通路的干预可能为研究神经系统脱髓鞘改变后促进少突胶质细胞髓鞘化提供新的思路。
[1]McCarthy KD,de Vellis J.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue.J Cell Biol,1980,85:890-902
[2]Bu J,Banki A,Wu Q,et al.Increased NG2(+)glial cell proliferation and oligodendrocyte generation in the hyp0mye¨nating mutant shiverer.Glia,2004,48:51-63
[3]Zhu X,Bergles DE,Nishiyama A.NG2 cells generate both oligodendrncytes and gray matter astrocytes.Development,2008,135:145-l57
[4]Aguirre A,Gallo V.Postnatal neurogenesis and gliogenesis in the olfactory bulb from NG2-expressing progenitors of the subventricular zone.J Neurosci,2004,24:10530-10541
[5]Redwine JM,Armstrong RC.In vivo proliferation of oligodendrocyte progenitors expressing PDGFaR during early remyelination.Neurobiol,1998,37:413-428
[6]Anjana Jain,Robert J.Mc Keon,et al.Brady-Kalnay,eta1.Sustained Delivery of Activated Rho GTPases and BDNF Promotes Axon Growth in CSPG-Rich Regions Following Spinal Cord Injury.PLoS One,2011,6(1):e16135
[7]Xian Huang,Jin-Mo Kimc,Tae Ho Kong,et al.GMCSF inhibits glial scar formation and shows long-term protective effect after spinal cord injury.Journal of the Neurological Sciences,2009,277:87-97
[8]Massey JM,Amps J,Viapiano MS,et al.Increased chondroitin sulfate proteoglycan expression in denervated brain-stem targets following spinal cord injury creates a barrier to axonal regeneration overcome by chondroitinase ABC and neurotrophin-3.Exp Neurol,2008,209:426-445
[9]Armin Buss,Katrin Pech,Byron A Kakulas,et al.NG2 and phosphacan are present in the astroglial scar after human traumatic spinal cord injury.BMC Neurology,2009,10:1-15
[10]Numano F,Inoue A,Enomoto M,et al.Critical involvement of Rho GTPase activity in the efficient transplantation of neural stem cells into the injured spinal cord.Mol Brain,2009,2:37
[11]Yang P,Wen HZ,Zhang JH.Expressionof a domi nant-negative Rho-kinase promotes neurite outgrowth in a microenvironment mimicking injured central nervous system.Acta Pharmacol Sin,2010,31(5):531-539
[12]Ying Ch,Veerakumar B,Jie P,et al.Isolation and culture of rat and mouse oligodendrocyte precursor cell.Nature Protocols,2007,2 (5):1044-1051
[13]Zhi Yu Yu,Miao Liu,Xiang Luo,et al.ROCK inhibition with Y27632 promotes the proliferation and cell cycle progression of cultured astrocyte from spinal cord.Neurochemistry International,2012,61(7):1114-1120
[14]Carloni S,Carnevali A,Cimino M,et al.Extended role of necrotic cell death after hypoxia-ischemia-induced neurodegeneration in the neonatal rat.Neurobiol Dis,2007,27:354-361
[15]Florencia L,Susana G,Analia L,et al.Progesterone attenuates astro-and microgliosis and enhances oligodendrocyte differentiation following spinal cord injury.Exp Neurol,2011,231(1):135-46
[16]Gard AL,Williams WC,Burrell MR.Oligodendroblasts distinguished from O-2A glial progenitors by surface phenotype(O4+GalC-)and response to cytokines using signal transducer LIFR beta.Dev.Biol,1995,167:596-608
[17]Sheikh AM,Nagai A,Ryu JK,et al.Lysophosphatidylcholine induces glial cell activation:role of rho kinase.Glia,2009,57(8):898-907
[18]Gopalakrishnan SM,Teusch N,Imhof C,et al.Role of Rho Kinase Pathway in Chondroitin Sulfate Proteoglycan-Mediated Inhibition of Neurite Outgrowth in PC12 Cells.J Neurosci Res,2008,86(10):2214-2226
[19]Xiong,Man,Jin Li,Si-Min Ma,et al.Effects of hypothermia on oligodendrocyte precursor cell proliferation,differentiation and maturation following hypoxia ischemia in vivo and in vitro.Exp.Neurol,2013
[20]Thomas Schmitz,Stefanie Endesfelder,Li-Jin Chew,et al.Minocycline Protects Oligodendroglial Precursor Cells Against Injury Caused by Oxygen-Glucose Deprivation.Journal of Neuroscience Research,2012,90:933-944
[21]Haibo W,Tomasz R,Ambika T,et al.MyosinⅡIs a Negative Regulator of Oligodendrocyte Morphological Differentiation.Journal of Neuroscience Research,2012,90(8):1547-1556
图 版 说 明
图1 倒置显微镜下细胞形态(scale bar=100μm)(A)脊髓混合胶质细胞 (B)纯化后3 d的少突胶质前体细胞(C)诱导分化3 d的少突胶质细胞。
图2 OPCs及其诱导分化为OLs细胞鉴定(scale bar=40 μm)(A)-(D)为OPCs细胞鉴定,(E)-(H)为OPCs诱导分化后细胞鉴定结果。
图3 免疫荧光显示OPCs表达ROCK2(scale bar=40μm)
图4 Y27632对OGD损伤后OPCs分化的影响情况 (A1-A4)为对照组细胞,(B1-B4)为对照+Y27632组细胞,(C1-C4)为 OGD 组细胞,(D1-D4)为 OGD+Y27632组细胞;(A1-D1)为干预后当天倒置显微镜下细胞状态,(A2-D2)为干预后第4 d倒置显微镜下细胞状态(scale bar=100μm),(A3-D3)为干预后0 d免疫荧光染色,(A4-D4)为干预后第4 d MBP和DAPI的免疫荧光染色。红色为MBP,蓝色为DAPI(scale bar=40 μm)。
EXPLANATION OF FIGURES
Fig.1 Cells morphology under inverted microscope(scale bar=100μm)(A)Spinal cord mixed glial cells(B)Oligodendrocyte precursor cells 3 days after purification(C)Oligodendrocytes differentiated of 3 days from oligodendrocyte precursor cells
Fig.2 Identification of OPCs and OLs differentiated from OPCs(scale bar=40μm)(A)-(D)Identification of OPCs,(E)-(H)Identification of OLs differentiated from OPCs
Fig.3 The expression of ROCK2 in OPCs showed by immunofluorescence(scale bar=40μm)
Fig.4 Effects of Y27632 on OPCs differentiation following OGD (A1-A4)Cells in control group,(B1-B4)Cells in control+Y27632 group,(C1-C4)Cells in OGD group,(D1-D4)Cells in OGD+Y27632 group;(A1-D1)Cells morphology under inverted microscope 0 day after treatment,(A2-D2)Cells morphology under inverted microscope 4 days after treatment(scale bar=100μm),(A3-D3)Immunofluorescence of cells 0 day after treatment,(A4-D4)Immunofluorescence of cells 4 days after treatment.Double staining with MBP (red)/DAPI(blue)(scale bar=40μm).