生长分化因子-5及碱性成纤维细胞生长因子诱导家兔椎间盘髓核细胞成骨作用的研究
张长春 陆泉秀 周新社 鲍正齐 胡建国 丁 海 许 刚 周建生*
(1安徽省蚌埠医学院第一附属医院骨科,蚌埠233004;2安徽省组织移植重点实验室,蚌埠233004)
目前通过手术方式对滑脱椎体进行复位和椎间融合是治疗腰椎滑脱的最终方法。但国内外有学者认为[1,2],对于Ⅰ和Ⅱ度的腰椎滑脱只需要原位脊柱融合即可,对I度滑脱复位反而易引起并发症。而手术进行脊柱融合不仅创伤大,治疗费用高,而且术中使用的融合材料,包括自体骨、异体骨和人工骨等都存在着各种不足。临床病例研究发现某些椎间盘组织钙化,可以形成高密度的骨组织[3]。而通过微创技术人工诱导椎间盘组织使其钙化,则有希望达到椎体融合的目的。因此,本研究通过建立家兔椎间盘髓核细胞的体外培养模型,研究重组人生长分化因子-5(recombinant human growth differentiation factor-5,rh GDF-5)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)对髓核细胞成骨潜能的激发作用。
材料和方法
1.试剂与仪器
rh GDF-5(Peprotech公司,美国),bFGF(Peprotech公司,美国),鼠抗人I型胶原抗体、鼠抗人Ⅱ型胶原抗体(Chemicon公司),Envissin+TM Peroxidase Rabbit(DAKO公司),MTT试剂盒(碧云天生物技术研究所),骨钙素放射免疫检测试剂盒(北京东亚免疫技术研究所),磷酸盐缓冲液(武汉博士德生物技术有限公司)。
2.髓核细胞的提取和培养
取健康成年家兔4只,无菌条件下取出兔胸腰段脊柱,仔细分离出椎间盘髓核组织,剪碎至1 mm3,经0.1%Ⅱ型胶原酶消化后离心、重悬两次,得到髓核细胞后0.4%台盼兰染色并用血细胞计数板进行计数,计算细胞活力(细胞活力=未被染色活细胞数量÷细胞总数×100%),得到高成活率、成份均一的椎间盘髓核细胞。用差速贴壁法纯化细胞,得到纯度更高的髓核细胞。按1×105/ml密度将细胞分别接种于培养板和培养瓶中,培养基为含15%胎牛血清的DMEM,青霉素100 U/ml、链霉素100 U/l,待细胞贴壁后每3 d进行传代,收集,倒置显微镜观察生长情况。
3.实验分组
取上述第三代细胞,按细胞因子不同分为四个培养组:A组(对照组):DMEM/15%FBS培养基;B组(rh GDF-5):DMEM/15%FBS培养基+rh GDF-5(0.1μg/ml);C组(bFGF):DMEM/15%FBS培养基+bFGF(10 ng/ml);D 组(rh GDF-5+bFGF):DMEM/15%FBS培养基+rhGDF-5(0.1μg/ml)+bFGF(10 ng/ml)。
4.Ⅰ、Ⅱ型胶原免疫组化染色
取第三代细胞爬片后PBS洗片,4%多聚甲醛固定10 min后3%H2O2、10%正常山羊血清室温依次孵育10min,倾去血清先后滴加一抗(4℃过夜),二抗,DBA显色,冲洗后复染、封片。设置阴性对照(不加一抗,其余步骤相同)。
各组细胞培养至第24 d分别行Ⅰ型、II型胶原蛋白免疫组化染色(按试剂盒步骤进行)。前者用鼠抗人I型胶原抗体为一抗,后者用鼠抗人II型胶原抗体为一抗。
5.Ⅰ型胶原免疫印迹(Western blot)
将上述处理后的各组细胞,迅速冰上匀浆、沸煮10 min,超声后BCA法测定细胞蛋白浓度。按照溴酚蓝:β-巯基乙醇=1∶3的比例充分混合、震荡、煮沸10 min。将预染maker和各组样品依次加入相应泳道进行电泳,待目的蛋白分离后、缓慢的由SDS-PAGE胶转至NC膜上转膜、3-5%脱脂奶粉室温封闭30-60 min、一抗孵育(4℃过夜)、TBS漂洗3次×10 min、二抗室温下避光孵育1-2 h、TBS漂洗3次×10 min,Odyssey显色仪显色分析。
6.放射免疫技术测定骨钙素表达
各组细胞培养至24 d后取上清液,加入分离剂后,混匀室温放置20 min,4℃3500 r/min离心20 min,吸弃上清液,检测沉淀物放射剂量。由放射免疫γ计数器预先编制程序,直接给出标准曲线、相关参数及样品浓度,单位以ng/ml表示。按表1依次进行。
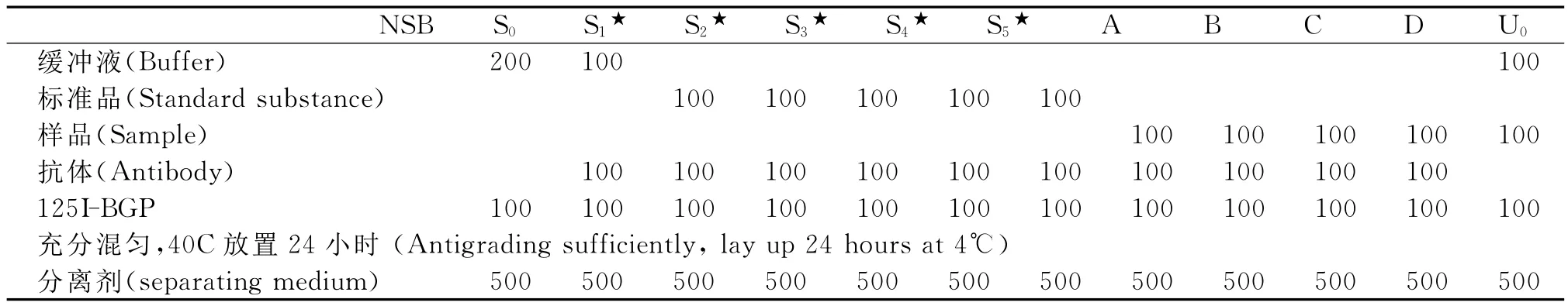
表1 BGP放射免疫技术加液程序(μl)Table 1 Feeding program of BGP radio-immunity technology(μl)
7.四环素标记钙结节及茜素红染色比较钙盐沉积程度
各组细胞培养至24 d时,将其分别在含有1 mg/ml四环素的培养基中培养1 h,更换正常DMEM/15%FBS培养基再培养1 h,然后用PBS洗涤,95%乙醇脱水后荧光显微镜观察;各组细胞培养至24 d时,95%乙醇固定后,0.1%茜素红染色,双蒸水冲洗后,倒置显微镜观察比较各组钙盐沉积情况。
8.统计学分析
采用SPSS 17.0统计软件进行处理,对各组总体方差进行齐性检验,用单因素方差分析确定各组均数间是否有差异,以P<0.05为差异有显著性,具有统计学意义。
结 果
1.Ⅰ、Ⅱ型胶原免疫组化染色
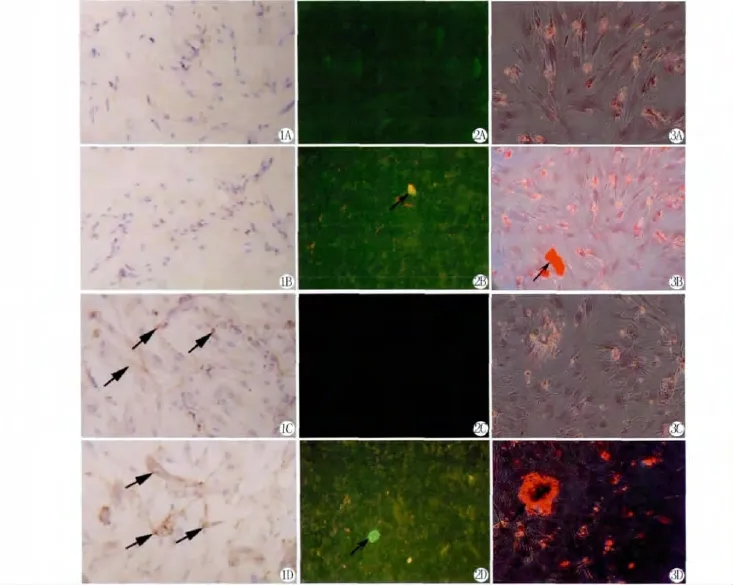
Ⅰ、Ⅱ型胶原免疫组化染色胞浆呈黄褐色定义为阳性,结果显示对照组和rhGDF-5组细胞分泌的Ⅰ型胶原免疫组化染色呈阴性(图1A和B);bFGF组和rh GDF-5+bFGF组细胞分泌的Ⅰ型胶原免疫组化染色呈阳性(图1C和D)。四组细胞分泌的Ⅱ型胶原免疫组化染色均为阴性。
2.Ⅰ型胶原免疫印迹(Western blot)
免疫印迹结果显示:对照组(Vector)和rh GDF-5组细胞分泌的Ⅰ型胶原蛋白的表达水平显著低于bFGF组和rhGDF-5+bFGF组(P<0.05)(图2)。
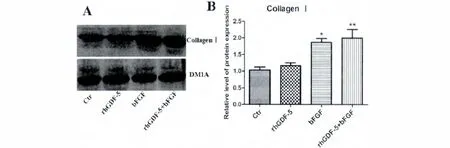
图2 各组细胞Ⅰ型胶原蛋白免疫印迹结果。A.对照组(Vector)和rh GDF-5组细胞Ⅰ型胶原蛋白的表达水平显著低于bFGF组和rhGDF-5+bFGF组,DM1A(α-tublin)为内参。B.Ⅰ型胶原蛋白/内参DM1A后图灰度值的统计图(*P<0.05,**P<0.05和Vector组比较)。Fig.2 Result of CollagenⅠexpressed in each group.A.The expression level of CollagenⅠprotein in Vector and rh GDF-5 group is lower than that in bFGFand rhGDF-5+bFGFgroup.The levels of CollagenⅠwas standardized against the level of the DM1A (α-tublin)protein.B.Blot of CollagenⅠ/DM1A protein(*P<0.05,**P<0.05 versus Vector group).
3.骨钙素表达水平测定结果
bFGF组细胞分泌的骨钙素检测结果与对照组相比较无显著差异。rhGDF-5组和rhGDF-5+bFGF组细胞分泌的骨钙素量均明显高于对照组(表2)。
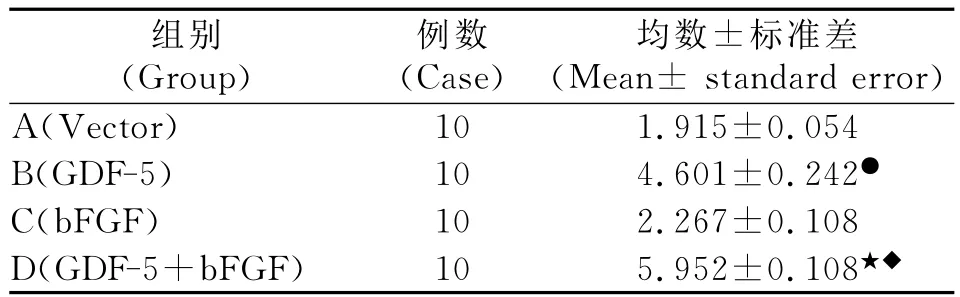
表2 第24 d各组细胞上清液中骨钙素测定结果(ng/ml)Table 2 Osteocalcin detection in the supernate after 24 days'cultivation
4.四环素标记钙结节
对照组和bFGF组均未见明显荧光标记的钙结节;rh GDF-5组和rh GDF-5+bFGF组可见明显的荧光钙结节,形状以圆形为主,伴有少数不规则形结节。rhGDF-5+bFGF组钙结节的大小和数量均明显高于GDF-5组的钙结节(图3)。
5.茜素红染色
对照组未见钙盐沉积;rh GDF-5组钙盐沉积较A组明显;bFGF组未见明显的钙结节,提示无明显钙盐沉积。实验组的钙盐沉积最为明显,形成的钙结节无论在大小和数量上均要高于其他三组(图4)。
讨 论
髓核细胞能特异性地合成和分泌大量的Ⅱ型胶原和聚合蛋白,并且碱性磷酸酶活性非常低[4]。由于长期的缺氧环境,髓核细胞缺乏线粒体并富含糖原[5]。体外培养的髓核细胞有氧呼吸活动增强,在有或没有诱导因子作用的情况下,其Ⅱ型胶原免疫组化染色均为阴性,并且细胞内的糖原减少甚至消失、线粒体增多,这些都提示,髓核细胞出现了向成纤维细胞反分化的特征[6]。
Ⅰ型胶原作为钙盐沉积的基础,是成骨细胞合成分泌的特异性胶原蛋白,当椎间盘发生退变或钙化时,髓核细胞分泌的Ⅱ型胶原会减少,Ⅰ型胶原明显增多[7]。而本实验中,在bFGF的诱导下髓核细胞Ⅰ型胶原免疫组化呈阳性染色,提示髓核细胞在诱导因子bFGF的作用下出现了转分化,即具有成骨分化的潜能。
GDF-5属于TGF-β超家族中的新成员,是机体生长发育过程的重要生长因子。很多研究显示其在体内、外均有较强的促进髓核细胞成骨性分化、诱导异位成骨作用[8-11]。Zeng等[11]发现 GDF-5诱导脂肪间充质干细胞使其表达 OC、Cbfal、ALP和VEGF等增加。从而证实GDF-5的矿化作用能诱导脂肪间充质干细胞成骨转化。Rothamel等[12]研究发现GDF-5的复合材料,能促进比格犬牙槽脊骨质缺损部位的骨组织形成。这些均提示:GDF-5有显著的矿化作用。
骨钙素是成骨细胞分化成熟及基质矿化的特异性指标;Ⅰ型胶原是成骨细胞分泌的主要胶原蛋白,是成骨细胞分化的标志;钙盐沉积则是细胞矿化作用的主要表 现[13,14]。本实验 中 B 组 (rh GDF-5)细胞不论是上清液中骨钙素表达还是茜素红染色显示钙盐的沉积,均要比A组强,且明显抑制髓核细胞的增殖,提示rhGDF-5通过抑制体外培养的髓核细胞的增殖,而诱导其成骨作用;但其并不影响Ⅰ型胶原的表达。
bFGF具有促进细胞有丝分裂、促进软骨和骨组织损伤修复及行成、促进血管形成等多种生物学作用[15]。Riew 等[16]发现bFGF能促使细胞合成DNA,促进细胞从静止期进入增殖期,从而能促进大多数源于中胚叶和神经外胚叶的细胞增殖。研究发现敲除bFGF基因可引起骨密度降低,骨成长迟缓,导致成骨障碍[17]。本实验中C(bFGF)组细胞的增殖速度较对照组rhGDF-5组明显加快,Ⅰ型胶原的表达明显增强,但骨钙素表达较A组细胞无显著差异,茜素红和四环素荧光也未见明显的钙结节,故可以推测,bFGF的主要作用是促进细胞增殖,在诱导细胞骨化方面并不如rhGDF-5作用明显。
成骨诱导和骨形成是一个复杂而又连续的过程,许多细胞因子通过不同方式在不同环节上影响不同时期的成骨细胞生长和代谢[18,19]。GDF-5和bFGF通过不同的途径和不同的机理作用于椎间盘髓核细胞,诱导髓核细胞成骨分化。GDF-5可诱导髓核细胞成骨分化,促进钙盐沉积形成钙结节,但同时阻碍了细胞的增殖。bFGF能使细胞DNA合成量增加,促进细胞有丝分裂,从而促进细胞的增殖。但其诱导髓核细胞成骨能力明显不足。所以,当联合使用GDF-5和bFGF时,GDF-5诱导细胞成骨后,为bFGF提供了大量的靶细胞,进而促进成骨细胞的增殖分化。bFGF弥补了DGF-5促细胞增殖能力上的不足,而GDF-5弥补了bFGF成骨诱导活性底下的缺点,使两者在诱导髓核细胞成骨的生物学功能上形成互补,加速了成骨诱导和骨形成的过程。本实验中rh GDF-5+bFGF组的骨钙素表达最高、Ⅰ型胶原免疫组化的强阳性、明显的钙盐沉积都说明了GDF-5和bFGF有协同诱导髓核细胞成骨的能力。
[1]贾连顺.腰椎滑脱和腰椎滑脱症.中国矫形外科杂志,2001,8(8):518-521
[2]Kmi NH,Lee JW.Anterior interbody fusion versus posterolateral fusion with transpedicular fixation for isthmic spondylolisthesis in adults.A comparison of clinical results.Spine(PhilaPa 1976),1999,24(8):812-816
[3]An HS,Anderson PA,Haughton VM,et al.Introduction:discdegeneration:summary.Spine,2004,29(23):2677-2678
[4]Zhang CC,Zhou JS,Hu JG,et al.Effects of IGF-1 on IL-1β-induced apoptosis in rabbit nucleus pulposus cells in vitro.Mol Med Rep,2013,7(2):441-444
[5]Buckwalter JA,Pedrini-Mille A,Pedrini V,et al.Proteoglycans of human infant intervertebral disc.Electron microscopic and biochemical studies.Bone Joint Surg Am,1985,67(2):284-294
[6]谢其扬,叶君健,傅冷西,等.腰椎间盘髓核细胞体外培养及细胞生物学特性研究.中国中医骨伤科杂志,2006,11(14):85-88
[7]Sittichockechaiwut A,Scutt AM,Ryan AJ,et al.Use of rapidly mineralizing osteoblasts and short periods of mechanical loading to accelerate matrix maturation in 3D scaffolds.Bone,2009,44(5):822-829
[8]Kadomatsu H,Matsuyama T,Yoshimoto T,et al.Injectable growth/differentiation factor-5 recombinant h uman collagen composite induces endochondral ossification via Sry-related HMG box 9 (Sox9)expression and angiogenesis in murine calvariae.J Periodont Res,2008,43:483-489
[9]Dupoirieux L,Pohl J,Hanke M,et al.A preliminary report on the effect of dimeric rh GDF-5 and its monomeric form rh GDF-5C465A on bone healing of rat cranial defects.Journal of Cranio-Maxillofacial Surgery,2009,37(1):30-35
[10]Chhabra A,Zijerdi D,Zhang J,et al.BMP-14 Deficiency Inhibits Long Bone Fracture Healing A Biochemical,Histologic,and Radiographic Assessment.J Orthop Trauma,2005,19(9):629-634
[11]Zeng Q,Lix D,Beck G,et al.Growth and differentiation factor-5(GDF-5)stimulates osteogenic differentiation and increases vascular endothelial growth factor(VEGF)levels in fat-derived stromal cells in vitro.Bone,2007,40(2):374-381
[12]Schwarz F,Rothamel D,Herten M,et al.Lateral ridge augmentation using particulated or block bone substitutes biocoated with rhGDF-5 and rhBMP-2:an immunohistochemical study in dogs.Clin Oral Implants Res,2008,19(7):642-652
[13]Goto H,Osakim M,Fukushima T,et al.Human bone marrow adipocytes support dexamethasone induced osteoclast differentiation and function through RANKL expression.Biomed Res,2011,32(1):37-44
[14]Youness E,Mohammed NA,Morsy FA.Cadmium impact and osteoprosis,mechanism of action.Toxical Mech Metheds,2012,22(7):560-567
[15]陈富民,南欣荣.bFGF在牵引成骨中的研究进展.现代口腔医学杂志,2009,23(2):199-201
[16]Riew KD,Lou J,Wright NM,et al.Thoraooscopic intradiscal spine fusion using a minimally invasive Gene-therapy technique.J Bone Joint Surg Am,2003,85-A (5):866-871
[17]Montero A,Okada Y,Tomita M,et al.Disruption of the fibroblast growth factor-2 gene results in decreased bone mass and bone formation.JC lin Invest,2000,105(8):1085-1093
[18]Zhang B,Yang S,Sun Z,et al.Human mesenchymal stem cells induced by growth differentiation factor 5:an improved self-assembly tissue engineering method for cartilage repair.Tissue Eng Part C Methods,2011,17(12):1189-1199
[19]Coleman CM,Scheremeta BH,Boyce AT,et al.Delayed fracture healing in growth differentiation factor 5-deficient mice:a pilot study.Clin Orthop Relat Res,2011,469(10):2915-2924
图 版 说 明
图1 髓核细胞Ⅰ型胶原免疫组化阴性(A,B)和阳性(C,D箭头所示)染色(×100)(A:A组;B:B组;C:C组;D:D组)。
图3 四环素标记的钙盐阴性(A,C)和阳性(B,D箭头所示)沉积(×200)。A:A组;B:B组;C:C组;D:D组。
图4 茜素红染色的钙盐(A,C)和阳性(B,D箭头所示)沉积(×200)。A:A组;B:B组;C:C组;D:D组。
EXPLANATION OF FIGURES
Fig.1 Negative(A,B)and positive(C,D)staining of typeⅠcollagen in the nucleus pulposus cells in each group by immunohistochemistry staining(×100)(A:group A;B:group B;C:group C;D:group D).
Fig.3 Negative(A and C)and positive(B and D)calcium deposition in each group by tetracycline marker staning(×200).A:group A;B:group B;C:group C;D:group D.
Fig.4 Negative(A,C)and positive(B,D)calcium deposition in each group by alizarin red staining(×200).A:group A;B:group B;C:group C;D:group D.