恶性胸腔积液中肺腺癌的EGFR、VEGF和P53的表达及分子生物学意义
方长清 姜跃峰 姜海娇 方思涵 李建华*
(1中国医科大学附属第一医院病理科暨中国医科大学病理教研室,2辽宁大学经济学院,沈阳110001)
肺癌是目前癌症中致死率最高的一种,其中原因之一就是患者在初诊时往往都处于肺癌晚期,恶性胸腔积液是晚期肺癌常见的并发症之一,且能够降低病人的生存期[1]。而对于晚期肺癌的治疗,如何使用经济、有效的化疗药物来延长患者的生存期,是目前临床治疗面临的主要问题,而靶向药物的使用是其中最主要的方法之一。
EGFR(epidermal growth factor receptor)表皮生长因子是广泛存在于细胞膜上的一种糖蛋白,属于酪氨酸激酶,参与的信号通路主要包括MAPK通路、PI3K 通路、c-Src通路等[2]。有研究表明在肿瘤的发展过程中,EGFR的高表达可以促进肿瘤细胞的增殖、血管生成、黏附、侵袭和转移[3],且它的高表达与其发生基因突变密切相关[4]。而发生EGFR基因突变的患者可使用酪氨酸激酶抑制剂靶向治疗,如吉非替尼。恶性肿瘤的生长依赖机体提供的营养和氧气,而当肿瘤组织生长大于2 mm时必须需要血管来提供养分,此时肿瘤细胞在缺氧的情况下可以通过自身和周围组织分泌多种生长因子来刺激血管的生成,其中 VEGF(vascular endothelial growth factor,血管内皮生长因子)是刺激血管生成重要的因子,它可以促进血管内皮细胞增殖、增加血管通透性。近年针对VEGF为靶点的药物研究已有一定进展[5]。P53基因的突变是肿瘤形成早期的重要事件,已在多种肿瘤组织中得到证实。野生型的P53基因具有抑制肿瘤的作用,而发生突变后失去了抑制作用,有研究显示,在肺癌中P53具有较高的突变率,对于肺癌的形成具有重要作用。
本研究对恶性胸腔积液中的肺腺癌细胞进行提取与收集,对EGFR、VEGF和P53进行表达检测,并进行相关性统计,对其表达意义进行分析,进一步理解肿瘤细胞的恶性生物学行为和探讨对临床治疗的指导意义。
材料和方法
1.临床样本
收集2011到2012年中国医科大学附属第一医院门诊及病房中未经治疗的77例肺腺癌患者恶性胸腔积液作为研究对象,经细胞及组织病理和免疫化学染色诊断为腺癌。男37例,女40例,年龄从36至83岁,平均年龄为59岁。
2.液基细胞薄层检测技术(ThinPrep Cytology Test,TCT)
收集新鲜胸水25 ml 2管2000 r/min离心5 min后,弃掉上清液,加入细胞清洗液继续2000 r/min离心5 min后,吸取适量沉淀物加入细胞保存瓶内,静置10 min左右,用新柏氏液基细胞仪制成薄层细胞涂片,并进行巴氏染色和镜下诊断。
3.切片制备与HE染色
采用TCT常规制片,诊断后,每份标本收集新鲜胸水200 ml左右,室温下2000 r/min离心5 min,取细胞沉渣,经95%乙醇固定12 h后梯度酒精脱水,二甲苯透明,浸蜡,包埋,切片,HE染色后,镜下观察,筛选切片。
4.免疫细胞化学技术:
常规石蜡包埋切片后,采用链霉素抗生物素蛋白-过氧化物酶法(streptavidin-peroxidase,SP法)进行免疫细胞化学染色。切片常规烤片,脱蜡,水化,0.01 mol/l柠檬酸盐缓冲液高温高压抗原修复3 min;内源性过氧化物酶阻断液37℃孵育30 min;一抗4℃孵育过夜,EGFR、VEGF、P53稀释比例为1∶100;辣根过氧化物酶标记的二抗37℃孵育30 min;链霉素亲和素过氧化物酶溶液37℃孵育30 min;新配置的DAB溶液显色;苏木素复染,中性树胶封片。用PBS代替一抗作阴性对照。
免疫细胞化学结果判定标准:细胞质或细胞膜中出现棕黄色颗粒的细胞为阳性细胞,每张切片在光镜下随机选取5个视野,每个视野计数100个瘤细胞,着色强度分为:无色为0分,浅黄色或黄色为1分,棕黄色为2分。阳性细胞数分为:<10%为0分,10%-50%为1分,>50%为2分,两项得分相乘结果>2记为阳性(+),<2为阴性(-)。
5.统计分析
统计数据分析采用SPSS17.0统计软件,基因表达与临床特征之间的关系采用chi-square test或者Fisher's exact test,两者相关性用非参数spearman等级相关分析,P<0.05为差异有统计学意义。
结 果
TCT结果镜下显示细胞散在分布,核异型性明显,核质粗糙,N/C比例升高,核膜清晰,核大小不等,初步诊断为可疑瘤细胞;而在良性腹水中则以炎性细胞为主(图1A)。HE及免疫细胞化学结果显示上皮性肿瘤标志物CK7和TTF-1表达阳性(图1B-D)。EGFR、VEGF和P53分别表达于细胞膜和细胞浆、细胞浆、细胞核(图2A-C),表达率分别为71.4%、74%和40.3%(如表1),EGFR与 VEGF的表达成正相关(r=0.609,P=0.000)(表2)。
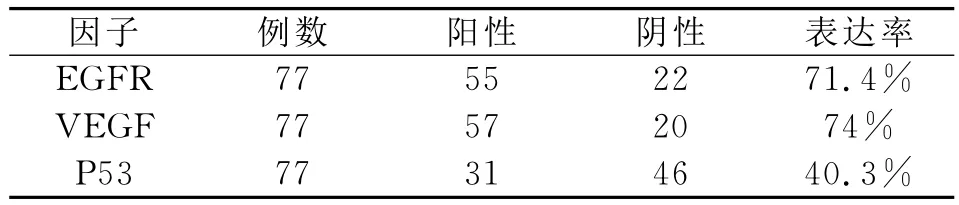
表1 恶性胸腔积液中肺腺癌细胞的EGFR、VEGF、P53的表达率Table 1 The expression rates of EGFR、VEGF and P53 of lung adenocarcinoma cells in malignant pleural effusion
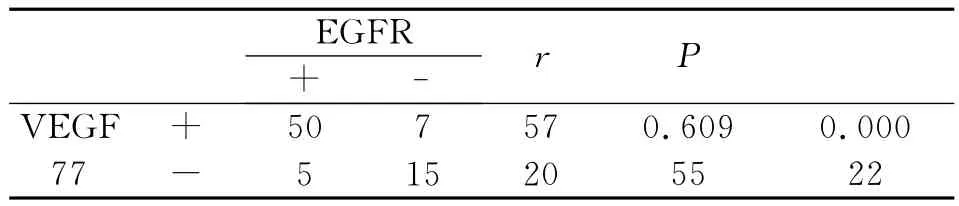
表2 EGFR和VEGF表达的相关性Table 2 The correlation of EGFR and VEGF expression
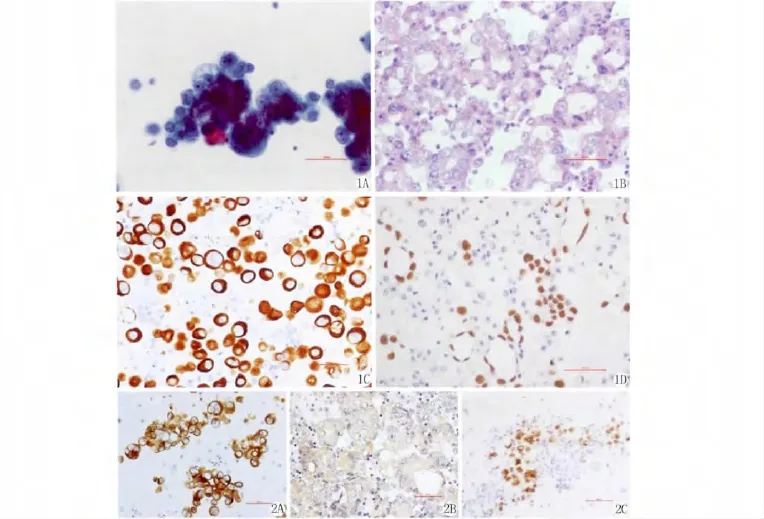
图1 A-B:恶性胸腔积液中肺腺癌细胞的TCT和HE染色。C-D:CK7、TTF-1在肺腺癌细胞中的表达(×400).图2 A-C:恶性胸腔积液中肺腺癌细胞的EGFR、VEGF和P53的表达(×400)。Fig.1 A-B:TCT and HE staining of lung adenocarcinoma cells in malignant pleural effusion.C-D:CK7、TTF-1 positive expression in lung adenocarcinoma cell(×400).Fig.2 A-C:EGFR,VEGF and P53 positive expression of lung adenocarcinoma cells in malignant pleural effusion(×400).
讨 论
EGFR是一种跨膜糖蛋白,它属于表皮生长因子基因(erbB)受体家族的一员,结构上包括由细胞外的结合区、跨膜区及主要由酪氨酸激酶组成的细胞内区等。EGFR活化后激活多条下游的信号通路近而介导生长作用或致癌[6]。表皮生长因子受体在非小细胞肺癌(NSCLC)中的表达率为43%-89%,其介导的信号通路影响着肿瘤细胞的增殖、凋亡、浸润转移及血管生成[7,8]。EGFR基因定位于人类第7号染色体短臂,包括28个外显子,EGFR基因突变的主要集中在19和21,两者共约占所有突变的90%[9]。多项研究证实:对EGFR基因突变患者使用EGFR-TKI(吉非替尼或厄洛替尼)与化疗相比,可显著延长患者PFS,并具有较高的疾病反应率,且具有良好的耐受性。同时,亚裔、女性、不吸烟及腺癌患者为 EGFR-TKI治疗的优势人群[3]。目前EGFR基因突变的检测已成为临床指导EGFRTKI用药的共识,但EGFR基因的检测较昂贵,而临床免疫化学EGFR的表达的检测则相对廉价,有研究表明其表达强度与基因突变具有关联性[4],因此对EGFR进行免疫化学检测,对于指导临床用药,改善患者预后具有重要意义。
VEGF作为特异性的血管内皮细胞分裂素,能够刺激体外培养的血管内皮细胞发生有丝分裂和迁移,以及体内血管的形成。血管的发生对于肿瘤的生长、侵袭和转移都发挥了重要作用,在这个过程中VEGF这种血管内皮细胞特异性生长因子起着重要的调节作用,它可促进肿瘤血管新生。在多种肿瘤组织中都发现其高表达,包括肺癌、胃癌、大肠癌和乳腺癌,且高表达者预后不良[10]。以VEGF为把目标的化疗药物的研究已有一定的进展,包括贝伐单抗等,并在临床化疗中取得良好的效果,虽有一定的副作用,但提高了患者的生存期,这为肿瘤治疗提供了新思路[11]。
在肿瘤发生发展的过程中,多种基因表达状态的改变和相互作用起到了重要作用,我们的研究显示,在恶性胸腔积液的肺腺癌细胞中,EGFR和VEGF具有较高的表达率,且二者的表达之间具有较高的相关性,有研究显示,EGFR可以促进肿瘤组织的血管形成,我们猜测EGFR可以通过信号通路上调VEGF进而促进肿瘤血管的形成。在恶性胸腔积液的临床诊断过程中,发现有部分患者的肿瘤细胞可相互连接成管腔样结构,有报道显示其与肿瘤血管生成拟态有关[12]。在我们的研究中有40.3%的P53表达,p53为一种抑癌基因,有研究显示野生型的P53基因具有多种功能,如调节转录、稳定基因组、抑制细胞周期进展、促进细胞凋亡,甚至还可能抑制血管形成。而发生突变的基因不仅失去了原有的生物学功能而且还会干扰原有的功能[13],这进一步刺激和促进了肿瘤的发生。针对其突变的基因治疗仍处于临床试验阶段。目前针对肺癌治疗的药物已有多种,但由于耐药的出现及其他方面的原因,治疗的效果一直不理想,而进行针对不同机制的联合用药也许能改善患者的预后,而对于药物的正确选择还需要进行临床试验的研究。恶性胸腔积液中的肿瘤细胞是较容易获得的一种诊断样本,对于肺癌的治疗,目前提出个体化的概念,是根据每一位患者自身不同的状态条件而进行不同的治疗方案,因此无论是靶向治疗还是基因治疗都需要进行治疗前相关因子的检测,而恶性胸腔积液中的肿瘤细胞的获取进而进行检测,不仅是一种既方便有经济的手段而且对患者的创伤较小,这对于肺癌晚期患者的治疗具有重要意义。
[1]Daniel M,Saiama W,Janakiraman S,et al.Prognostic Impact of Malignant Pleural Effusion at Presentation in Patients with Metastatic Non-Small-Cell Lung Cancer.Journal of Thoracic Oncology,2012,1485-1489
[2]吴健虹,谢秋玲,陈小佳等.表皮生长因子受体EGFR及其信号传导.生命科学,2006,18(2):116-122
[3]Gillian B,Drew B,Neale R,et al.Epidermal growth factor receptor(EGFR)in lung cancer:an overview and update.J Thorac Dis 2010,2:48-51
[4]Guiyang Jiang,Chuifeng Fan,Xiupeng Zhang,at el.Ascertaining an Appropriate Diagnostic Algorithm U-sing EGFR Mutation-Specific Antibodies to Detect EGFR Status in Non-Small-Cell Lung Cancer.PLoS ONE 2012,8(3):1-9
[5]何 艳,曹以诚.VEGF与肿瘤血管生成及其在抗肿瘤药物开发中的应用.生命科学,2008,20(2):222-224
[6]Kumar A,Petrie T,Halmos B,et al.Structure and clinical relevanceof the epidermal growth factor in human cancer.J Clin Oncol,2008,26(10):1742-1751
[7]Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-smallcell lung cancer harbouring mutationsof the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3 trial.Lancet Oncol,2010,11:121-128
[8]Scagliotti GV,Selvaggi G,Novello S,et a1.The biology of epidermal growth factor receptor in lung cancer.Clin Cancer Res,2004,10(2):4227-4232
[9]Chana SK,Gullicka WJ,Hill ME,et al.Mutations of the epidermal growth factor receptor in non-small cell lung cancer-Search and destroy.Eur J Cancer,2006,42(1):17-23
[10]吴胤瑛,李恩孝.VEGF在恶性肿瘤中的研究进展.现代肿瘤医学,2008,13(5):18-21
[11]陈川,俞德超,滕理.以 VEGF/VEGFR为靶点的抗肿瘤药物的研究进展.中国肿瘤生物治疗杂志,2007,14(3):291-300
[12]杜明伟,方长青,王秀茹等.血管内皮标记物及血管内皮生长因子在胸水细胞中的表达和意义.微生物学杂志,2012,32(4):47-52
[13]马军莉,胡云衢,蒲志贤.p53在非小细胞肺癌中表达的研究现状.2010,16(22):3399-3402

