转染及培养条件对外源性钙离子ATP酶SERCA1a表达的影响
王国丽 大宝贵嗣 山崎和生 Stefania Danko 铃木裕*
(1中国医科大学生物化学与分子生物学教研室,沈阳110001;2旭川医科大学生物化学讲座,日本 旭川078-8501)
SERCA1a是肌浆网内质网钙离子转运ATP酶 (sarco-endoplasmic calcium transporting ATPase,SERCA)的成人骨骼肌型,通过主动转运钙离子入肌浆网,维持细胞正常的钙离子浓度及梯度,保证肌肉收缩舒张的正常进行[1]。在应用突变法研究SERCA1a结构及功能关系时,有些变异型SERCA1a在真核细胞内表达后,无法提取足够的微粒体蛋白进行后续实验。为寻找SERCA1a表达的最适条件,解决这类蛋白质获取不足问题,本文通过比较COS1表达的外源性SERCA1a表达量及酶活性的检测结果,对细胞培养温度、时间、转染试剂用量以及携带兔SERCA1a cDNA的p MT2质粒的转染用量等可能影响SERCA1a表达的因素进行了评估。
材料和方法
1.一般材料
非洲绿猴肾细胞COS1细胞购自ATCC。DMEM、FBS、Lipofactamine、plus reagent购自Invitrogen。p MT2载体和p MT2-SERCA1a质粒获赠于加拿大多伦多大学D.H.Mac Lennan教授。其余试剂分别购自日本和光株式会社和Sigma公司。
2.细胞培养及转染
COS1细胞在10 cm培养皿中培养。培养基为含10%FBS的DMEM,无抗生素。培养箱设置100%湿度、5%CO2,常规培养温度为37℃。
细胞融合度70%左右进行转染。转染过程中使用无血清DMEM。常规每皿加入p MT2空质粒或p MT2-SERCA1a质粒 DNA 8μg、lipofactamine 60μl、plus reagent 40μl混合物孵育5 h。更换含血清的DMEM后,于37℃或者降低至34℃、31℃继续培养2至5 d。每皿DNA 4μg或lipofactamine 30μl、plus reagent 20μl的常规半量转染亦分别进行,转染后培养与常规全量转染后培养相同。
3.微粒体制备
将10 cm培养皿内贴壁生长的COS1细胞用5 ml PBS洗2次后收集至2 ml含5 mmol/l EDTA的PBS液,再用5 ml PBS洗1次。加2 ml低渗液(10 mmol/l Tris-HCl、p H 7.5、0.5 mmol/l MgCl2),10 min后加入蛋白酶抑制剂aprotinin 200μ和100 mmol/l PMSF 20μl,使用Dounce玻璃匀浆器匀浆40下。加入2 ml溶液A(蔗糖0.5 mol/l、β巯基乙醇6 mmol/l、CaCl240μmol/l、KCI 300 mmol/l、Tris-HCl 10 mmol/l,p H 7.5),继续匀浆20下,10000 g离心20 min。将上清与2.5 mol/l KCl 0.9 ml混匀,150000 g离心10 min(Himac CS 100FX,Hitachi)。微粒体沉淀用100μl溶液B混悬,零下80℃保存。溶液B成分为蔗糖0.25 mol/l、β巯基乙醇3 mmol/l、CaCl220μ mol/l、KCI 150 mmol/l、Tris-HCl 10 mmol/l,p H 7.5。离心在4℃进行,其它步骤均在低温实验室内冰上完成。
4.蛋白质定量
微粒体蛋白浓度的检测应用Lowry法,每样本或标准品设4平行孔,变异系数低于2%。
微粒体中的SERCA1a蛋白由双抗体夹心ELISA法定量。固相抗体为羊抗兔SERCA1a IgG,一抗为鼠SERCA1a单克隆抗体(MA3-911,Affinity Bioreagents),二抗为辣根过氧化物酶标记的羊抗鼠抗体IgG,底物为TMB(Life Technologies)。加入0.2 N硫酸终止显色反应,450 nm测吸光度。每个样本或每个浓度标准品均设5个平行孔。
5.SERCA1a蛋白特异的的Ca2+-ATP酶活性检测
应用同位素法对SERCA1a水解ATP的酶活性进行检测。ATP水解的速率在25℃测定。反应体系为50μl,含10μg/ml微粒体蛋白、50 mmol/l MOPS/Tris(p H 7.0)、0.1 mol/l KCl、7 mmol/l MgCl2、0.55 mmol/l CaCl2、0.5mmol/l EGTA、1μmol/l A23187、0.1 mmol/l[γ-32P]ATP。反应时间为5、10、15、20 min。萃取游离磷酸,进行β闪烁计数。其时间放射性曲线为直线,斜率即单位时间内被0.5μg微粒体蛋白水解的ATP量。上述ATP酶活性需减去非钙离子依赖的ATP酶活性,方为Ca2+依赖的ATP酶活性。非钙离子依赖的ATP酶活性检测体系含5 mmol/l EGTA,但不加CaCl2,其余同上。计算过表达的外源SERCA1a蛋白特异的Ca2+-ATP酶活性,还需要减去由p MT2空质粒转染细胞制备的对照微粒体蛋白的Ca2+-ATP酶活性本底,该本底为COS1细胞内源蛋白的Ca2+-ATP酶活性,低于外源性SERCA1a蛋白Ca2+-ATP酶活性的3%。
6.SERCA1a蛋白的EP生成量测定
EP生成量在0℃测定。反应体积为50μl,含50 μg/ml微粒体蛋白、50 mmol/l MOPS/Tris (p H 7.0)、0.1 mol/l KCl、7 mmol/l MgCl2、0.55 mmol/l CaCl2、0.5mmol/l EGTA、1 μmol/l A23187、0.01 mmol/l[γ-32P]ATP。反应10 s,加入15%TCA 及0.3 mol/l Pi。离心,5%SDS-PAGE分离沉淀蛋白质后,与标准品同时进行放射自显影定量。空质粒转染细胞的微粒体蛋白EP生成量做为本底被减去,其EP生成量低于含外源SERCA1a的微粒体蛋白的EP生成量的5%。
7.统计学分析
结 果
1.SERCA1a蛋白表达量检测
p MT2-SERCA1a质粒DNA转染细胞提取的微粒体蛋白含外源DNA过度表达的野生型SERCA1a(wild type,wt),而p MT2空质粒转染细胞提取的微粒体蛋白仅含内源性钙离子ATP酶SER-CA,故作为分析和计算的对照或本底(control,ct)。37℃培养的细胞微粒体蛋白的产量约为0.1 mg/皿,而其中SERCA1a的含量大致为1-2%。
质粒DNA转染用量、培养温度、培养时间对微粒体蛋白表达量及SERCA1a表达量的影响分别参见表1和图1。37℃培养的结果与34℃培养接近,不同条件的常规全量转染试剂转染的微粒体蛋白及SERCA1a定量结果与半量试剂转染结果无明显差异,故本文图表未列出37℃培养及常规全量试剂转染的具体数据。
Lowry定量结果(表1)表明,微粒体蛋白表达量在培养3至4 d达到高峰,培养温度变化对其无显著影响。培养1 d微粒体蛋白量随着培养温度升高而增长,符合细胞生长增殖与温度的正相关关系。培养5 d,4μg DNA转染细胞微粒体蛋白量明显高于8μg DNA转染细胞(P<0.01)。
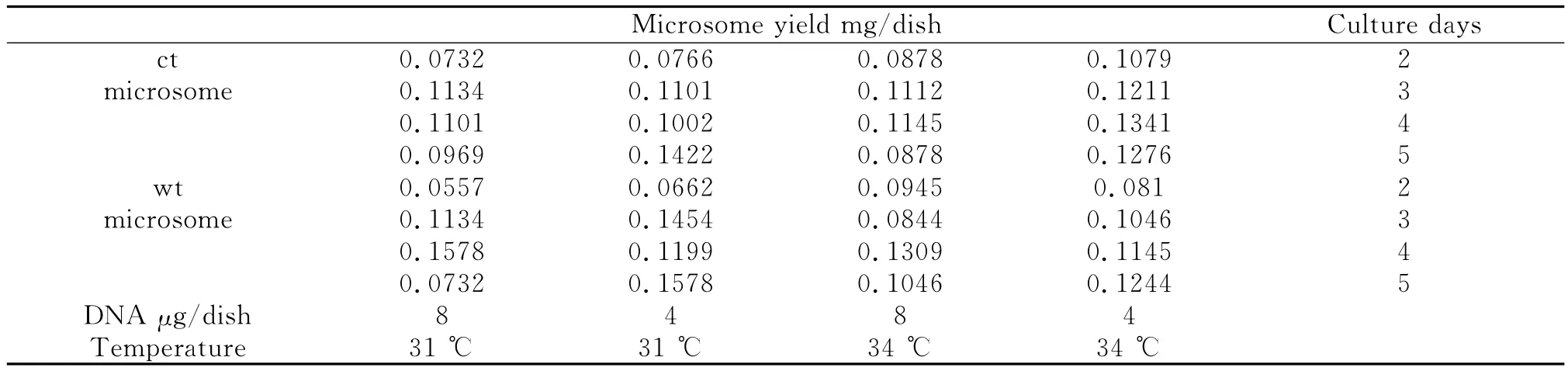
表1 Lowry法微粒体蛋白定量结果Table 1 Detection of microsomal proteins by Lowry method
ELISA检测结果(图1)显示降低细胞培养温度及提高DNA转染用量,可一定程度提高SERCA1a表达量。SERCA1a表达量在8μg DNA转染细胞31℃培养3 d最高,显著高于其他转染及培养条件下的SERCA1a表达量(P<0.01)。其他转染及培养条件均在4 d达到高峰。
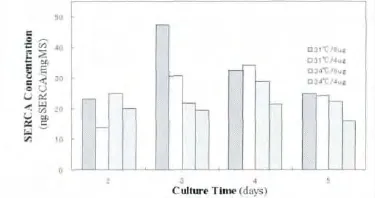
图1 微粒体蛋白中SERCA1a浓度的ELISA检测结果Fig.1 Detection of SERCA1a in microsomal proteins by ELISA
2.SERCA1a酶活性评估
34℃表达的SERCA1a的ATP酶活性显著高于31℃表达的SERCA1a(P<0.01,图2),但仍明显低于37℃表达的SERCA1a水解ATP的速度3.36±0.03 mol/min/mg(P<0.05)[2]。31℃表达的SERCA1a的ATP酶活性随着细胞培养时间延长而增加(P<0.01),此变化趋势在34℃不典型。37℃SERCA1a的ATP酶活性在细胞培养2至5 d期间无明显变化,亦不受其他转染及培养条件影响。
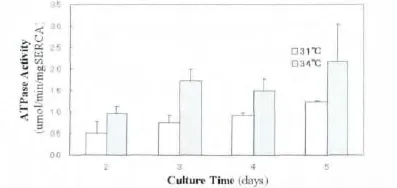
图2 SERCA特异性的钙离子ATP酶活性Fig.2 Specific Ca2+ATPase of SERCA
EP定量结果与ATP酶活性的结果的变化趋势基本一致(图3)。37℃表达的SERCA1a生成EP总量为3.31±0.41 nmol/mg2,显著高于31℃表达的SERCA1a(P<0.01),但是仅略高于34℃表达的SERCA1a,甚至略低于34℃培养5 d的细胞表达的SERCA1a。
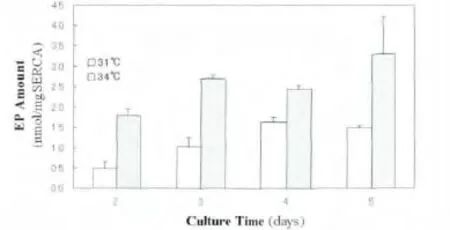
图3 SERCA1a的磷酸化酶中间体EP的生成水平Fig.3 Phosphorylation level of SERCA1a
讨 论
检测结果表明:微粒体蛋白量在细胞培养3至4 d达到高峰,改变转染及细胞培养条件,未见明显变化;降低细胞培养温度及提高DNA转染用量,可增加SERCA1a表达量,SERCA1a表达量在8μg DNA转染细胞31℃培养3 d达到最高;降低细胞培养温度后,SERCA1a的ATP酶活性及EP生成量也随之下降,并且ATP酶活性比EP生成量的下降幅度更大。在最低的细胞培养温度31℃,SERCA1a的ATP酶活性及EP生成量随着细胞培养时间延长而增加,而此趋势在34℃和37℃表达的SERCA1a却不明显。
通过一系列实验,可以确定瞬时转染COS1细胞表达外源SERCA1a蛋白的最适条件为常规的半量转染试剂、全量DNA、37℃培养3至4 d。不过全量DNA转染与半量DNA转染相比,SERCA1a表达量虽然最高可增至1.5倍,在质粒DNA量不十分充足时,增加培养皿的数目比单皿DNA用量加倍可收获更多SERCA1a蛋白。而应用常规半量转染试剂的优势则十分突出,比使用全量转染试剂经济,又在不减少SERCA1a产量的前提下,降低转染试剂对细胞的毒性。
我们的结果与Muerhoff AS.的报道接近,提示瞬时转染细胞在37℃培养3至4 d,细胞生长增殖达及外源蛋白的表达均达到高平台期[3]。然而在我们的实验中,发现了值得特别注意的现象,那就是降低细胞培养温度可以提高外源蛋白的产量,但是这些过度表达的SERCA1a的EP生成量降低,ATP酶活性的降低更加显著。在SERCA1a水解ATP转运钙离子的5步反应循环中[2],SERCA1a先被ATP磷酸化形成磷酸化的酶中间体EP,然后EP被水解释放有机磷酸,才能全部完成ATP水解成ADP和磷酸的反应(图4)。因此,低温表达的SERCA1a表达量增加,EP生成量降低,ATP酶活性的降低更多,可以用低温条件下蛋白错误折叠增加而蛋白降解相关蛋白的活性下降解释[4-6]。在31℃,细胞内错误折叠的SERCA1a增加,而细胞降解错误折叠和衰老蛋白质的能力下降,所以定位在内质网膜的SERCA1a有一部分结构异常,这部分蛋白质可能无法形成EP,即使形成EP,这些EP可能无法水解生成无机磷酸或者水解速度减低。31℃表达的SERCA1a的ATP酶活性及EP生成量随培养时间延长而的变化趋势从另一个角度支持上述观点。在31℃,蛋白正确折叠与蛋白降解相关蛋白的活性下降,然而随培养时间的延长,正确折叠蛋白质的比例及应降解蛋白质的降解总量不断增长,达到高平台期的时间晚于37℃和34℃,所以呈现5 d内SERCA1a的ATP酶活性及4 d内EP生成量随培养时间延长而增加的趋势。
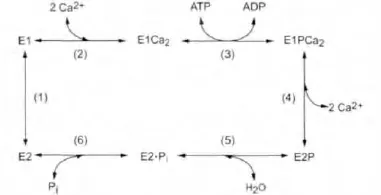
图4 SERCA1a反应循环模式图Fig.4 The reaction cycle of SERCA1a
综上所述,增加外源SERCA1a蛋白在COS1细胞内的表达可通过提高DNA转染用量实现。降低细胞培养温度虽可增加SERCA1a表达量,但引起SERCA1a蛋白的ATP酶活性和EP生成量下降。为获取足够的目的蛋白进行研究,对瞬时表达系统的转染及培养条件进行最适化是必要的。需要特别注意的是某些条件下部分过度表达的外源蛋白可能不具备正常的结构与功能。用蛋白定量替代蛋白的生物功能及生物效应监测的场合,需要谨慎地进行结论推断。
[1]鈴木裕.ポンプの構造/機能連関および遺伝子異常と細胞病態.生化学,2003,75(9):1215-1224
[2]Wang GL,Yamasaki K,Daiho T,et al.Critical hydrophobic interactions between phosphorylation and actuator domains of Ca2+-ATPase for hydrolysis of phosphorylated intermediate.J Biol Chem,2005,280:26508-26516
[3]Muerhoff AS,Dawson GJ,Dille B,et al.Enzyme-linked immunosorbent assays using recombinant envelope protein expressed in COS-1 and Drosophila S2 cells for detection of west Nile virus immunoglobulin M in serum or cerebrospinal fluid.Clin Diagn Lab Immun,2004,11(4):651-657
[4]Sapiess C,Beil A,Ehrmann M.A temperature-dependent switch from chaperone to protease in a widely conserved heat shock protein.Cell,1999,97(3):339-347
[5]Voges D,Zwick IP,Baumeister W.The 26S proteasome:a molecular machine designed for controlled proteolysis.Annu Rev Biochem,1999,68:1012-1068
[6]Lecker SH,Goldberg AL,Mitch WE.Protein degradation by the ubiquitin-proteasome pathway in normal and disease states.J Am Soc Nephrol,2006,17:1807-1819

