多种生姜有效成分联合提取工艺*
高晓东,王秋英,乔旭光,李锋,唐晓珍
1(山东农业大学食品科学与工程学院,山东泰安,271018)
2(山东省科学技术干部学校,山东济南,250100)
生姜是我国的传统优势和特色资源之一,在国际市场上占有非常重要的地位。我国生姜生产历史悠久,品质优良,但其产后加工技术水平比较低,多以原料的形式参与国际市场竞争,严重制约了我国生姜产业的发展,迫切需要高附加值的深加工产品来提升我国生姜深加工整体技术水平。
目前,生姜中已研究的主要成分有姜辣素、姜黄素以及生姜蛋白酶。姜辣素是生姜呈多种药理作用的主要功能因子[1],能清除自由基、抗氧化、抗突变、抗肿瘤、抗菌、抗病毒和调节免疫等功能[2-3]。姜黄素是植物界很稀少的具有二酮的色素,具有降糖、降脂、抗氧化、抗炎、抗癌等药理作用[4-6]。生姜蛋白酶被认为是木瓜蛋白酶家族的新成员[7],是一种非常有工业化应用前景的蛋白酶,可用于肉类嫩化[8]、酒类澄清[9],凝乳[10]、大豆分离蛋白[11]等,尤其能特异水解脯氨酸P2位含有脯氨酸的多肽和蛋白质,这种对脯氨酸的特殊亲和性使其在生化研究中成为一种很有前途的工具酶[12]。
生姜中各种有效成分具有较高的研究和应用价值,其提取分离的新工艺也不断发展,但多数都只是单独提取。本实验针对目前生姜中各种有效成分多为单独提取的现状,在综合各种生姜有效成分提取方法的基础上,对生姜多种有效成分的联合提取方法进行研究,以确定一次性提取生姜蛋白酶、姜黄素和姜辣素的适宜工艺,从而可充分利用生产原料,降低生产成本和时间,提高生产效率。
1 材料与方法
1.1 试验材料
莱芜大姜:由山东省莱芜市东兴源食品有限公司提供。
1.2 试验仪器
UV-2501PC型紫外-可见分光光度计,日本岛津公司;BS-150A电子天平,上海友声衡器有限公司;HH-6数显恒温水浴锅,江苏常州国华电器有限公司;酸度计,美国Thermo公司;TDL-5-A离心机,上海安亭科学仪器厂;RE52CS旋转蒸发器,上海亚荣生化仪器厂;SHZ-ⅢD型循环水真空泵,上海亚荣生化仪器厂;85-2型磁力搅拌器,郑州市亚荣仪器有限公司。
1.3 试验试剂
酪氨酸,无锡晶海氨基酸有限公司;香草醛,杭州中香化学有限公司;L-半胱氨酸、酪蛋白,美国Sigma公司;三氯乙酸,上海山浦化工有限公司;无水乙醇、NaOH、NaH2PO4、柠檬酸、乙二胺四乙酸二钠,天津市凯通化学试剂有限公司;Na2HPO4,天津市巴斯夫化工有限公司;H3PO4,上海中秦化学试剂有限公司;所用试剂均为分析纯。
1.4 实验方法
1.4.1 料液比的选择
取生姜100 g,用无水乙醇按料液比 1∶1、1∶2、1∶3、1∶4、1∶5(g∶mL)打浆,低温静置冷却后,离心 5 min(转速3 000 r/min),测定上清液中姜辣素与姜黄素的含量和沉淀中生姜蛋白酶的比活力,综合确定最佳料液比。
1.4.2 上清液的处理
1.4.2.1 旋蒸温度的选择
将无水乙醇打浆后的上清液加入旋蒸瓶,并按照40、50、60、70、80℃的梯度进行真空旋蒸,记录旋蒸时间,旋蒸后,上相馏分为姜辣素,测定其Abs 280 nm值,下相固体物为姜黄素,测定其Abs 425 nm值,确定最佳提取温度。
1.4.2.2 旋蒸转速的选择
在1.4.2.1确定的旋蒸温度下,分别按照16、32、48、64、80 r/min 的转速进行真空旋蒸,同样根据吸光度值确定旋蒸的最佳转速。
1.4.3 沉淀的处理
1.4.3.1 缓冲液pH值的选择
离心后的沉淀分别用 pH值为6.0、6.5、7.0、7.5、8.0 的 H3PO4缓冲液(0.05 mol/L,含 5 mmol/L EDTA,15 mmol/L L-Cysteine)按照 1∶4(g∶mL)进行复溶,搅拌混匀后过滤,弃残渣留上清液,测量清液体积,置清液于冰浴中,缓慢加入95%无水乙醇,使乙醇的终体积分数为60%,于冰浴中静置沉淀后,抽滤,称量沉淀质量,得湿酶粉。于4℃冰箱保存。测定酶活时,以湿酶粉∶∶柠檬酸-磷酸氢二钠缓冲液(0.05 mol/L、pH 6.0)=1∶10(g∶mL)的比例混合,待酶粉溶解完全,即得到酶液,根据比活力确定最佳缓冲液pH值[13]。酶液需现配现用。
1.4.3.2 冰浴时间的选择
根据1.4.3.1中确定的缓冲液pH值,重复以上操作,于冰浴中分别静置4、5、6、7、8 h 沉淀后,抽滤,称量沉淀质量,得湿酶粉,根据比活力确定最佳冰浴时间。
1.5 测定方法
1.5.1 生姜蛋白酶比活力的测定方法[14]
生姜蛋白酶比活力即生姜蛋白酶活力与总蛋白质含量的比值,单位U/mg。
1.5.1.1 蛋白质含量的测定
本实验采用Bradford Protein Assay(考马斯亮蓝G-250)法测定蛋白质浓度[14]。标准曲线方程为:y=97.142x-1.2932,R2=0.997,其中:x为样品的吸光度值(Abs 595nm);y为蛋白质浓度(μg/mL)。
1.5.1.2 生姜蛋白酶活力测定
生姜蛋白酶活力的定义:在40℃水浴条件下,酶促反应前5 min降解酪蛋白产生TCA(三氯乙酸)可溶的多肽增加量,以活性与灭活的生姜蛋白酶进行对照,根据酪氨酸标准方程,每增加1 μg/mL酪氨酸的值计量为一个酶活力单位。标准曲线方程为:y=802.92x-9.5212,R2=0.9995,其中:x为酶促反应样品的吸光度值(Abs 280nm);y为生姜蛋白酶活力值(U)[14]。
1.5.2 姜辣素含量的计算[15]
准确配制20 μg/mL的香草醛标准溶液,测得标准曲线方程为:y=12.946x+0.208,R2=0.999 1,其中:x为样品的吸光度值(Abs 280 nm);y为姜辣素含量(μg/mL)。姜辣素质量计算:
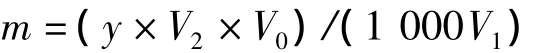
其中:m为姜辣素质量(mg);V0为上清液的体积(mL);V1为所取旋蒸液的体积(mL);V2为旋蒸出的姜辣素的体积(mL)。
1.5.3 姜黄素含量的计算[16]
准确配制100 μg/mL的姜黄素标准溶液,测得标准曲线方程为:y=6.346 9x-0.303,其中:x为样品的吸光度值(Abs 425 nm);y为姜黄素含量(μg/mL)。姜黄素质量计算:
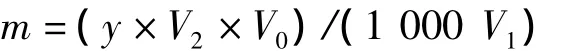
其中:m为姜黄素质量(mg);V0为上清液的体积(mL);V1为所取旋蒸液的体积(mL);V2为加入姜黄素的乙醇的体积(mL)。
1.6 数据分析
使用SPSS17.0软件对数据进行分析,实验结果均为3次结果的平均值。差异分析采用Ducan法进行分析比较。
2 结果与分析
2.1 最佳料液比的确定
由图1、图2可见,当料液比小于1∶3(g∶mL)时,随着料液比的增加,姜辣素、姜黄素的提取率以及生姜蛋白酶的比活力呈上升趋势,原因可能是在溶剂较少的情况下,打浆比较完全,成分溶出较多;而当料液比超过1∶3后,各指标随料液比的增加而降低,这是因为无水乙醇在打浆过程中起到沉淀蛋白质(包括酶)、浸提姜黄素等脂溶性物质的作用,无水乙醇用量的增加,一方面可以保证细胞内物质的溶出,使生姜蛋白酶充分沉淀,另一方面也会增加生姜蛋白酶变性失活的几率[13]。料液比为1∶3时,极显著(P<0.01)高于其他料液比,故选为最佳料液比。

图1 生姜蛋白酶比活力随料液比的变化Fig.1 Ginger proteas activity with the materials liquid radio changes
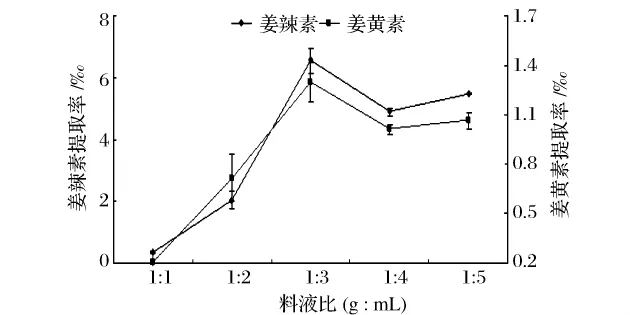
图2 姜辣素、姜黄素质量随料液比的变化Fig.2 Gingerol and Curcumin quality with the material liquid radio changes
2.2 最佳旋蒸温度的确定
由图3可以看出,姜辣素、姜黄素的提取率都随温度增加而显著升高(P<0.05),60℃时达到最高,随后姜黄素提取率缓慢下降(P>0.05),而姜辣素极显著降低(P<0.01),可见最佳旋蒸温度为60℃。
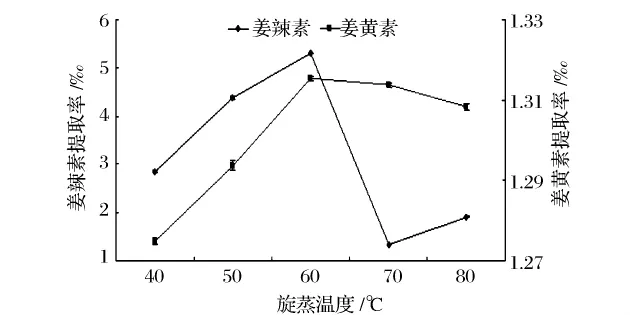
图3 旋蒸温度对姜辣素、姜黄素质量的影响Fig.3 Rotary evaporation temperature of Gingerol and Curcumin quality influence
2.3 最佳转速的确定
根据图4所示,姜辣素、姜黄素的提取率随转速的增加均呈降低趋势,可能是因为转速越大,旋蒸时间越短,收集不充分,导致测量值有所下降。同时本实验采用N-1100型旋转蒸发仪,最低转速为16 r/min,且在企业实际生产中旋转速度越高消耗成本越多,故确定最佳转速为16 r/min。
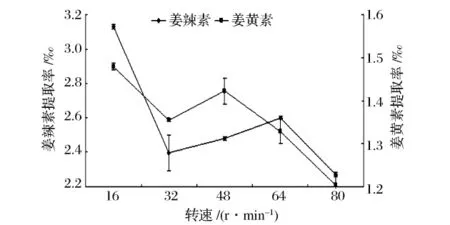
图4 旋蒸转速对姜辣素、姜黄素质量的影响Fig.4 Rotary evaporation speed of Gingerol and Curcumin quality influence
2.4 缓冲液pH值对生姜蛋白酶比活力的影响
由图5可见,生姜蛋白酶的比活力随复溶缓冲液pH值的增加而极显著升高(P<0.01),pH=6.5时达到最高,且极显著高于其他pH值(P<0.01),然后随着pH值的增加逐步降低,这可能是由于磷酸缓冲液复溶后的pH值过高或过低破坏了生姜蛋白酶的空间结构,并引起酶构象的改变,导致酶活力降低[17]。故最佳缓冲液pH值为6.5。

图5 生姜蛋白酶比活力随缓冲液pH值的变化Fig.5 Ginger protease activity with buffer solution pH value changes
2.5 冰浴时间对生姜蛋白酶比活力的影响
图6 显示,当冰浴时间低于5 h时酶产量很低,冰浴5h时生姜蛋白酶比活力最高,且显著高于其他时间(P<0.05),之后呈下降趋势。原因可能是由于冰浴过程中乙醇使蛋白质的二级结构和三级结构发生了改变或破坏,即蛋白质变性,使其理化性质改变和生物活性丧失,从而导致酶比活力降低[12]。所以最佳冰浴时间为5 h。
2.6 正交实验
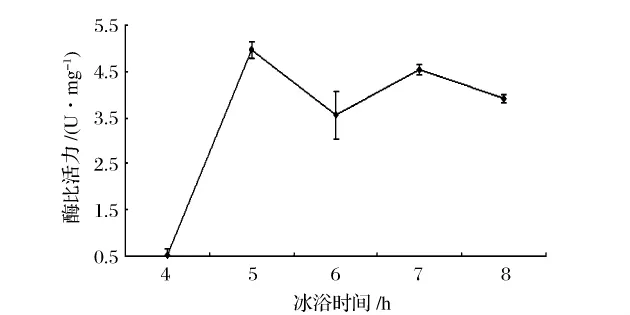
图6 生姜蛋白酶比活力随冰浴时间的变化Fig.6 Ginger protease activity with ice bath time changes
2.6.1 生姜蛋白酶L9(34)正交实验
根据单因素实验结果,选定生姜蛋白酶比活力正交实验的因素及水平如表1所示,正交实验表及结果如表2所示。

表1 生姜蛋白酶最佳提取方案因素水平表Table 1 The best extraction scheme of Ginger protease factor level table

表2 生姜蛋白酶L9(34)正交实验结果Table 2 Ginger protease L9(34)orthogonal experimental results
由表2极差分析结果可知,各因素对比活力的影响大小依次是A料液比>D冰浴时间>C缓冲液pH,最佳条件为 A2C2D2,即料液比1∶3,缓冲液最佳pH值为6.5,最佳冰浴时间为7 h,经验证生姜蛋白酶的得率为1.376%,比活力可达4 465 U/mg,大于正交表中最大值4 383 U/mg。
2.6.2 姜辣素、姜黄素L9(34)正交实验
根据单因素实验结果,选定姜辣素和姜黄素提取的正交实验因素及水平如表3,正交实验表及结果如表4所示。
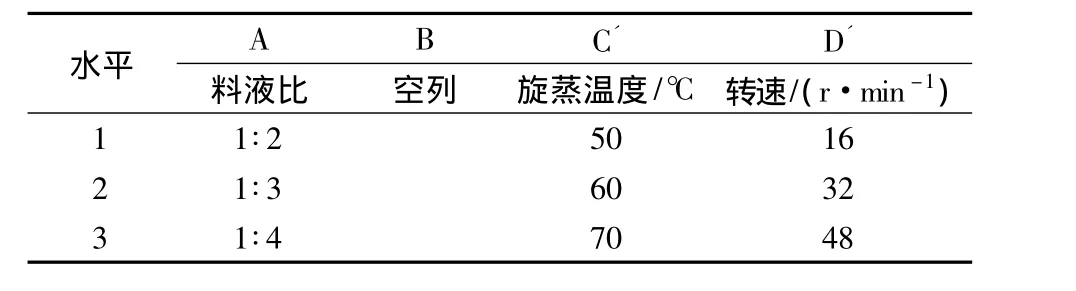
表3 姜辣素、姜黄素最佳提取方案因素水平表Table 3 Gingerol and Curcumin extraction scheme factor level table
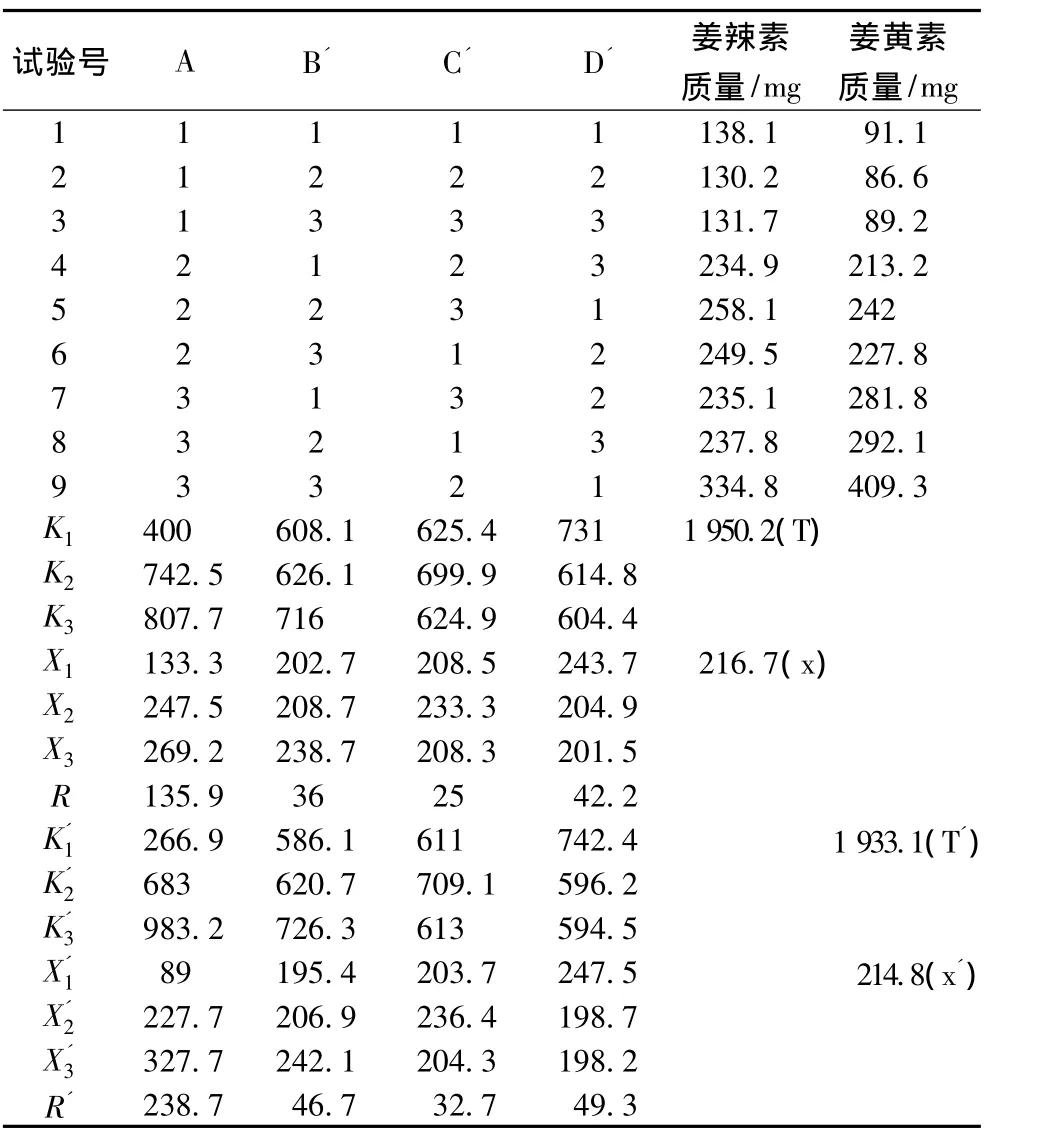
表4 姜辣素、姜黄素L9(34)正交实验结果Table 4 Gingerol and Curcumin L9(34)orthogonalexperimental results
由表4极差分析结果可知,各因素对提取率影响大小均依次为A料液比>D'转速>C'旋蒸温度,最佳条件为A3C'2D'1,即料液比1∶4,旋蒸温度60℃,转速16 r/min。在此条件下所得提取液的姜辣素、姜黄素质量与表4中实验9一致,每100 g分别为334.8 mg和409.3 mg,其提取率分别为0.334 8%和0.409 3%。由于姜辣素、姜黄素的R值较小,且生姜蛋白酶的市场价值与前两种成分相比更高,综合考虑实验结果最终确定生姜中3种有效成分同步提取的最佳条件为A2C2D2C'2D'1,即料液比1∶3,生姜蛋白酶提取的缓冲液pH为6.5,冰浴时间7h;姜辣素、姜黄素旋蒸温度60℃,转速16 r/min。在此条件下姜辣素、姜黄素的提取率分别为0.314 3%、0.388 9%,与最佳条件下提取率无显著差异。
3 结论
生姜中3种有效成分同步提取的最佳条件为A2C2D2C'2D'1,即料液比1∶3(g∶mL),生姜蛋白酶提取的缓冲液pH值为6.5,冰浴时间7 h;姜辣素、姜黄素旋蒸温度60℃,转速16 r/min。此条件下生姜中姜辣素、姜黄素的提取率分别为0.314 3%、0.388 9%;生姜蛋白酶的得率为1.376%,比活力达到4 465 U/mg。
[1] Ali B H,Blunden G,Tanira M O,et al.Some phytochemical,pharmacologicaland toxicological propertiesofginger(ZingiberofficinaleRoscoe):a review of recent research[J].Food and Chemical Toxicology,2008,46(2):409-420.
[2] Lee H S,Seo E Y,Kang N E,et al.[6]-Gingerol inhibits metastasis of MDA-MB-231 human breast cancer cells[J].The Journal of Nutritional Biochemistry,2008,19(5):313-319.
[3] El-Sharaky A S,Newairy A A,Kamel M A,et al.Protective effect of ginger extract against bromobenzene-induced hepatotoxicity in male rats[J].Food and Chemical Toxicology,2009,47(7):1 584-1 590.
[4] Weber W M,Hunsaker L A,Roybal C N,et al.Curcumin(diferuloylmethane)inhibits consititutive NF-kB activation,induce G1/S arrest,suppresses proliferation,and induces apoptosis in mantle cell lymphoma[J].Bioorganic &Medicinal Chemistry,2006,14:2 450.
[5] Chen A,Xu J,Johnson A C.Curcumin inhibits human colon cancer cell growth by suppressing gene expression of epidermal growth factor receptor through reducing the activity of the transcription factor Egr-1[J].Oncogene,2006,25:278.
[6] Shen S Q,Zhang Y,Xiang J J,et al.Protective effect of curcumin against liver warm ischemia/reperfusion injury in rat model is associated with regulation of heat shock protein and antioxidant enzymes [J].World J Gast roenterol,2007,13(13):1 953-1 961.
[7] Ichikawa Y,Sasa H,Michi K.Purification of Ginger Protease[J].Eiyo to Skokuryo,1973,26(6):377-383.
[8] 孙国梁,唐晓珍,孔凡敏,等.生姜蛋白酶嫩化牛肉效果的研究[J].食品工业科技,2008,29(3):244-248.
[9] 唐晓珍,黄雪松,乔聚林,等.生姜蛋白酶对啤酒的澄清效果[J].食品工业科技,2002,23(8):12-14.
[10] 张平平,黄雪松,刘宪华.姜汁凝乳的研究[J].中国乳品工业,1999,27(5):17-19.
[11] 周冬丽,盖钧镒,魏安池.酶法改性大豆分离蛋白研究进展及发展前景[J].粮食加工,2010,35(2):47-50.
[12] Chi K H.Amino acid sequence and glycan structures of cysteine prodease specificity from girger rhizone Zirglber officinale[J].Eur J Biochem ,2000 ,267:1 516-1 526.
[13] 杜新永.生姜蛋白酶分离纯化及品种间差异性比较[D].泰安:山东农业大学,2010.
[14] 代景泉.生姜蛋白酶的分离纯化及其部分特性的研究[D].泰安:山东农业大学,2002.
[15] 曾凡逵.生姜姜辣素的提取与分析[D].广州:暨南大学硕士学位论文,2006:17-18.
[16] 牛生洋,郝峰鸽,许秋亚.姜黄素的提取及应用研究进展[J]. 河南科技学院学报,2008,36(4):58-61.
[17] 游庆红,尹秀莲.生姜蛋白酶的分离纯化及其酶学性质初步研究[J].中国酿造,2010(4):98-100.

