胶质芽孢杆菌胞外多糖的制备及流变学特性
李洁,窦文芳,李会,史劲松,许正宏,李华钟
1(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)2(江南大学 医药学院,江苏 无锡,214122)
微生物胞外多糖是一种长链的大分子聚合物,具有独特的物理性质、流变学特性和较好的安全性,生产不受地域生态环境和季节因素的影响,在食品、日化、纺织、医药和废水处理等领域的应用潜能日益引起人们的关注[1]。目前已应用于食品领域的微生物胞外多糖有透明质酸、黄原胶、阿拉伯胶、细菌纤维素、小核菌葡聚糖、短梗霉多糖、热凝多糖等[2]。随着微生物胞外多糖应用领域的不断拓宽,每年对多糖的需求量不断增大,越来越多的国内外学者致力于开发和研究具有应用潜能的微生物胞外多糖。
胶质芽孢杆菌胞外多糖(EPS)是一种由胶质芽孢杆菌(Bacillus mucilaginosus)在微氮培养基上产生的高黏性荚膜多糖。研究表明EPS在矿业、农业、化工等领域已有广泛的应用,周吉奎等人报道[3]EPS可作为生物矿化剂,释放含钾及磷矿物中的钾、磷及其它灰分;连宾等人报道[4]EPS既可作为一种高效、无毒、无二次污染的生物絮凝剂;同时EPS还可作为陶瓷工业的添加剂,改善高岭土的弯曲强度和其它性质等。目前关于发酵法制备EPS及其性质的研究鲜见报道,这使其在食品、精细化工、制药、印染等相关领域的应用受到限制,因此研究其生物合成、结构、物理化学特性就显得尤为重要。
本实验室前期从自然界中筛选获得1株具有良好生产EPS能力的胶质芽孢杆菌SM-01(保藏号为CGMCC5766)。该菌在以蔗糖、尿素为碳氮源及一些无机盐组成的培养基中发酵产生高黏性发酵液,经乙醇沉淀、离心、干燥,得到EPS干品。EPS溶液在低浓度时即具有很高的黏度、优良的流变学特性与稳定性。EPS分子质量相对均一(约600万Da),该特点明显优于其他已工业化应用的黄原胶、威兰胶、细菌纤维素等多糖,可简化后期分离纯化过程。本文主要研究了EPS的发酵过程、制备方法及流变学特性,这是其流变学特性研究的首次报道,为EPS作为增稠剂、悬浮剂、乳化剂、稳定剂等应用于食品和日化领域提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种及试剂
菌株Bacillus mucilaginosus SM-01,江南大学医药学院制药工程实验室分离并保藏;间羟基联苯,购自西域公司;浓H2SO4、四硼酸钠、NaOH、无水乙醇等化学试剂均为国产分析纯。
1.1.2 培养基
(1)斜面培养基(L):蔗糖10 g,(NH4)2SO40.1 g,CaCO32 g,MgSO4·7H2O 0.2 g,K2HPO40.2 g,NaCl 0.2 g,琼脂 15 g,pH 7.0 ~7.2。
(2)种子培养基(L):蔗糖 10 g,尿素 0.1 g,Ca-CO35 g,MgSO4·7H2O 0.2 g,K2HPO40.2 g,NaCl 0.2 g,pH 7.0 ~7.2。
(3)发酵培养基(L):蔗糖 60 g,尿素 0.3 g,Ca-CO35 g,MgSO4·7H2O 0.6 g,K2HPO40.2 g,NaCl 0.4 g,pH 7.0 ~7.2。
1.2 仪器与设备
722型分光光度计,尤尼可上海仪器有限公司;CR22GII冷冻高速离心机,日本日立公司;SPX-250型生化培养箱,上海跃进医疗器械厂;真空冷冻干燥机,美国Labconco公司;DK-8D型电热恒温水浴锅,上海医用恒温设备厂;DV-C黏度计,美国Brookfield公司。
1.3 实验方法
1.3.1 胶质芽孢杆菌的培养
将斜面保藏的菌种于平板上划线,30℃恒温培养24 h,活化2次,将活化后的种子接种到种子培养基中,32℃、200 r/min培养24~28 h,再将此种子按4%的接种量接入到5 L罐中,30℃、500 r/min、1 vvm发酵培养68 h,定时取样测定菌浓、多糖产量、pH并获取发酵液。
1.3.2 EPS的的分离提取
发酵液→稀释2~3倍→离心(20 min,8 000 r/min,4℃)→浓缩上清液→加入3倍体积95%的乙醇→4℃静置过夜→离心(10 min,5 000 r/min,4℃)→沉淀复溶→乙醇重复抽提→冷冻干燥所得沉淀→多糖
1.3.3 测定方法
① 菌浓测定:取发酵液1 mL,稀释2~4倍,725型分光光度计在600 nm下测其吸光值。
②多糖含量的测定:精确称取1 g发酵液,稀释2倍,8 000 r/min离心10 min去除菌体,上清液中加入2倍质量的95%乙醇,充分振荡至出现絮状沉淀,4℃保温过夜,离心去除上清液得粗品,沉淀物60℃真空干燥至恒重,电子天平称重。
③pH测定:采用精密pH计测定。
1.3.4 EPS溶液流变学特性测定
准确称取一定量经冷冻干燥的EPS,充分溶解,配制成0.5%的溶液,分别测定不同转速(0.3~100 r/min)、质量浓度(1.0~5.0 g/L)、剪切时间(0~900 s)、温度(25℃,40℃,60℃,80℃,100℃)、pH 值(2,3,5,7,9,11)、无 机 盐 (NaCl,KCl,CaCl2,MgCl2,Pb(NO3)2,FeCl3)、其它生物高分子多糖(海藻酸钠,瓜尔胶,槐豆胶,阿拉伯胶,黄原胶)对其表观黏度的影响。
实验中表观黏度的测定,采用DV-C黏度计于25℃、2号转子、20 r/min条件下进行,2 min后待读数稳定读出其黏度值。黏度相对值的计算公式:

2 结果与分析
2.1 SM-01胞外多糖发酵及制备
在含蔗糖60 g/L、尿素0.3 g/L及其一些无机盐组成的培养基中,对SM-01进行5 L发酵罐培养,分析发酵过程中的pH、菌浓、EPS产量的变化。结果表明(图1),0~12 h为菌体缓慢生长的延迟期;12~48 h为菌体快速生长的对数期,菌浓在48 h时达到最大,OD600为2.8;48~60 h为菌体生长的稳定期,EPS在60 h时可达到最大值23.46 g/L,表明此菌的生长与代谢产物多糖合成表现为生长偶联的关系;从整个发酵过程的pH值变化来看,虽然培养基中加入了CaCO3,但pH值仍略呈下降趋势,推测菌体在生长过程会产酸;发酵60 h后,菌体开始进入衰亡期,菌浓和多糖产量均有所下降,可能是由于培养基黏度增大导致供氧不足造成的。由于多糖的积累不利于菌浓的提高,因此可以借鉴许喜林等[5]采用的“先用氮源丰富的培养基提高生物量,再于无氮培养基中发酵积累黄原胶”的方法,提高EPS的产量。根据1.3.2中EPS的分离提取方法可得到海绵状EPS固体,其回收率可达76.7%。
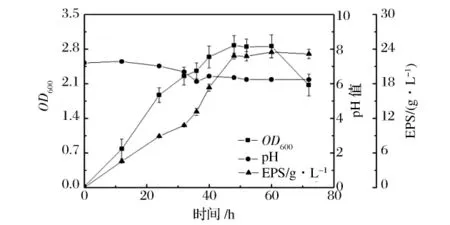
图1 胶质芽孢杆菌SM-01产多糖的发酵过程曲线Fig.1 The curve of growth of SM-01
2.2 EPS溶液流变学特性的研究
2.2.1 剪切速率对EPS溶液黏度的影响
研究了不同转速对0.5%EPS溶液黏度的影响。结果表明(图2),0.5%的EPS溶液符合典型的非牛顿流体的假塑性行为特征——对剪切力敏感,随着剪切速率的增加,溶液黏度显著下降[6]。由于该多糖的分子质量在600万Da以上,溶液在静止或低转速时分子会相互缠结黏度较大;随着转速的增大,分子间的剪切应力变大,就出现表观黏度随剪切速率减小的假塑性,这一性质与威兰胶和透明质酸等相似[7-8]。
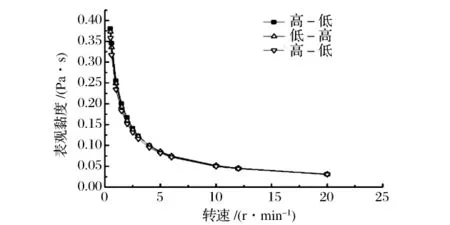
图2 剪切速率对EPS溶液黏度的影响Fig.2 Effects of shearing rate on viscosity
2.2.2 浓度对EPS溶液黏度的影响
研究了不同质量浓度EPS溶液黏度的变化。结果表明(图3),在25℃、2号转子、20 r/min的条件下,0.1%的溶液黏度约为0.017 Pa·s,而0.5%的溶液黏度就已达到0.133 Pa·s,黏度提高了约100倍。同时经测定2%的溶液已趋于凝胶化,流动性很差。可能是因为EPS质量浓度的增大加强了多糖链之间的相互作用,从而使溶液黏度提高[9]。
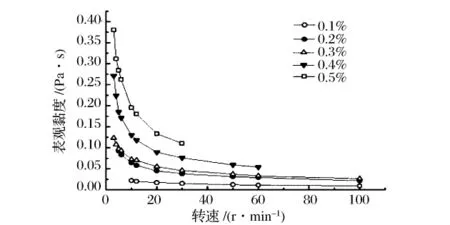
图3 浓度对EPS溶液黏度的影响Fig.3 Effect of EPS concentration on EPS solution viscosity
对于非牛顿流体而言,黏度和剪切速率(或转速)之间的关系可以用Ostward-dewele的幂律黏度模型表示,其表达式为:ηα=K·γ(n-1)[10],当溶液浓度由0.1%增加到0.5%时,对图3中的曲线进行拟合,可以得到K值从0.053增加到0.672;n值从0.62降低到0.47,表明EPS溶液黏度越大假塑性越强(图3)。
2.2.3 剪切时间对EPS溶液黏度的影响
研究了不同的剪切时间对0.5%的EPS溶液黏度的影响。如图4所示,在0~900 s的范围内0.5%的EPS溶液黏度维持在0.133~0.136 Pa·s,可见EPS溶液黏度随剪切时间的延长基本不发生变化。表明多糖分子与水分子以及多糖分子之间的相互作用相对稳定,其稳定性优于乳酸菌所产多糖[11]。此外,还研究了EPS溶液长期静置后的黏度变化。结果表明,20℃下静置60 d后,EPS溶液黏度变化在2.0%以内,表现出良好的贮存稳定性。因此,将EPS作为溶液增稠剂或颗粒分散剂有一定的优势。
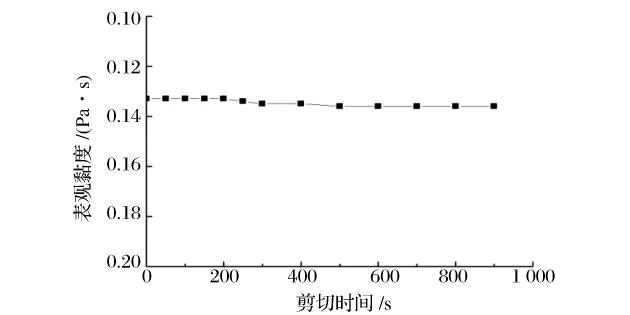
图4 剪切时间对EPS溶液黏度的影响Fig.4 Effects of shearing time on viscosity
2.2.4 温度对EPS溶液黏度的影响
研究0.5%的EPS溶液在25~100℃表观黏度的变化情况,为确保实验结果的准确性,将表观黏度换算成黏度相对值(图5)。结果显示,溶液表观黏度随着温度升高降低较为缓慢,当温度再次降至25℃时,黏度能够基本恢复;但0.5%的EPS溶液在100℃加热30 min后,表观黏度会从0.38 Pa·s下降到0.08 Pa·s,黏度会下降67%。表明长时间高温加热可以降低大分子多糖的分子量或者改变其分子结构,分子无规则卷曲解体,从而使溶液的黏度下降[12]。因此,当EPS应用于食品行业时,应选择高温瞬时灭菌[13]。
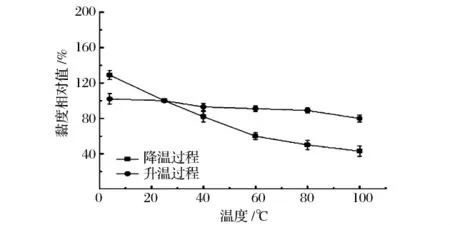
图5 温度对EPS溶液黏度的影响Fig.5 Effects of temperature on viscosity
2.2.5 pH对EPS溶液黏度的影响
研究EPS溶液的表观黏度在pH 2~11的变化情况(图6)。结果显示,在中性范围内溶液黏度保持相对稳定,而在酸性或较强的碱性条件下,黏度有较大幅度的变化。如pH=2时溶液黏度相对值约为65%,当体系pH >12时,EPS溶液呈现弱凝胶化,推测大分子之间的相互作用发生了根本改变[14]。EPS在碱性条件下形成凝胶的特性与海藻酸钠、阿拉伯胶、刺槐豆胶及黄原胶等生物高分子多糖极为相似[15]。
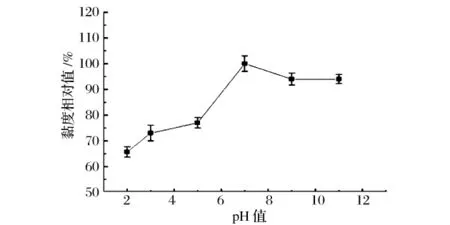
图6 pH值对EPS溶液黏度的影响Fig.6 Effects of pH on viscosity
2.2.6 无机盐种类对EPS溶液黏度的影响
研究 NaCl、MgCl2、CaCl2、KCl、FeCl3、Pb(NO3)2分别为1%,3%,5%,7%时对EPS溶液表观黏度的影响,并将表观黏度值换算成黏度相对值。结果显示(表1),不同无机盐离子的加入均会导致溶液表观黏度的下降,并且随着离子浓度的增加其黏度呈下降趋势,其中Mg2+和Ca2+导致溶液表观黏度下降的趋势更加显著。表明无机盐可能会降低EPS溶液分子间的电荷力,造成溶液黏度下降。同时研究中还发现,钙、镁盐可以与EPS在pH >11的情况下形成凝胶;中性pH范围内,FeCl3和Pb(NO3)2加入到EPS溶液后会促进多糖絮凝,出现橘黄色和白色沉淀,这与黄原胶的性质很相似[14]。有报道大分子多糖在工业废水处理中已显示出了广阔的应用前景[16-17]。并且实验已经证实了EPS溶液确实具有良好的絮凝效果,后续试验也已经展开。

表1 无机盐对EPS溶液黏度的影响Table 1 Effects of inorganic salt on viscosity
2.2.7 其他多糖胶对EPS溶液黏度的影响
分别将浓度为0.5%的海藻酸钠、阿拉伯胶、瓜尔胶、黄原胶、槐豆胶溶液与同浓度的EPS溶液1∶1复配,复配溶液黏度均增加,其中EPS与阿拉伯胶复配后黏度提高了近1倍(表2)。表明EPS中的双螺旋结构易和含β-1,4键的其它多糖分子发生不同程度的嵌合作用,造成复配后溶液黏度发成不同程度的提高[17]。因此如将多糖复配后开发用于食品行业,既可以减少糖的用量又可以达到很好的增稠效果;同时EPS与壳聚糖溶液混合后会产生沉淀,在这一点上EPS与其它阴离子多糖性质一致[11]。

表2 EPS与其它种类多糖复配后溶液黏度的变化Table 2 Effects of other EPSs on viscosity
3 结论
本文利用实验室保藏的1株胶质芽孢杆菌SM-01发酵生产多糖(EPS),5L发酵罐发酵后EPS的产量最高可达23.46 g/L,发酵液经稀释、离心、醇沉后EPS的回收率为76.7%。
本文是国内外关于胶质芽孢杆菌胞外多糖(EPS)流变学特性研究的首次报道,为拓宽EPS的应用领域有重要意义。EPS是一种高分子量、高黏度多聚物,其水溶液表现为典型的非牛顿流体特性,具有良好的流变学特性;在25~100℃ EPS溶液具有良好的耐热性;该溶液在微酸性、中性和微碱性条件下黏度相对稳定,这符合日化行业对pH的要求,因此EPS可作为增稠剂、悬浮剂、保湿剂和乳化剂应用于化妆品行业。EPS与其它食品中广泛应用的多糖复配时有很好的协效性,此优良特性使多糖在食品方面有也具有很广阔的应用前景。
[1] Canquil N,Villarroelm,BravoS,et al.Behavior of the rheological parameters of exopolysaccharides synthesized by three lactic acid bacteria[J].Carbohydrate Polymers,2007,68(2):270-279.
[2] Kumar AS,Mody K,Jha B.Bacterial exopolysaccharidesa perception [J].Journal of Basic Microbiology,2007,47(2):103-117.
[3] 周吉奎,胡岳华,邱冠周.硅酸盐细菌在矿物工程领域应用研究进展[J].金属矿山,2002(1):26-28.
[4] 连宾,陈烨,袁生等.硅酸盐细菌GY03菌株的絮凝特性[J].矿物学报,2003(4):303-307.
[5] 许喜林,司徒海峰,陈维钧.除细胞法产生黄原胶[J].食品科学,1998,25(1):11-15.
[6] Abuin A G,Diaz D G,Navazm JM,et al.Viscosimetric behaviour of hyaluronic acid in different aqueous solutions[J].Carbohydrate Polymers,2011,85(3):500-505.
[7] 陈芳,李建科,徐昶.新型微生物多糖—韦兰胶的流变特性影响因素研究[J].食品科学,2007,28(9):49-52.
[8] Isobe Y K,Endo K J,Kawai H.Properties of a highly viscous polysaccharide produced by a bacillus strain isolated from soil[J].Biosci Biotech Biochem,1992,56(4):636-639.
[9] Vitor D,Alves,F F,Cristiana A V.et al.Rheological and morphological of the culture broth during exopolysaccharide production by Enterobacter sp.[J].Carbohydrate Polymers,2010,48(3):758-764.
[10] 贾薇,郑志永,刘汝冰,等.一种新型微生物多糖流变学初探[J].食品科学,2009,30(1):135-138.
[11] Diaz D G,Navaza J M,Riveio L C Q.Intrinsic viscosity and flow behavior of arabic gum aqueous solutions[J].International Journal of Food Properties,2008,11(4):773-780.
[12] 周林,郭祀远,蔡妙颜,等.裂褶菌胞外多糖的黏度性质及其构象研究[J].食品与发酵工业,2005,31(11):1-5.
[13] 杨贞耐,张雪.乳酸菌胞外多糖的流变学特性和分子结构修饰[J].食品科学,2007,28(12):535-538.
[14] Kang KS,Pettit DJ.Industrial gums[M].New York:AcademicPress,1993:341-398.
[15] Bin L,Chen Y.Microbial flocculation by Bacillus mucilaginosus,applications and mechanisms[J].Bioresource Technology,2008,99(11):4825-483.
[16] Deng S B,Bai R B.Characteristics of a bioflocculant produced by Bacillus mucilaginosusand its use in starch wastewater treatment[J].Applied Microbiology and Biotechnology,2003,60(5):588-593.
[17] 陈志行,周莉,陈小辉.黄原胶与魔芋胶混胶黏度的影响因素研究[J].食品与机械,2003(1):14-16.

