液相色谱-电喷雾飞行时间质谱法同时测定虫生真菌菌丝中16种游离氨基酸*
刘肖肖,李淑林,陆瑞利,罗飞飞,胡丰林
1(安徽农业大学微生物防治省重点实验室,安徽合肥,230036)
2(安徽农业大学应用化学系,安徽合肥,230036)
虫生真菌(entomogeneous fungi)是一种以昆虫为寄主的内生真菌,具有有性型和无性型两种存在形式。虫草属中的冬虫夏草(Cordyceps sinensis)和蛹虫草(Cordyceps militaris)以及它们的无性型中国被毛孢(Hirsutella sinensis)和蛹拟青霉(Paecilomyces militari)[1-2]已被广泛地用于保健食品和药品[3-4]。目前关于虫草及其无性型的研究主要集中在甘露醇、核苷、多糖、抗氧化和抗肿瘤等活性成分[5-7],而缺乏对虫草及其无性型中的游离氨基酸组成的系统研究。游离氨基酸是食品中可以被人体直接吸收的重要营养物质,同时又是食品中主要的风味物质,因此,测定虫草及其无性型中各种游离氨基酸的含量,将可作为评价该类真菌的食用和保健价值的重要指标。
由于多数氨基酸不具有紫外吸收和荧光检测的发色基团,所以当用传统的液相色谱或氨基酸分析仪测定氨基酸含量时,首先要对氨基酸进行衍生化处理,分析过程较复杂[8],同时衍生化处理容易形成非目标衍生物,从而影响氨基酸测定的准确性。相比较而言,近年来应用越来越普及的液相色谱与飞行时间质谱联用技术[9-10],具有较高的分辨率和检测的灵敏度,对样品的检测限可以达到纳克级,远高于普通的HPLC方法;同时能够对样品中特定组分单独提取分析,可有效地避免在HPLC上出现的重叠峰的干扰;样品无需进行衍生化处理,实验过程简单,准确性高,然而目前尚无以之对虫生真菌中游离氨基酸进行分析检测的报道。因此,本文拟采用液相色谱-电喷雾飞行时间质谱(LC-ESI-TOF-MS)联用分析法,建立一种简捷,高效及高灵敏度的测定虫生真菌中游离氨基酸含量的方法,为虫生真菌中游离氨基酸的检测、资源利用和食用质量评价提供技术参考和理论依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 供试菌株
中国被毛孢(Hirsutella sinensis)菌株号为RCEF5042;蛹拟青霉(Paecilomyces militari)菌株号为RCEF0720;古尼拟青霉(Paecilomyces gunnii)菌株号为RCEF0199;蝉棒束孢(Isaria cicadae)菌株号为RCEF4777;细脚棒束孢(Isaria tenuip)菌株号为RCEF4256;戴氏绿僵菌(Metarhizikum taii)菌株号为RCEF4127;粉被玛利亚霉(Mariannaea puinosa)菌株号为RCEF4695,由安徽农业大学虫生真菌研究中心提供。
1.1.2 材料与试剂
色谱纯甲醇,色谱纯乙腈,色谱纯甲酸,均购于美国Tedia公司;16种氨基酸(分析纯):脯氨酸(Pro),缬氨酸(Val),亮氨酸(Leu),异亮氨酸(Ile),赖氨酸(Lys),甲硫氨酸(Met),组氨酸(His),苯丙氨酸(Phe),精氨酸(Arg),酪氨酸(Tyr),色氨酸(Try),丝氨酸(Ser),苏氨酸(Thr),胱氨酸(Cys),天冬氨酸(Asp),谷氨酸(Glu),购于中国药品生物制品鉴定所。
1.1.3 主要仪器
高分辨液质联用分析仪(Agilent 6210 time of flight LC/MS),包括 Agilent1100高效液相色谱(HPLC),二极管阵列检测器(DAD),飞行时间质谱仪(TOF)和电喷雾离子源(ESI),购于美国Agilent公司;供试分析型高效液相色谱柱有Agilent Eclipse XDB-C18(2.1 mm ×150 mm,5μm)、Waters Xterra MS C18(2.1 mm ×150 mm,3.5μm)和 Phenomenex Synergi Hydro-RP(4.6mm ×250mm,4μm),分别购于Agilent、Waters和 Phenomenex公司;AN0635 电子天平,购于上海民桥精密科学仪器公司;FreeZone12冷冻干燥系统,购于美国Labonconco公司;2K-15超速离心机,购于Sigma公司;KQ5 200DE型数控超声波清洗器,购于昆山市超声仪器有限公司;SimplicityRUV超纯水系统,购于Millipore公司。
1.2 方法
1.2.1 标准溶液的配置
精确称取16种氨基酸标准品,溶解于30%的甲醇水溶液,分别得到混合标准溶液Ⅰ(含脯氨酸(Pro),缬氨酸(Val),亮氨酸(Leu),异亮氨酸(Ile),赖氨酸(Lys),甲硫氨酸(Met),苯丙氨酸(Phe)和精氨酸(Arg),它们的浓度均为500 μmol/L);混合标准溶液Ⅱ(含丝氨酸(Ser),苏氨酸(Thr),胱氨酸(Cys),组氨酸(His),天冬氨酸(Asp),谷氨酸(Glu),酪氨酸(Tyr)和色氨酸(Try),它们的浓度均为125 μmol/L)。这些标样在测定前用30%的甲醇水溶液(含0.1%甲酸)稀释成系列浓度的标准溶液,以进行标准曲线绘制。
1.2.2 样品前处理
精确称取各虫生真菌固体培养菌丝体的冻干粉200 mg,溶于4 mL 30%的甲醇水溶液(含0.1%甲酸),25℃超声提取30 min,1 2000 r/min离心10 min取上清液,即得50 mg/mL的待测样品溶液。制备好的氨基酸标准溶液及样品溶液在4℃暂存备用,保存时间不得超过 24 h[10-11]。
1.2.3 色谱条件
进样体积:5 μL;流速:0.60 mL/min;柱温箱:25℃;供试流动相体系为含0.1%甲酸的甲醇水体系和乙腈水体系,采用梯度洗脱,洗脱梯度为:0~8 min由100%的流动相A(水相)洗脱;8~15 min流动相B(有机相)比例由0%增加到15%;15~23 min流动相B由15%增加到20%;23~30 min流动相B由20%增加到50%。
1.2.4 质谱条件
电喷雾(ESI)离子源的雾化气压:0.24 MPa(35psi);氮气流速:12.0 L/min;毛细管温度:325℃;离子扫描范围(m/z):50~1000;阴离子模式下离子化电压:3 500 V;碎片电压:175 V;阳离子模式下离子化电压:4 000 V;碎片电压:250 V。
2 结果与分析
2.1 色谱柱及色谱条件初步选择
由于氨基酸是极性较强的化合物,因此初步选择了3个适合极性化合物分析的高效液相色谱柱进行初步比较,结果发现当以Phenomenex Synergi Hydro-RP色谱柱,以乙腈水为流动相时分离效果最好。具体流动相条件为:A相为0.1%甲酸水溶液;B相为0.1%甲酸乙腈溶液;流动相梯度为:0~8 min用100%A相洗脱;8~15 min B相由0%增加到15%;15~23 min B相由15%增加到20%;23~30 min B相由20%增加到50%。
2.2 质谱条件的确定
实验分别测定了16种氨基酸在阳离子模式和阴离子模式下的电离情况,结果显示:16种氨基酸标准品在阳离子模式下的主要离子碎片为脱羧基、脱氨基和脱水后形成的离子,即[M-HCOOH+H]+、[MH2O+H]+或[M-NH3+H]+;同时,含支链氨基酸的支链会发生不同程度的断裂,芳香类氨基酸还会产生多种苯基离子碎片,离子种类较复杂,不利于定量分析。而在阴离子模式下,16种氨基酸的离子碎片主要为准分子离子峰[M-H]-,离子碎片专一,稳定性高,增加了检测的灵敏度和定量范围,可见采用阴离子分析模式较好。
阴离子模式下测定的16种标准氨基酸的质谱参数见表1。

表1 16种氨基酸在阴离子模式下的质谱参数Table 1 Mass spectra data of 16 amino acids detected under negative ionization mode
2.3 氨基酸标准品的定性及定量分析
2.3.1 氨基酸标准品的定性分析
在阴离子模式下,将16种氨基酸标准溶液单独进样得到各种氨基酸准确的质谱图(见图1)。根据质谱图提供的离子碎片,可确定各氨基酸最优的定量离子均为准分子离子峰(见表1)。虽然亮氨酸和异亮氨酸具有相同的分子离子,但亮氨酸和异亮氨酸的出峰时间不同,先出峰为异亮氨酸,据此可对二者进行准确分析。此外,缬氨酸的准分子离子(m/z)为116.072与色氨酸的吲哚基离子(m/z:116.050)质荷比接近,但二者的色谱保留时间不同,因此可准确区分。总之,在阴离子模式下16种氨基酸都可以达到定量测定的要求。氨基酸标准溶液中提取的16种氨基酸的离子流图如图2所示。
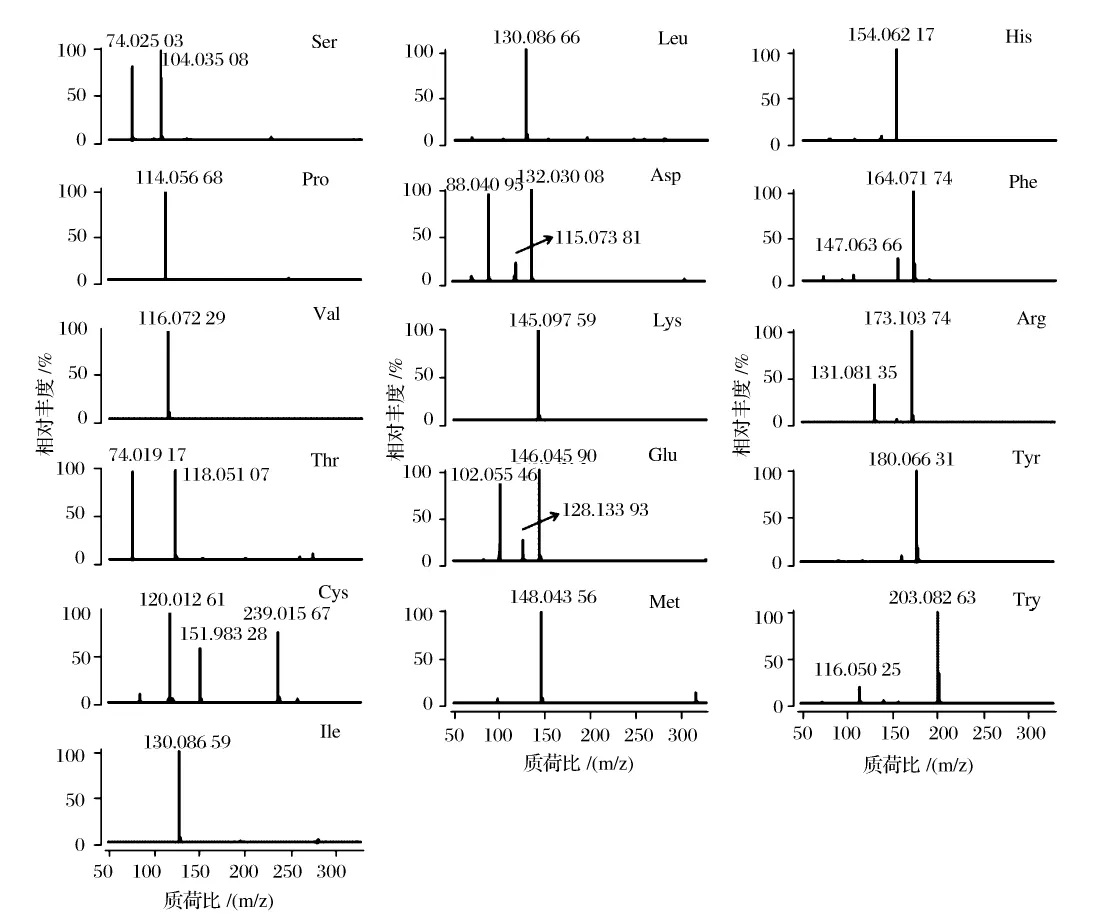
图1 阴离子模式下16种氨基酸的质谱图Fig.1 Mass spectra of 16 amino acids detected under negative ionization mode
2.3.2 氨基酸标准品的定量分析
将2.1中配置的氨基酸系列标准溶液,按相应的质谱条件依次进样测定峰面积。以标准品溶液的浓度(μmol/L)为横坐标,峰面积值为纵坐标,绘制标准曲线,并求得16种氨基酸的线性回归方程及相关系数(见表2)。根据样品中16种氨基酸含量的差异,对各种氨基酸的线性范围进行了优化,从而得到最优 的回归方程和最佳测定浓度(见表2)。

图2 阴离子模式下氨基酸标准溶液中16种氨基酸的离子流图Fig.2 Ion flow of 16 amino acids detected under negative ionization mode

表2 16种氨基酸的线性回归方程,相关系数,RSD及回收率的测定结果Table 2 Linear regression equation,coefficient of correlation,RSD and recovery ratio of the 16 amino acids
2.4 精密度测定
精确配制浓度为50 μmol/L的16种氨基酸标准品混合溶液,按相同的质谱条件连续进样5次,计算峰面积,求得16种氨基酸的的相对标准偏差(RSD)在0.84% ~2.75%之间(见表2)。
2.5 回收率测定
准确配制25 mg/mL的细脚棒束孢样品溶液,加入适量的氨基酸标准溶液,进行加标回收试验,按与试验样品相同的方法测定峰面积,求得16种氨基酸的回收率为97.1%-102.8%(见表2)。
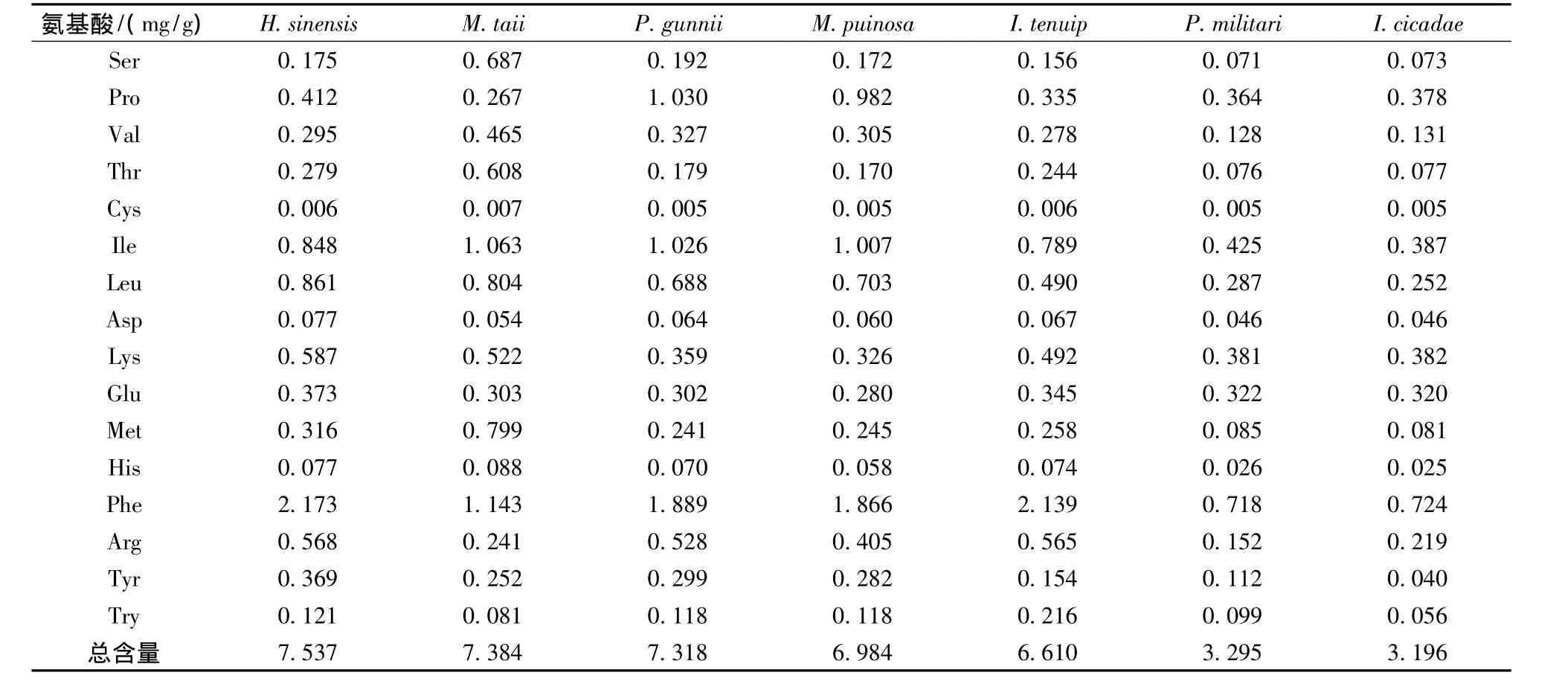
表3 7种虫生真菌样品中16种游离氨基酸的含量Table 3 Contents of 16 amino acids of the seven tested entomogenous fungi
2.6 7种虫生真菌样品中16种游离氨基酸含量的分析
按照前面优化的方法,对7种虫生真菌菌丝样品中16种游离氨基酸的含量进行了测定,结果见表3。从表中可以看出,同一菌株中各种氨基酸的含量相差较大,但所有菌株中含量最高的均为苯丙氨酸,其中,中国被毛孢的苯丙氨酸含量最高为2.173 mg/g;各菌株中胱氨酸的含量均很低,在最低线性浓度外;各菌株中脯氨酸(Pro)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、赖氨酸(Lys)、谷氨酸(Glu)和苯丙氨酸(Phe)含量基本在0.3 mg/g以上,较其他氨基酸含量明显较高,它们和苯丙氨酸一起可作为虫生真菌中游离氨基酸的特征指标。不同菌株间同种氨基酸含量也存在一定差异,对于含量最高的苯丙氨酸在不同菌株间的含量差异为0.718~2.173 mg/g;丝氨酸(Ser)、苏氨酸(Thr)、缬氨酸(Val)、甲硫氨酸(Met)在戴氏绿僵菌中的含量明显高于其他菌株。实验结果还表明,不同菌株间游离氨基酸总含量也存在较大差异,中国被毛孢中游离氨基酸总含量为7.537 mg/g,较蝉拟青霉(3.196 mg/g)的总含量高出1.36倍。
3 结论
本文采用液相色谱-电喷雾飞行时间质谱(LCTOF-MS)联用技术,在阴离子电离模式下,可快速地对16种氨基酸进行定性和定量测定。16种氨基酸的色谱特征和质谱离子特征明显,可准确定性。定量试验结果表明,16种氨基酸的线性范围广准确性高,在相关系数大于0.998时,线性范围都能达到4.0~125 μmol/L,最大可达2.0 ~500 μmol/L;在氨基酸浓度为50 μmol/L时,16种氨基酸的相对标准偏差在0.84% ~2.75%之间;回收试验结果显示,回收率为97.1%~102.8%。用液质联用法对中国被毛孢、蛹拟青霉、古尼拟青霉、蝉棒束孢、细脚棒束孢、戴氏绿僵菌和粉被玛利亚霉菌丝样品中16种游离氨基酸含量的测定结果显示,同一菌株中各种氨基酸的含量相差较大,但所有供菌株中含量最高的均为苯丙氨酸,它在不同供试菌株中的含量范围为0.718~2.173 mg/g,其中中国被毛孢的苯丙氨酸含量最高;供试菌株中含量较高的氨基酸还有脯氨酸、缬氨酸、亮氨酸、异亮氨酸、赖氨酸和谷氨酸,它们含量大部分都在0.3 mg/g以上,较其他氨基酸含量明显较高,可作为判定虫生真菌中游离氨基酸的特征指标。不同菌株间游离氨基酸总量也存在较大差异,中国被毛孢中游离氨基酸总含量为7.537 mg/g,较蝉拟青霉 (3.196 mg/g)的总含量高出1.36倍。总之,采用液质联用技术可以准确地对虫生真菌中16种游离氨基酸进行快速检测,其测定结果可为虫生真菌中游离氨基酸特征鉴定、资源利用和食用价值评价提供技术和理论参考。
[1] 李增智,黄勃,李春如,等.确证冬虫夏草无性型的分子生物学证据[J].菌物系统,2000,19(1):60-64.
[2] 梁宗琦.蛹虫草无性型——蛹草拟青霉的确证[J].食用菌学报,2001,8(4):28-32.
[3] 胡丰林,李增智.虫草及相关真菌的次生代谢产物及其活性[J].菌物学报,2007,26(4):607-632.
[4] 梁宗琦.我国虫草属真菌研究开发的现状及思考[J].食用菌学报,2001,8(2):53-62.
[5] 丁婷,胡丰林,耿德贵,等.冬虫夏草及其无性型菌株发酵液中核苷类成分的HPLC法定量分析[J].食品与发酵工业,2006,32(6):97-99.
[6] 何亚琼,胡丰林,王利,等.虫草及其无性型中的抗肿瘤细胞活性成分[J].生物学杂志,2008,25(1):1-4.
[7] 胡丰林,陆瑞利,李增智.一种被毛孢代谢物中自由基清除剂的分析、分离和制备[J].微生物学报,2008,48(8):1 035-1 042.
[8] 丁永胜,牟世芬.氨基酸的分析方法及其应用进展[J].色谱,2004,22(3):210-215.
[9] Sánchez C L,Cubero J,Sánchez J,et al.Screening for human milk amino Acids by HPLC-ESI-MS/MS[J].Food Analytical Methods,2011,5(2):312-318.
[10] 黄翼飞,胡静.液相色谱-电喷雾离子阱串联质谱同时分析烟草中的20种游离氨基酸[J].色谱,2010,28(6):615-622.
[11] 刘阳,倪君君,相婷,等.直接注入式串联质谱法测定氨基酸含量[J].沈阳药科大学学报,2011,28(3):198-205.

