锁掷酵母与海洋红酵母的营养成分分析*
韩梅,翟玉贵,王小波,张伟国
1(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
2(光明乳业股份有限公司技术中心乳业生物技术国家重点实验室,上海,200436)
类胡萝卜素是一类在植物、动物和微生物中广泛存在的脂溶性色素,已被广泛地应用于药物,保健品,动物饲料和化妆品的生产[1-2]。它们不仅可以作为维生素A源,还可以有效地保护细胞中的各种生物大分子不受自由基的损伤,从而维持细胞正常的生理代谢,防止衰老和癌变[3-5]。海洋红酵母因其含有丰富的类胡萝卜素、不饱和脂肪酸等,现在已经作为一种益生菌应用于海产品养殖,它既可以作为鱼类的饵料为其提供各种营养物质和类胡萝卜素,又可以附着在鱼鳞上防止其他有害细菌的滋生,提高鱼类的存活率[6],红酵母既可以作为有益微生物与海洋生物共生,又可以作为菌体蛋白应用于功能饲料的开发。随着畜牧业和饲料业的迅猛发展,饲料添加剂也向着广度和深度方向发展。现在很多国家和地区都在加大对饲料添加剂的研发,其中美国、日本和欧盟等已有100多种饲料添加剂产品,随着饲料添加剂的运用,其在养殖业中的作用越来越显著。
从目前来看,随着人们对合成色素毒性的认识程度的加深,许多国家已禁止使用毒性较大的化学合成色素,转为使用天然的微生物、植物和动物产品。受资源和环境等条件的限制,天然动植物增色饲料添加剂的发展空间受到制约。利用微生物发酵法生产增色饲料添加剂将是发展的必然趋势。增色饲料添加剂的研究与应用已取得初步进展,本论从筛选高产类胡萝卜素的菌种出发,选育出1株类胡萝卜素产量远高于市售海洋红酵母的锁掷酵母,现对其含有的类胡萝卜素,氨基酸和脂肪酸进行分析,为其应用于饲料奠定基础。
1 材料与方法
1.1 菌种
锁掷酵母(Sporidiobolus pararoseus)JD-2从自然界中筛选并保藏于中国典型菌种保藏中心,保藏号:CCTCC M 2010326。
海洋红酵母(Rhodotorula sp.),购于安琪酵母。
1.2 主要试剂和仪器
β-胡萝卜素,番茄红素标准品购自SIGMA;
高效液相色谱仪购自美国安捷伦公司。
1.3 培养基
斜面培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母膏10 g/L,琼脂 20 g/L,pH6。
种子培养基:葡萄糖20 g/L,玉米浆20 g/L,Mg-SO4·7H2O 0.5 g/L,KH2PO41.0 g/L,pH6。
发酵培养基:葡萄糖40 g/L,玉米浆20 g/L,Mg-SO4·7H2O 0.5 g/L,KH2PO41.0 g/L,pH6。
1.4 实验方法
摇瓶培养方法:将菌株接入种子培养基中,待其长到对数生长期后期,再以10%的接种量接入发酵培养基中,在28℃下、100 r/min的往复式摇床上振荡培养72 h。
7 L罐分批发酵培养方法:发酵罐中装液量3.5 L,接种量10%,通风1 L/min,流加氨水控制pH6左右,通过流加泡敌消泡,根据溶氧需求调节转速,发酵72 h。
1.5 菌体的获得
发酵液→5 000 r/min离心10 min→菌体→同体积的蒸馏水洗2次→冷冻干燥备用
1.6 分析方法
1.6.1 类胡萝卜素分析
将薄板上基本分离的色素刮下,溶于丙酮中进行进一步的分析。
C18柱分离条件:①流动相:V(乙腈)∶V(二氯甲烷)=1∶1;②流速1 mL/min;③进样量10 μL;④检测波长470 nm;⑤柱温30℃;⑥色谱柱:d 3.9 mm×150 mm Nova-Pak C18,颗粒直径 5 μm。
C30柱同分异构体分离条件[7-8]:①色谱柱:Warotenoid S-5(4.6 mm×250 mm);②流动相A为乙腈-甲醇(体稷比75∶25),流动相B为甲基叔丁基醚,流动相A和B中分别加入体积分数为0.05%的三乙胺;③线性梯度洗脱:流动相B在8 min内由0%增加到55%;8~35 min内 B维持55%;流速1.0 mL/min;进样量 20 μL。
1.6.2 氨基酸分析方法
分别用酸法和碱法水解后用氨基酸自动分析仪测定。
1.6.3 脂肪酸的测定方法
菌体破壁后用丙酮提取的粗类胡萝卜素提取液于80℃烘箱中烘6 h,得粗脂肪,甲酯化后,用气相色谱法测定。
气相色谱法测定条件:起始温度150℃,保持3 min,升温速率3℃/min,至240℃,保留20 min。载气压力(N2):0.060 MPa;燃气压力(H2):0.65 MPa;助燃气压力(空气):0.050 MPa;分流比:30∶1。
2 结果与讨论
2.1 海洋红酵母与锁掷酵母中总类胡萝卜素含量的比较
由图1可知,锁掷酵母中总类胡萝卜素的含量明显大于海洋红酵母。海洋红酵母菌体和冻干粉呈粉红色,锁掷酵母菌体和冻干粉呈深红色。锁掷酵母可以作为一种增色饲料添加剂应用于功能性饲料的开发。增色饲料添加剂是增加畜、禽蛋、禽肉和水产品色泽的添加剂。动物体本身不能合成类胡萝卜素,必须由饲料供给,饲料中的类胡萝卜素被吸收后,沉着于畜禽和海产品中使之着色。禽蛋的卵黄,禽类皮肤与肉质和海产品的外壳与肉质的色泽在一定程度上决定了它们的商品价值。但是随着饲料行业的发展,饲养周期的缩短,它们的色泽与自然生长的产品差距越来越大,人们可以在饲料中添加一定比例的增色剂,解决由于饲养时间缩短引起的色泽不足问题,这是提高畜禽产品质量的重要技术措施之一。国内外大量研究表明,通过合理调整饲料的营养成分可提高畜禽产品的质量[9],其富含的类胡萝卜素还可以通过食物链被动物吸收,提高产品品质。另外作为菌体饲料,锁掷酵母还可以为动物提供丰富的氨基酸和脂肪酸。

图1 海洋红酵母与锁掷酵母总类胡萝卜素的比较(平板比较图和冻干粉比较图)Fig.1 The comparation of carotenoids in Sporidiobolus pararoseus JD-2 and Rhodotorula sp.
2.2 锁掷酵母中各种类胡萝卜素的分析
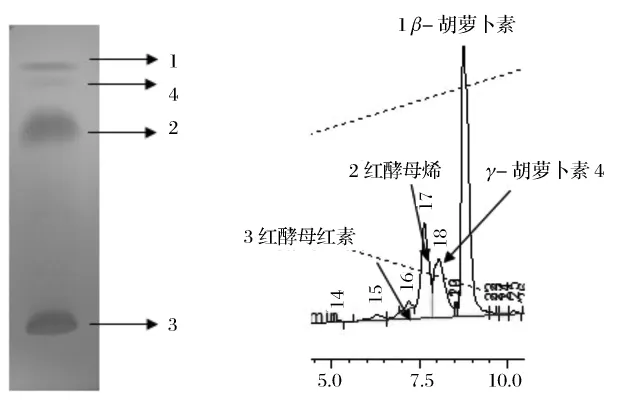
图2 薄板层析图和C18柱液相色谱图Fig.2 The thin layer chromatography and HPLC used C18
由图2和图3、表1可知,色素1的出峰时间与β-胡萝卜素标样相同,并且质谱分析其分子质量为536,色素1的最大吸收峰在450 nm处,所以可以确定其为β-胡萝卜素;色素2的出峰时间介于β-胡萝卜素和番茄红素之间但是更接近于番茄红素,其分子质量为534确定其为红酵母烯;色素3的分子质量为564,确定其为红酵母红素,它的分子末端含有一个羧基,可溶于碱性的醇溶液中;色素4的分子质量为536,其最大吸收峰与γ-胡萝卜素接近,出峰位置介于β-胡萝卜素和番茄红素之间,更接近β-胡萝卜素,所以可以初步确定其为γ-胡萝卜素。由表2可知,锁掷酵母中含有的总类胡萝卜素量显著高于海洋红酵母,并且其中含有较多的β-胡萝卜素,而海洋红酵母中β-胡萝卜素含量很少,以红酵母烯为主。
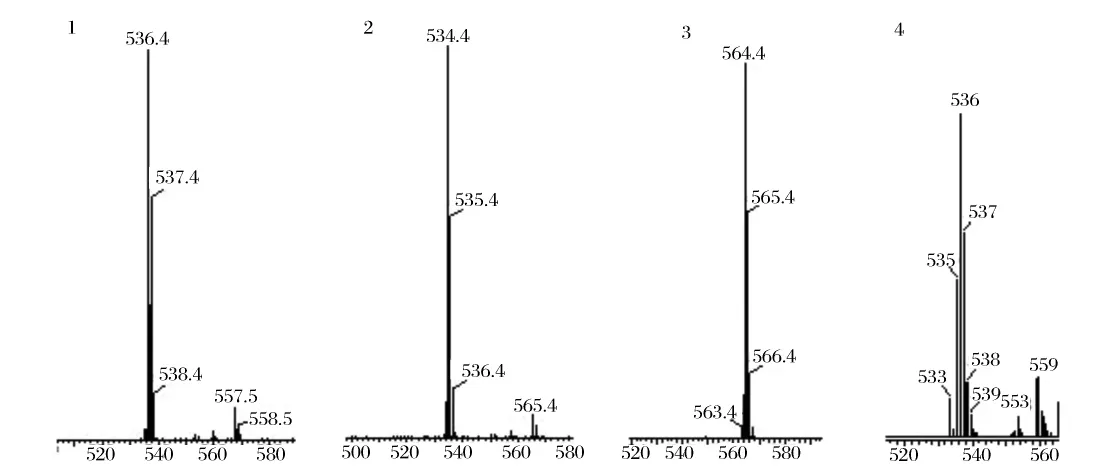
图3 类胡萝卜素质谱图Fig.3 Mass spectrogram of carotenoids
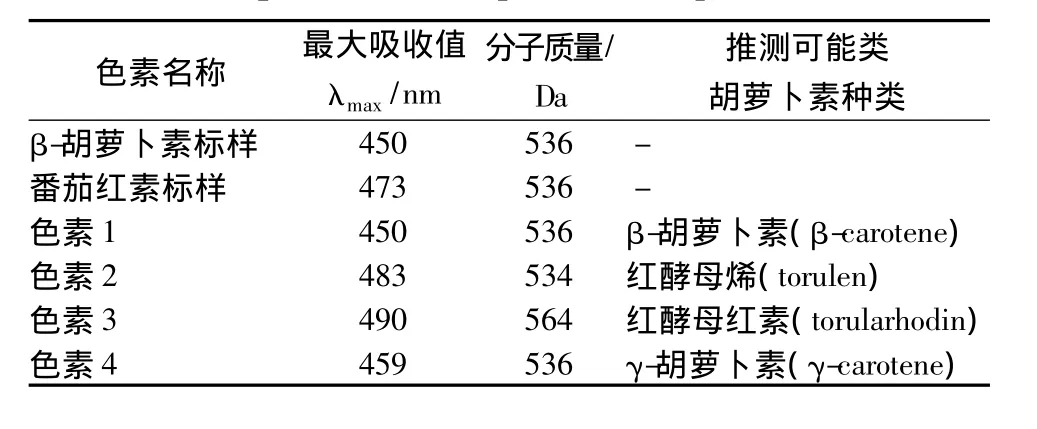
表1 锁掷酵母发酵产物中可能存在的类胡萝卜素种类及色谱特征Table 1 Carotenoids chromatographic characteristics in the fermentation production of Sporidiobolus pararoseus JD-2
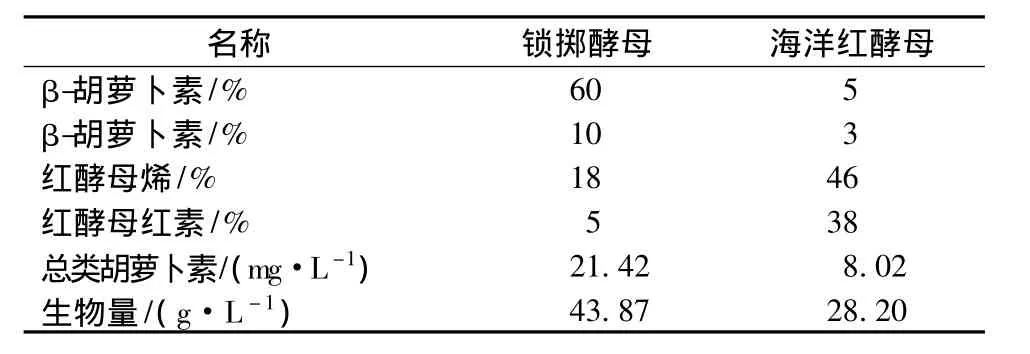
表2 海洋红酵母和锁掷酵母中类胡萝卜素组成Table 2 Carotenoids composition of Rhodotorula sp.and Sporidiobolus pararoseus JD-2
由于类胡萝卜素类物质的碳骨架是由单双键交替的长多烯链构成,所以它有多种顺反异构体,研究表明,动物和人对不同的异构体的利用程度是不同的,因此分析各种类胡萝卜素的顺反异构情况有一定的意义。在人体血液中全反式β-胡萝卜素占90%左右,顺式结构几乎只有13-顺-β-胡萝卜素,但是在人体组织中全反式β-胡萝卜素只有70% ~80%,顺式结构主要有9-顺和13-顺-β-胡萝卜素,并且顺式结构的含量在不同的组织中含量有区别[10-11]。全反式β-胡萝卜素有较高的维生素A转化功能[12],而其他的顺式结构对组织的功能性有更重要的作用[10]。
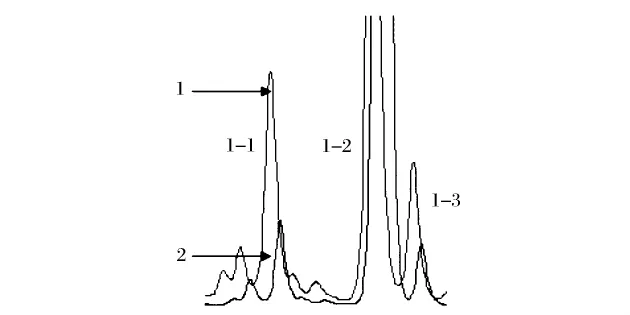
图4 天然与合成β-胡萝卜素的液相色谱图Fig.4 HPLC chromatogram of natural and synthetic β-carotene
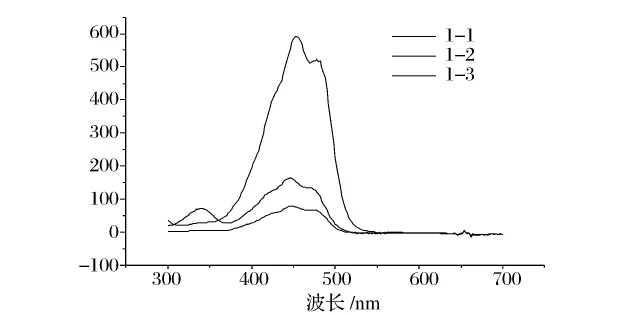
图5 β-胡萝卜素的光谱特征图Fig.5 Spectral overlays of β-carotene sample
根据β-胡萝卜素的液相色谱图4、光谱特征图5和参考文献[7]对β-胡萝卜素同分异构体进行分析,结果得出锁掷酵母中β-胡萝卜素异构体以全反式β-胡萝卜素(1-2)为主,占总β-胡萝卜素的60%左右,顺式结构主要有13-顺(1-1)和9-顺β-胡萝卜素(1-3),分别占21%和10%,而化学合成的β-胡萝卜素几乎全为全反式β-胡萝卜素。
2.3 海洋红酵母和锁掷酵母中的氨基酸组成
由表3氨基酸分析可知锁掷酵母中的蛋白质含量占总干重的15%左右,其氨基酸组成中必需氨基酸占总氨基酸的38%,而且必需氨基酸种类全面,鲜味氨基酸占总氨基酸的43%,可以很好的促进鱼类的进食。锁掷酵母与海洋红酵母的氨基酸组成基本类似。
2.4 海洋红酵母和锁掷酵母中的脂肪酸组成
不饱和脂肪酸能使动物血清中总胆固醇、低密度脂蛋白-胆固醇三酰甘油水平均下降而且可以提高畜禽免疫力[13]。油酸能够降低胆固醇在血液中的含量,减少其在血管上的沉积,有预防动脉硬化等作用,同时油酸却不降低有益胆固醇的含量。营养界把油酸称为“安全脂肪酸”,油酸的含量多少,是评定食用油品质的重要标志。亚油酸是动物生长的必需有机酸之一,是合成n-6系列不饱和脂肪酸的前体物质。由图6和表4可知海洋红酵母中不饱和脂肪酸占总脂肪酸的76%左右,锁掷酵母中不饱和脂肪酸占总脂肪酸的74%左右,酵母菌体可以很好地改变畜禽的饲料结构,不仅可以提高畜禽的质量,还有可能通过食物链的作用提高人体机能。
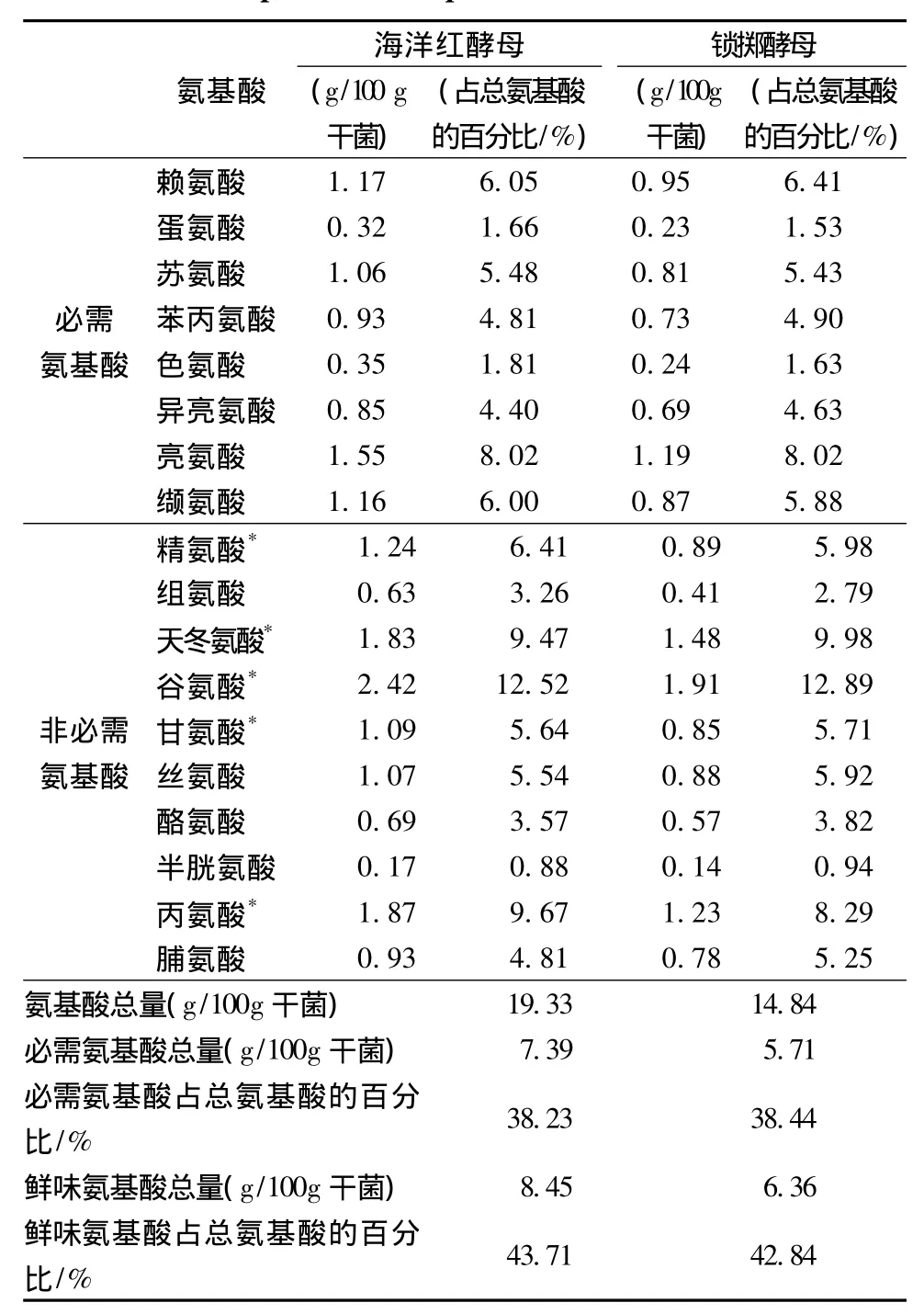
表3 海洋红酵母和锁掷酵母中氨基酸组成Table 3 Amino acid composition of Rhodotorula sp.and Sporidiobolus pararoseus JD-2
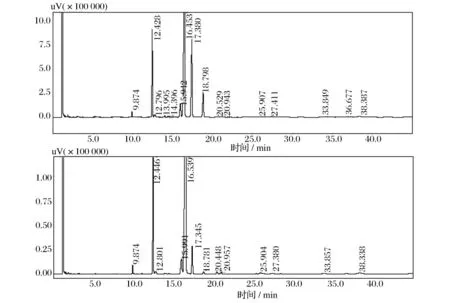
图6 海洋红酵母和锁掷酵母中脂肪酸组成Fig.6 Fatty acids composition of Rhodotorula sp.and Sporidiobolus pararoseus JD-2
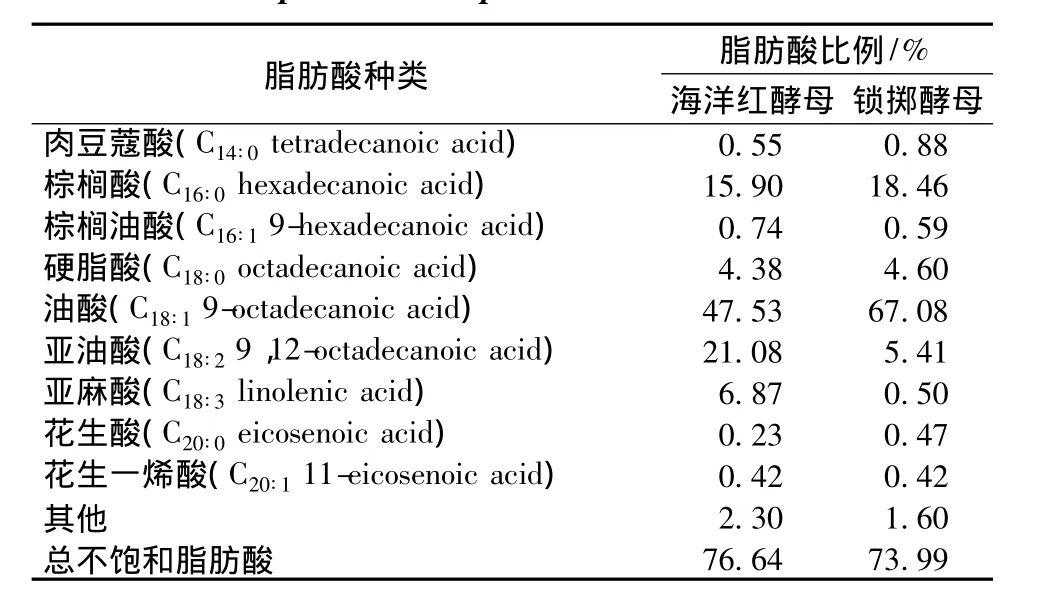
表4 海洋红酵母和锁掷酵母中脂肪酸组成Table 4 Fatty acids composition of Rhodotorula sp.and Sporidiobolus pararoseus JD-2
3 结语
本实验研究了锁掷酵母中主要的类胡萝卜素组成,并且对其β-胡萝卜素的同分异构体进行了分析,为其作为增色饲料添加剂奠定了基础。又进一步分析了锁掷酵母中氨基酸、脂肪酸的组成,并且将各指标与现有的市售海洋红酵母进行了比较分析,确定了锁掷酵母作为饲料酵母的可行性,为锁掷酵母的深入应用奠定了基础。
[1] Frengova G I,Beshkova D M.Carotenoids from Rhodotorula and Phaffia:yeasts of biotechnological importance[J].J Ind Microbiol Biotechnol,2009,36(2):163-180.
[2] Kim J H,Kim S W.Production of β-carotene by Recombinant Escherichia coli with Engineered Whole Mevalonate Pathway in Batch and Fed-batch Cultures[J].Biotechnol and Biopro Eng,2009,14(5):559-564.
[3] Jimenez E A,Jimenez J I,Sanchez M C,et al.Evaluation of free radical scavenging of dietary carotenoids by the stable radical 2,2-diphenyl-1-picrylhydrazyl[J].J Sci Food Agric,2000,80(11):1 686-1 690.
[4] Kiokias S,Gordon MH.Antioxidant properties of carotenoids in vitro and in vivo [J].Food Rev Int,2004,20(2):99-121.
[5] Lee J H,Ozcelik B,Min D B.Electron donation mechanisms of b-carotene as a free radical scavenger[J].J Food Sci,2003,68(3):861-865.
[6] 张志军,江晓路,张婷婷,等.红酵母Rhodotorula sp.06产类胡萝卜素的研究[J].食品工业科技,2007,28(11):123-125.
[7] 仇丹,陈志荣,李浩然.β-胡萝卜素异构体的定性分析[J]. 食品科学,2008,29(4):50-53.
[8] 惠伯棣,李京,裴凌鹏.应用C30-HPLC-PDA分离与鉴定番茄红素几何异构体[J].食品工业科技,2006,27(7):49-54.
[9] 刘立鹤,姚娟,李彪,等.酵母源生物饲料在水产养殖中的应用[J].饲料研究,2010(10):34-36.
[10] Wilhelm S,Alfred RS,Michael H.Separation of β-carotene and lycopene geometrical isomers in biological samples[J].Clin Chem,1993,39(5):810-814.
[11] Jonathan R L,Lisa W W,Robert,V A.Concurrent liquid chromatograhpic separation and photodiode array detection of retinol,tocopherols,all-trans-α-carotene,alltrans-β-carotene and the mono-cis isomers of β-carotene in extracts of human plasma[J].J Chromatogr A,1997,787(1):111-118.
[12] Cassia R L.High-performance liquid chromatographic determination of the geometrical isomers of β-carotene in several food-stuffs[J].J Chromatogr A,1995,697(2):289-294.
[13] 秦圣涛,孙淑红.多不饱和脂肪酸(PUFA)对家禽免疫功能的影响及其作用机制研究进展[J].饲料工业,2005,26(15):17-19.

