阴离子多糖对大豆蛋白乳状液乳析稳定性的影响*
王才华,周雪松,曾建新,赵强忠,赵谋明
1(广州合诚实业有限公司,广东广州,510530)2(华南理工大学轻工与食品学院,广东广州,510640)
以大豆为原料生产的豆奶饮料适口性强,营养丰富,具备“天然、绿色、营养、健康”的品类特征[1]。以豆奶为代表的植物蛋白饮料符合饮料市场发展潮流和趋势,近年来发展很快,在国内饮料消费市场占有重要地位。充分利用我国现有的大豆蛋白资源开发饮品,对于改善我国人民的膳食结构有着重要的意义[2]。
大豆蛋白饮料体系复杂,稳定性难以解决。因体系富含蛋白和脂肪,如果蛋白质不能与脂肪形成稳定的乳化体系,随着贮存时间的延长,易发生乳析分层;另外,蛋白质在高温下易变性,产生沉淀、凝固、分层现象。这些均严重影响了产品的外观品质。目前国内有关大豆蛋白乳状液的研究侧重于各种原辅料的复配(如乳化剂、多糖和盐类复配等)对乳状液稳定性的影响,其他植物蛋白乳状液的研究也是如此。国外有关蛋白乳状液的研究侧重于稳定性基础理论的研究,主要是以低蛋白(0.2% ~2%)高油脂(10% ~20%)为基本模型的乳状液,且未经过高温热处理。其中以乳蛋白(如酪蛋白和乳清蛋白[3-4])乳状液模型的研究最深入,有关植物蛋白乳状液的稳定性研究相对较少。因此本文以大豆蛋白乳状液模型(经过高温热处理)为基础,选取3种饮料中应用最为常用的阴离子多糖包括卡拉胶、CMC和黄原胶,研究它们对大豆蛋白乳状液乳析稳定性的影响,并探讨相关的作用机理,以期为有效解决植物蛋白饮料稳定性提供理论和方法指导。
1 材料与方法
1.1 材料与试剂
蔗糖、大豆油,市售;大豆蛋白(蛋白质含量90%),山东御馨蛋白有限公司;卡拉胶,海南文昌卡拉胶有限公司;羧甲基纤维素钠FH9,苏州依利法化工有限公司;黄原胶9290,淄博顺达生物科技有限公司;磷酸氢二钠、磷酸二氢钠,徐州化工三厂;叠氮钠,天津福晨化学试剂厂。
1.2 仪器与设备
APV-1000高压均质机,丹麦APV;Mastersizer 2000粒度分布仪,英国 Malvern;FA1104型分析天平,上海精密科学仪器有限公司;BHW-Ⅳ型机密恒温水箱,北京朝阳航信医疗器材厂;高速剪切机,上海标本模型厂;YX280B手提式不锈钢压力蒸汽灭菌器,苏州江东精密仪器有限公司。
1.3 实验方法
1.3.1 制备工艺流程
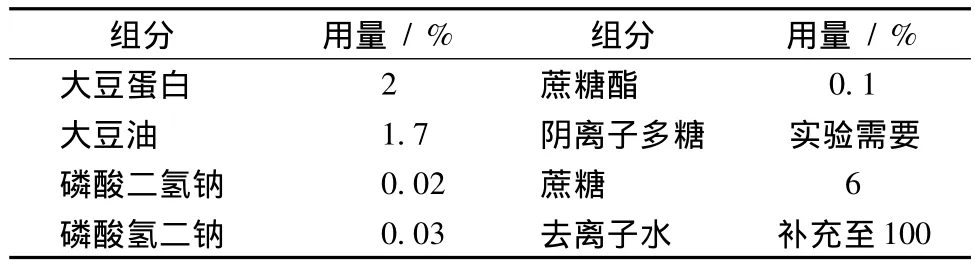
表1 大豆蛋白乳状液的基本配方Table 1 The formula of soy protein emulsions
首先将大豆蛋白在水中均匀分散,并将阴离子多糖、乳化剂、盐和蔗糖充分溶解,在搅拌状态下与大豆油缓慢混合,然后将在60℃水化30 min;水化结束后,用高速剪切机于10 000 r/min将粗乳状液剪切2 min,然后于60℃均质,均质压力为20 MPa,接着将乳状液灌装和灭菌(121℃/15 min),最后迅速冷却至常温。
1.3.2 粒度分布的测定
采用Mastersizer 2000粒度分布仪测定乳状液粒度分布,以面积加权平均直径(volume weighted mean diameter)d3,2表示乳状液粒径(单位:μm)。乳状液样品按1∶1 000用去离子水稀释,测定参数设定为:分析模式:通用;进样器名:Hydro 2000MU(A);颗粒折射率[5]:1.530;颗粒吸收率[5]:0.001;分散剂名:水;分散剂折射率:1.330。
1.3.3 乳析率的测定
向灭菌后的乳状液中加入2%的叠氮钠溶液,使乳状液的叠氮钠浓度达到0.02%,目的是抑制乳状液中的微生物生长。然后准确吸取乳状液10 mL于具塞刻度试管中。25℃静置,每隔一段时间记录乳析层的高度(mm)。
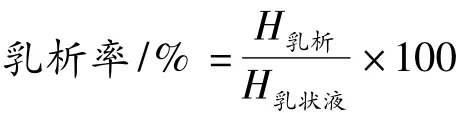
其中:H乳析为乳析的高度;H乳状液为乳状液的高度。
2 结果与分析
2.1 阴离子多糖对大豆蛋白乳状液乳析率的影响
卡拉胶对大豆蛋白乳状液的乳析率的影响如图1所示。由图1可看出,在静置过程中,添加0.03%卡拉胶的大豆蛋白乳状液的乳析率低于空白样;当卡拉胶浓度高于0.06%时,大豆蛋白乳状液的乳析率明显高于空白样,且随着卡拉胶浓度增加而迅速增加。这说明0.03%卡拉胶能够有效地抑制大豆蛋白乳状液的乳析,但随着卡拉胶浓度进一步增加,明显促进乳状液乳析。
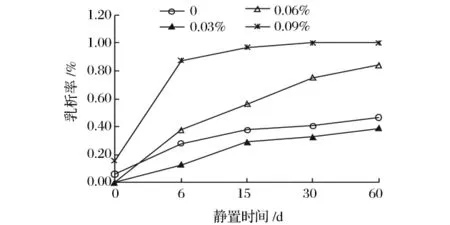
图1 卡拉胶对大豆蛋白状液乳析率的影响Fig.1 Efects of carrageenan on the creaming rate of soy protein emulsions
CMC对大豆蛋白乳状液的乳析率的影响如图2所示。由图2可以看出,随着CMC浓度的增加,乳状液的乳析率急剧增加,且均高于空白乳状液,这表明在实验浓度范围内,CMC并不能抑制乳析。添加0.15%CMC的乳状液在静置的第0天乳析率为8.6%,远远高于其他浓度CMC的乳状液的乳析率,随后乳析急剧增加,到静置第6天乳析率为13.5%,从外观上来看,乳状液出现相分离,上层为富集的脂肪球,下层则为半透明的液相。添加0.12%CMC的乳状液在静置第2天,也出现相同的相分离。
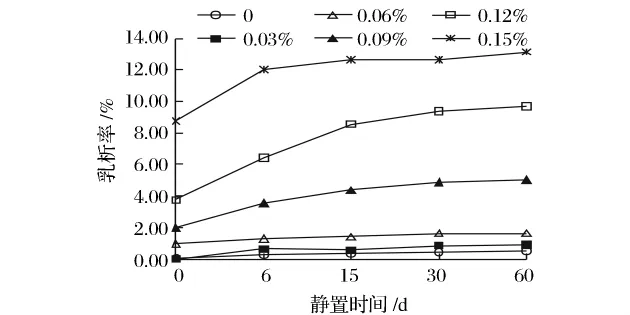
图2 CMC对大豆蛋白乳状液乳析率的影响Fig.2 Effects of CMC on the creaming rate of soy protein emulsions
黄原胶对大豆蛋白乳状液的乳析率的影响如图3所示。由图3可以看出,0.03%黄原胶对乳析有一定的抑制作用。高浓度的黄原胶则促进大豆蛋白乳状液的乳析,当黄原胶浓度高于0.06%后,随着浓度的增加,大豆蛋白乳状液的乳析率急剧增加。在静置6 d后,黄原胶添加浓度为0.09%、0.12%和0.15%的大豆蛋白乳状液都出现相分离现象。
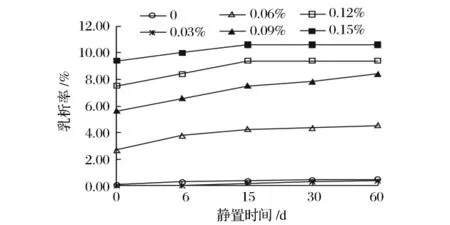
图3 黄原胶对大豆蛋白乳状液乳析率的影响Fig.3 Effects of xanthan on the creming rate of soy protein emulsions
在这3种阴离子多糖中,当多糖浓度低于0.06%,卡拉胶有较好的乳析抑制作用,而黄原胶有一定的抑制作用,CMC不能够抑制乳析。0.06% ~0.15%的阴离子多糖都明显降低乳状液的乳析稳定性,甚至发生相分离,其中黄原胶最显著,CMC次之,添加卡拉胶的乳状液的乳析稳定性相对较好,乳析率不超过1%。
2.2 阴离子多糖对大豆蛋白乳状液粒径的影响
卡拉胶对大豆蛋白乳状液顶部粒径d3,2的影响如表2所示。由表2可以看出,随着卡拉胶浓度增加,大豆蛋白乳状液顶部粒径d3,2呈波浪形变化,先减小然后增大,再减小,这可能与卡拉胶-大豆蛋白交互作用、乳状液表观粘度等因素有关。Dickinson等[6]认为,当卡拉胶浓度较低时,卡拉胶与大豆蛋白发生静电吸引作用。当体系pH值高于大豆蛋白等电点pI时,大豆蛋白分子带有净负电荷,但这不是表明蛋白质分子上的电荷完全为负电荷,在蛋白质分子上的某些区域或分子的某些片段仍带有正电荷。当体系中存在阴离子多糖时,蛋白质的正电荷区域就会和多糖的阴离子基团发生静电吸引相互作用。当多糖分子吸附到蛋白质包被的脂肪球表面,多糖与蛋白质分子间的静电相互作用成为影响蛋白质乳状液稳定性的重要因素[7]。卡拉胶吸附到脂肪球上的蛋白质吸附层,形成蛋白质-卡拉胶复合吸附物,使得吸附层的负电荷大大增加,脂肪球之间静电排斥力增强,通过静电排斥维持乳状液的稳定性[6],且卡拉胶的双螺旋构象使这种吸附很难发生在不同的脂肪球之间,难以发生桥连絮凝。因此,0.03%的卡拉胶能够有效地抑制大豆蛋白乳状液的顶部粒径d3,2增大;当卡拉胶浓度增加到0.06%,连续相中未吸附的卡拉胶因造成渗透压的差异,从而导致乳状液发生排斥絮凝,使得顶部粒径d3,2增大。但是当卡拉胶浓度增加到0.09%,顶部粒径d3,2又下降,这是可能由于乳状液表观黏度增加减缓了脂肪球上浮,暂时抑制顶部粒径d3,2。随着静置时间的延长,絮凝形成大的脂肪球上浮到顶部,在静置第6 d,0.09%卡拉胶的乳状液的顶部粒径d3,2急剧增大,高于其他浓度的乳状液。卡拉胶-大豆蛋白交互作用是影响顶部粒径d3,2的主要因素,表观黏度为次要因素。
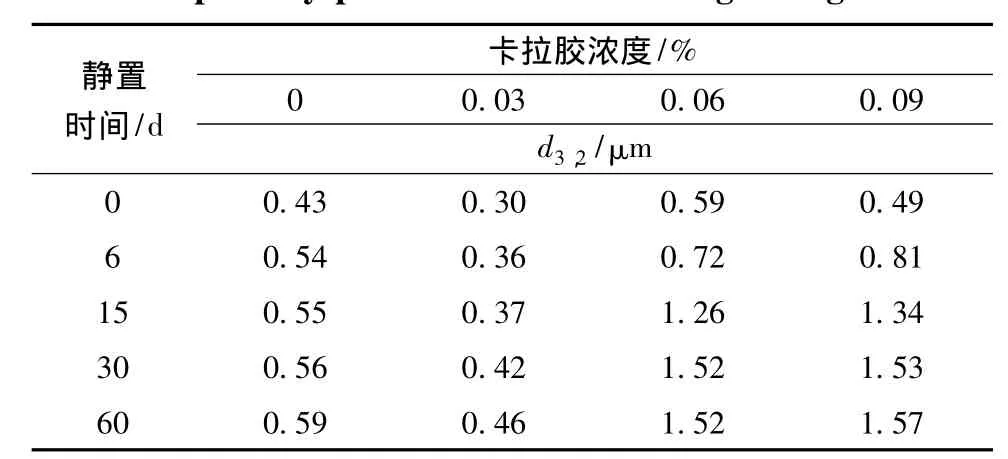
表2 卡拉胶对大豆蛋白乳状液顶部粒径d3,2的影响Table 2 Effects of carrageen on the d3,2in the top of soy protein emulsions during storage
由表2还可以看出,随着静置时间的延长,乳状液顶部粒径d3,2增大,增幅最大的是在静置的前15 d,这在宏观上表现为乳析。在静置期间,添加0.03%卡拉胶的乳状液顶部粒径d3,2一直小于空白乳状液,这表明低浓度的卡拉胶能够有效地抑制顶部粒径 d3,2。
本文选取添加0.06%卡拉胶的大豆蛋白乳状液顶部粒度分析其变化规律,粒度分布频率如图4所示。
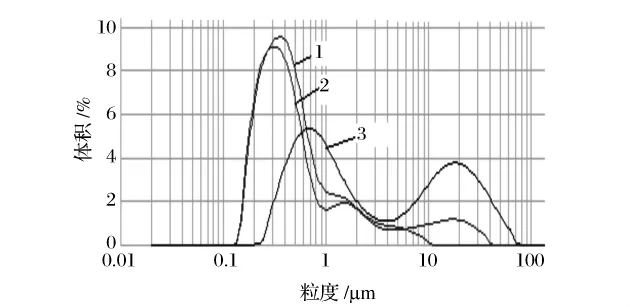
图4 0.06%浓度卡拉胶的大豆蛋白乳状液顶部粒度分布在静置过程中的变化Fig.4 Change of size distribution in the top of soy protein emulsions of 0.06%carrageenan during storage
通过对比粒度分布频率图可以发现,在静置的前期,脂肪球的粒径分布在0.1~10 μm;粒度分布的峰值(最频值)为0.35 μm,绝大部分脂肪球粒径在1 μm以下,这说明绝大部分脂肪球以单个形式存在,脂肪球之间可能发生可逆性的聚集,但很少发生不可逆性的聚结,因此乳析层经过震荡,乳状液可以恢复到均一的状态。随着时间的延长,在静置15 d时,脂肪球的粒径分布区间在0.1~40 μm;呈双峰分布,一个峰值在0.30 μm,另一个则大约在15 μm,小粒径脂肪球减少,大粒径脂肪球增多,这表明由部分小粒径脂肪球通过聚结成大的脂肪球,即使剧烈的震荡也不能够打碎。在静置60 d后,乳状液顶部粒径急剧增大,脂肪球的粒径分布范围0.20~70 μm;呈非常明显双峰分布,且2个峰都向右移动,一个峰值在0.7 μm,另一个峰值在 20 μm;对比静置 0 d 的粒度分布频率曲线,静置60 d后原先以单个形式存在的脂肪球大部分都聚结成更大的脂肪球。聚结是不可逆的过程,在小脂肪球聚结成更大的脂肪球的过程中,往往伴随着油脂析出(即油析),严重的油析将在试管口留下一道油析圈,极大影响了食品乳状液的外观品质。乳析是一个可逆的过程,而油析是不可逆的过程。
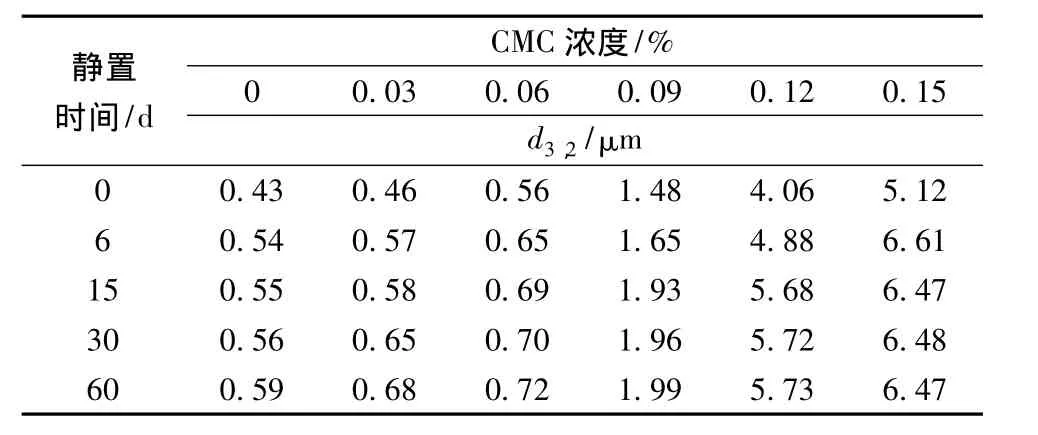
表3 CMC对大豆蛋白乳状液顶部粒径d3,2的影响Table 3 Effects of CMC on the d3,2in the top of soy protein emulsions during storage
CMC对大豆蛋白乳状液顶部粒径d3,2的影响分别如表3所示。由表3可以看出,在静置第0天,随着CMC浓度增加,顶部粒径d3,2急剧增大。随着静置时间的延长,顶部粒径d3,2增大,且在前15d增加幅度最大。当CMC浓度为0.12% ~0.15%时,乳状液在宏观上已经发生相分离,顶部出现明显的乳析层,底部呈半透明的液相。这表明CMC与大豆蛋白之间发生强烈的交互作用,当CMC浓度较低时,CMC与大豆蛋白之间发生较强的静电吸附作用,CMC分子连接不同脂肪球界面膜上的蛋白质分子,从而形成桥连絮凝;当CMC浓度高于发生絮凝的临界浓度(CFC)时,乳状液可能发生排斥絮凝。由于顶部的d3,2急剧增大,使得相应的乳状液乳析十分严重。
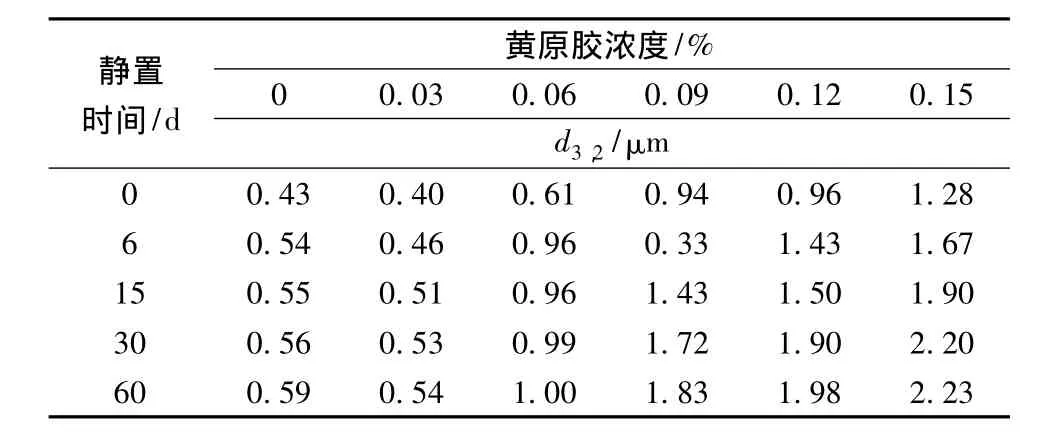
表4 黄原胶对大豆蛋白乳状液顶部粒径d3,2的影响Table 4 Effects of xanthan on the d3,2in the top of soy protein emulsions during storage
黄原胶对大豆蛋白乳状液顶部粒径d3,2的影响如表4所示。由表4可以看出,随着黄原胶浓度的增加,大豆蛋白乳状液顶部粒径d3,2先减小后增大,添加0.03%黄原胶的大豆蛋白乳状液顶部粒径d3,2的最小。这可能是由于当黄原胶浓度为0.03%时,主要通过静电稳定机制抑制脂肪球的絮凝;当黄原胶浓度进一步增加,黄原胶与大豆蛋白交互作用产生的排斥絮凝作用增强。随着静置时间的延长,乳状液顶部粒径d3,2增大,在静置0~6 d,增幅最大。添加黄原胶乳状液顶部粒径d3,2明显小于相同浓度的CMC乳状液,而高于添加相同浓度的卡拉胶乳状液,这说明CMC与大豆蛋白的交互作用最强。
2.3 乳状液的粒径与乳析率之间的关系
乳析是由于脂肪球与连续相之间的密度差引起的脂肪球的上浮。在普通的乳状液体系中,脂肪球上浮速度可通过Stockes方程描述。根据Stock原理,脂肪球上浮速度与体系的表观粘度成反比,与粒径的平方成正比。Grotenhuis等人[7]也认为,脂肪球的聚集和蛋白质的聚集不仅影响到乳状液的流变学性质,还影响到体系的稳定性如乳析和沉淀。通过SPSS 13.0 for windows分析大豆蛋白乳状液顶部粒径d3,2与对应的乳析率之间的相关性,结果表明在静置期间,添加卡拉胶的乳状液顶部粒径d3,2与乳析率的相关系数R=0.857(P<0.01);添加CMC的乳状液顶部粒径d3,2与乳析率的相关系数R=0.961(P<0.01);添加黄原胶的乳状液顶部粒径d3,2与乳析率的相关系数R=0.878(P<0.01)。由上述分析可知,通过顶部粒径d3,2可以解释大豆蛋白乳状液85.7%以上的乳析率变化,脂肪球粒径是影响乳析的主要因素,而体系表观粘度是次要因素。0.03%卡拉胶或黄原胶能够有效地抑制大豆蛋白乳状液的顶部粒径d3,2的增大,从而抑制乳析;而0.03%的CMC可能发生桥连絮凝,促进乳析。高浓度的卡拉胶、CMC和黄原胶都能使乳状液发生排斥絮凝,促进乳状液顶部粒径d3,2增大,加速乳析。更高浓度的CMC和黄原胶导致体系强烈的絮凝,此时体系表现严重乳析现象,甚至出现相分离。
3 结论
(1)添加0.03%卡拉胶的大豆蛋白乳状液乳析稳定性较好,而添加黄原胶或CMC的大豆蛋白乳状液乳析稳定性则较差,高浓度的阴离子多糖都有促进大豆蛋白乳状液的乳析作用。
(2)随着阴离子多糖浓度的增加,添加CMC的乳状液顶部粒径d3,2增大,添加卡拉胶或黄原胶的大豆蛋白乳状液顶部粒径d3,2先减小后增大;随着静置时间的延长,顶部粒径d3,2增大,且前15 d增加幅度最大,增加幅度由大到小依次为CMC、黄原胶和卡拉胶。
(3)添加阴离子多糖的大豆蛋白乳状液的顶部粒径d3,2与乳析率呈较好的正相关性,脂肪球越大,上浮速度越快,乳析率越高。
[1] 罗建.大豆蛋白质及副产物的功能与应用[J].江苏食品与发酵,2001(1):31-32.
[2] 宋国安.大豆蛋白在食品及乳品工业中的应用[J].食品科技,1996(1):2-4.
[3] Euston S,Finnigan S,Hirst R,et al.Aggregation kinetics of heated whey protein stabilized emulsions[J].Food Hydrocolloids,2000,14:155-161.
[4] Hunt J,Dalgleish D.Heat stability of oil-in-water emulsions containing milk proteins:effect of ionic strength and pH[J].Journal of Food Science,1995,60:1 120-1 123.
[5] Erix P Schokker,Douglas G Dalgleish.The shear-induced destabilization of oil-in-water emulsions using caseinate as emulsifier[J].Colloids and Surfaces A,1998,145:51-69.
[6] Dickinson E,Pawlowsky K.Effect of ι-carragenan on flocculation,creaming,and rheology of a protein-stabilized emulsion [J].Journal of Agriculture and Food Chemistry,1997,45:3 799-3 806.
[7] Grotenhuis E T,Paques Marcel,Van Aken G A,et al.The application of diffusing-wave spectroscopy to monitor the phase behavior of emulsion-polysaccharide systems[J].Journal of Colloid and Interface Science,2000,227:495-504.

