干扰素γ 抑制IL-13 对成纤维细胞的纤维化作用*
熊丽霞, 李文林, 蔡震宇, 周 莹, 熊俊平, 赵 林, 何晓燕, 石小玉△
(南昌大学医学院1基础医学院病理生理学教研室,2江西省医学生物高技术重点实验室,3基础医学院组织与胚胎学教研室,4基础医学院人体解剖学教研室,江西 南昌330006)
纤维化发生可能是由于I 型与II 型细胞因子之间失平衡而引起的,并以II 型细胞因子反应为主。I型细胞因子可促进正常组织结构的修复,II 型细胞因子可使成纤维细胞增生活化,最终导致细胞外基质蛋白沉积和纤维化[1-2]。I 型细胞因子包括干扰素γ(interferon γ,IFN-γ)、白细胞介素2(interleukin 2,IL-2)、IL-12 及IL-18 等,II 型细胞因子包括IL-4、IL-5、IL-10、IL-13 和单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)等。体内、外研究资料表明,当细胞因子的平衡以II 型细胞因子占优势时,就会发生纤维化[3]。IL-4、IL-13 等II 型细胞因子是通过刺激和激活转化生长因子β(transforming growth factor β,TGF-β)信号转导通路来促进纤维生成[4]。
IFN-γ 是NK 细胞和T 淋巴细胞产生的具有高度生物活性的一种细胞因子。近年来,越来越多的研究显示IFN-γ 对纤维化的形成具有强烈的抑制作用[5],具有抑制培养的成纤维细胞增生及胶原聚集等作用,与II 型细胞因子IL-4 及TGF-β 具有拮抗作用[6],因此被认为是很有前途的抗纤维化药物之一[7]。IFN-γ 对IL-13 的促胶原合成作用是否具有拮抗作用?是否对瘢痕纤维化具有治疗作用?其效果如何?以上问题仍不清楚。我们前期实验结果显示IL-13 能够促进成纤维细胞的增殖、I 型前胶原mRNA 的转录和I 型胶原蛋白的合成,并证实了IL-13 的这些作用是通过将JAK/STAT6 信号转导中的转录因子STAT6 磷酸化来实现的[8-9]。本实验拟探明在体外培养条件下IFN-γ 对致纤维化因子IL-13对成纤维细胞促胶原合成作用的拮抗作用及其对纤维化的治疗效果,为进一步探讨纤维化的机制提供实验依据。
材 料 和 方 法
1 材料
1.1 细胞株 成纤维细胞3T3 细胞株购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂 细胞因子IL-13 购于PeproTech;DMEM 培养基购于Gibco-BRL,按说明书配制,4 ℃保存;特级胎牛血清购于杭州四季青生物制品公司,使用前56 ℃水浴30 min 灭活补体后分装,-20 ℃保存。MTT 购于Sigma;DMSO 购于上海华美生物工程公司。重组人IFN-γ 购于上海克隆生物高技术有限公司。羟脯氨酸试验检测盒购于南京建成生物工程研究所。RT-PCR 试剂购于TaKaRa。Western blotting 试剂:羊抗I 型胶原蛋白抗体、羊抗actin 抗体购于Santa Cruz;兔抗羊IgG-HRP 购于北京中山生物技术有限公司。
1.3 RT-PCR 引物的设计和合成 引物利用Primer Premier 5.0 软件,参照GenBank 中I 型胶原α1 基因(collagen type I alpha 1,Col1A1)(登录号为NM-007742)的序列设计,由TaKaRa 公司(大连宝生物)合成。Col1A1 引物序列(产物378 bp):上游引物5’-ACAGAGGCATAAAGGGTCA-3’,下游引物5’-CAAGGTCACGGTCACGAA-3’;β-actin 引物序列(产物511 bp):上游引物5’-AgCGGGAAATCGTGCGTGAC -3 ’, 下 游 引 物 5 ’-AAGCATTTGCGGTGGACGAT -3’。
2 方法
2.1 成纤维细胞常规培养及分组 成纤维细胞常规培养在含15%胎牛血清、1 ×105U/L 青霉素和100 mg/L 链霉素的DMEM 培养液中,置于37 ℃、5% CO2孵箱中培养。取对数生长期成纤维细胞,调整其细胞密度为(5 ×108)~(1 ×109)/L。在羟脯氨酸释放实验、RT-PCR 和Western blotting 实验中均分为实验组和空白对照组。实验前,每组细胞均用无血清DMEM 培养12 ~16 h,实验组:IL-13(100 μg/L)(浓度参考见文献[9])+IFN-γ(4 ×105U/L)作用成纤维细胞24、48 和72 h,再进行以上各实验。然后进行对比实验,分成4 组:空白对照组、IFN-γ 组、IL-13 组和IFN-γ+IL-13 组,72 h 后检测Col1A1 mRNA 表达和I 型胶原蛋白的表达水平。
2.2 MTT 实验 将细胞以2.5 ×107/L 密度接种于96 孔培养板中,每孔100 μL,37 ℃、5% CO2孵箱中培养至细胞贴壁,分6 组,分别为:空白组(不加细胞)、对照组(不加细胞因子)、IFN-γ(2 ×105U/L)组、IFN-γ(4 ×105U/L)组、IFN-γ(6 ×105U/L)组和IFN-γ(8 ×105U/L)组,每组3 孔,共接种18 孔,5%CO2、37 ℃温箱中培养20 h,每孔加入MTT 20 μL,继续培养4 h,吸弃培养基,用无血清培养液洗1 次,加150 μL 二甲基亚砜溶解沉淀,振荡10 min,结晶物溶解。比色:选择570 nm 波长,在酶联免疫检测仪上,以空白孔调零,测定各孔吸光度(A)。以空白未加药物组作为对照组,其余各组抑制率(%)=(1-A实验组/A对照组)×100%。
2.3 羟脯氨酸释放实验( 总胶原含量测定) 细胞培养上清液进行羟脯氨酸释放实验,比较各实验组和空白对照组羟脯氨酸含量的差别,按试剂盒说明操作。
2.4 RT-PCR 法 各组细胞均用SV total RNA isolation system 提取总RNA,逆转录合成第1 条cDNA,使用Col1A1 和β-actin 特异性引物,按照TKR RTPCR kit 标准程序进行扩增,内参照β-actin 与Col1A1 在同一管内扩增,进行1.5%琼脂糖电泳。
2.5 Western blotting 实验 各组细胞用RIPA buffer将细胞充分裂解,Bio-Rad Dye Reagent 进行蛋白定量。调整样品中蛋白质含量,均以20 μg 蛋白量上样进行7%SDS-聚丙烯酰胺凝胶电泳,硝酸纤维膜转印。50 g/L 脱脂奶粉4 ℃封闭,TBS 洗涤,经I 型胶原蛋白第I 抗体和第II 抗体分别孵育后,ECL 试剂显像。再利用清除缓冲液清除硝纤膜上已结合的I抗和II 抗,重新经β-actin I 抗、II 抗孵育后,再次显像,作为内参照。对结果利用凝胶定量软件Quantity One(Bio-Rad)进行吸光度分析。
3 统计学处理
实验重复3 次。数据以均数±标准差(mean ±SD)表示,以单因素方差分析进行差异显著性检验。以P <0.05 为差异有统计学意义。
结 果
1 IFN-γ 对成纤维细胞增殖的影响
用不同浓度IFN-γ 作用成纤维细胞,MTT 法检测IFN-γ 对成纤维细胞增殖的作用,当IFN-γ 浓度在2 ×105U/L ~8 ×105U/L 时,细胞抑制率明显上升。为此,我们取4 ×105U/L 作为IFN-γ 对成纤维细胞作用的浓度,见图1。
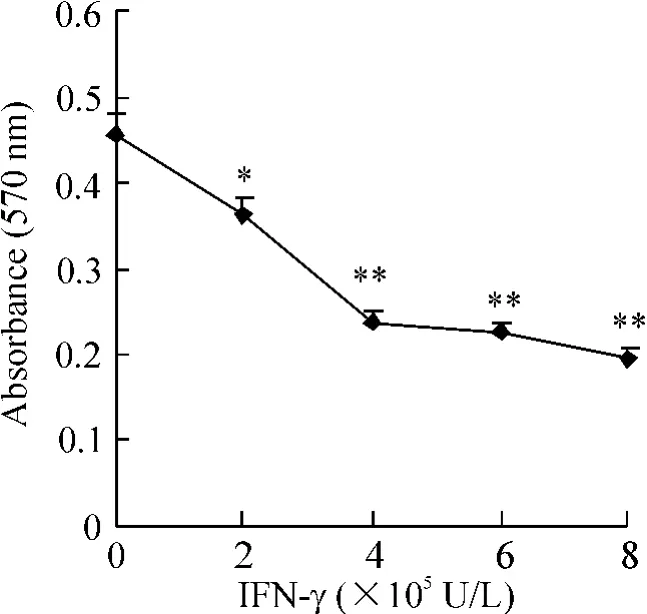
Figure 1. The anti-proliferation effect of IFN-γ on fibroblasts.Mean±SD.n=3. * P <0.05,**P <0.01 vs 0 U/L.图1 不同浓度IFN-γ 对成纤维细胞生长的影响
2 IFN-γ 抑制IL-13 对成纤维细胞分泌总胶原含量的影响
羟脯氨酸是胶原分解代谢的产物,机体内的羟脯氨酸主要存在胶原中,因此,羟脯氨酸是反映胶原含量的重要指标。前期实验结果显示IL-13 刺激成纤维细胞24 h 后分泌的总胶原含量增高,48 h 组显著高于对照组(P <0.05),持续至72 h(P <0.01),本研究结果显示IFN-γ +IL-13 作用成纤维细胞后,在24 h 与空白对照组相比可见分泌的总胶原含量减少,48 h 显著减少(P <0.05),72 h 减少更加明显(P<0.01),见图2。
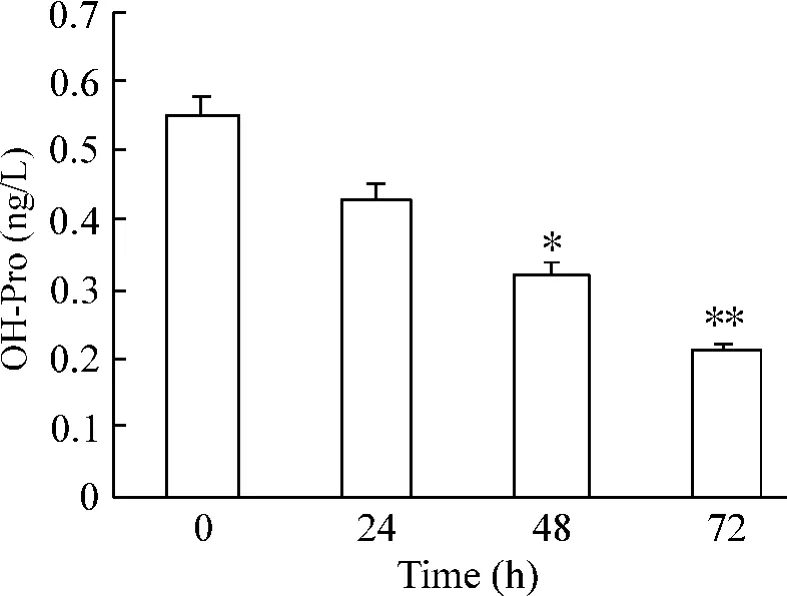
Figure 2. Hydroxyproline release of fibroblast cells in experimental group.Mean±SD. n =3. * P <0.05,**P <0.01 vs 0 h.图2 IFN-γ+IL-13 作用后成纤维细胞羟脯氨酸的变化
3 IFN-γ 抑制IL-13 对Col1A1 mRNA 水平的影响
RT-PCR 结果显示,在空白对照组、IFN-γ 和IL-13共同作用的实验各组都出现了明显的Col1A1 mRNA 表达,比较各实验组Col1A1 mRNA 表达与空白对照组相比,实验24 h 组有所减弱,实验48 h 和72 h 组有显著减弱(P <0.05 或P <0.01),见图3。进一步进行各因素比较,分成空白对照组、IFN-γ 组、IL-13 组和IFN-γ+IL-13 组,72 h 后观察到IFN-γ 组Col1A1 mRNA 表达显著低于空白对照组(P <0.05),IL-13 组显著高于空白对照组(P <0. 05),而IFN-γ+IL-13 组显著低于其它组(P <0.01),见图4。这说明IFN-γ 可抑制IL-13 的促成纤维细胞Col1A1 mRNA 表达作用。
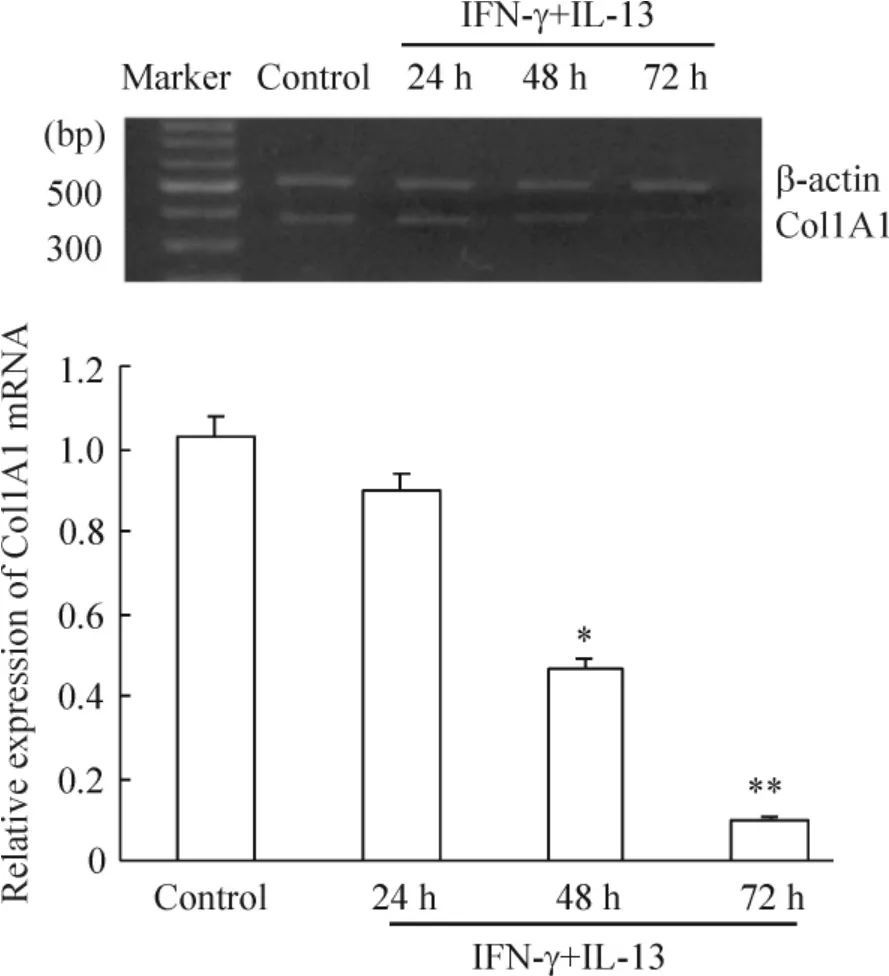
Figure 3. Effect of IFN-γ on IL-13-induced Col1A1 mRNA expression. Mean±SD. n=3. * P <0.05,**P <0.01 vs control.图3 IFN-γ 对IL-13 促成纤维细胞Col1A1 mRNA 表达的影响
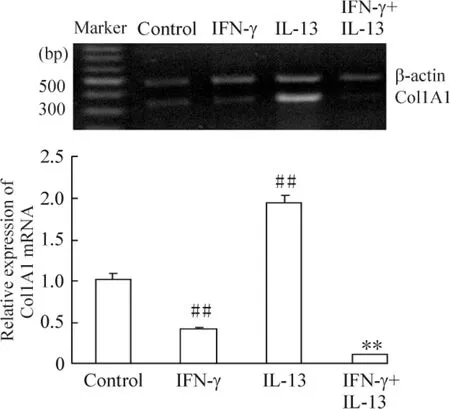
Figure 4. Effects of IFN-γ and IL-13 on Col1A1 mRNA expression. Mean±SD. n =3. * P <0.05,**P <0.01 vs control;##P <0.01 vs IFN-γ+IL-13.图4 IFN-γ 和IL-13 对成纤维细胞Col1A1 mRNA 表达的影响
4 IFN-γ 抑制IL-13 的促成纤维细胞I 型胶原蛋白表达作用
Western blotting 结果显示,空白对照组及实验各组均出现了I 型胶原蛋白条带,灰度分析表明IL-13(100 μg/L)和IFN-γ(4 ×105U/L)作用24 h 后,I 型胶原蛋白表达有所减弱,48 h 组显著减弱(P <0.05),72 h 组减弱最明显(P <0.01),见图5。进一步在蛋白水平进行各因素比较,分成空白对照组、IFN-γ 组、IL-13 组和IFN-γ+IL-13 组,72 h 后观察到IFN-γ 组成纤维细胞I 型胶原蛋白的表达显著低于空白对照组(P <0.05),IL-13 组显著高于空白对照组(P <0.05),而IFN-γ +IL-13 组显著低于其它组(P <0.01),见图6。这说明IFN-γ 抑制IL-13 的促成纤维细胞I 型胶原蛋白表达作用。
讨 论
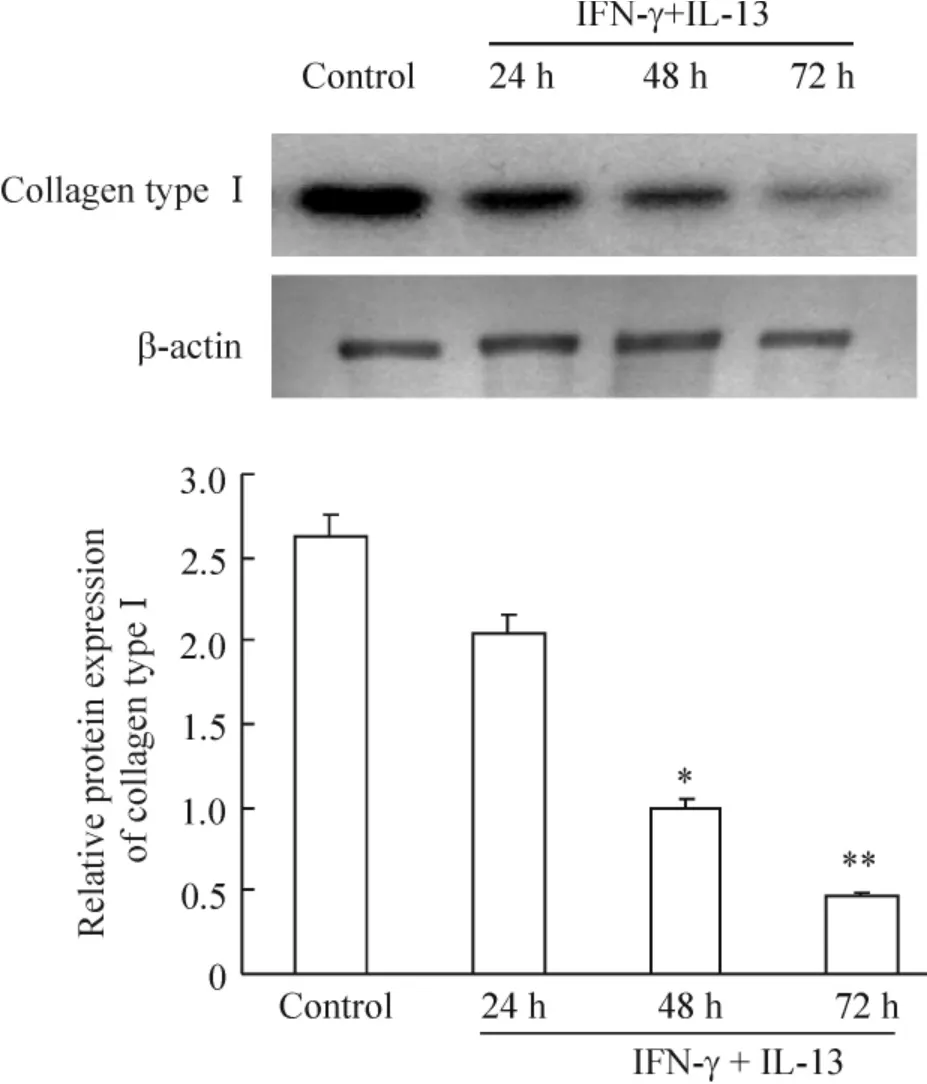
Figure 5. Effect of IFN-γ on IL-13-induced expression of collagen type I. Mean ± SD. n =3. * P <0.05,**P <0.01 vs control.图5 IFN-γ 对IL-13 促成纤维细胞I 型胶原蛋白表达的影响
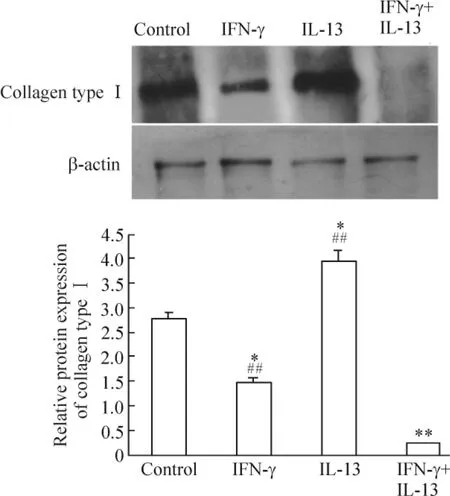
Figure 6. Effects of IL-13 and IFN-γ on the expression of collagen type I. Mean ± SD. n =3. * P <0.05,**P <0.01 vs control;##P <0.01 vs IFN-γ+IL-13.图6 IFN-γ 和IL-13 对成纤维细胞I 型胶原蛋白表达的影响
纤维化的发生可以影响到包括心、肺、肝、肾及皮肤等器官,纤维化已经成为医学上一个重要的病因学问题[10-11]。动物实验和临床研究均表明,II 型细胞因子和TGF-β 在纤维化形成过程中起着非常重要的作用,而在I 型细胞因子占优势的小鼠组织中与修复相关的许多基因被上调,这时无纤维化显著活化的证据,说明IL-13 和TGF-β 为致纤维化因子,而IFN-γ 具有抑制纤维化作用。Tredget 等[12-13]证实瘢痕组织和成纤维细胞的TGF-β mRNA 和蛋白水平在体内外被IFN-γ 和IFN-α 中和;并且观察了烧伤后1年发展成肥厚性瘢痕的病人,1 年内连续用流式细胞术观察T细胞和细胞因子的作用,发现损伤1个月内血清中未测到IFN-γ,损伤2 个月后IL-4 和IL-13阳性Th2 细胞比对照组显著增加,在瘢痕组织中IFN-γ mRNA 水平下降而IL-4 mRNA 水平增高,这充分说明了烧伤后肥厚性瘢痕病人极化的Th2 细胞效应。Aliprantis 等[14]和Lakos 等[15]的研究表明IL-13是一个重要的前纤维化介质,通过下调转录因子Tbet 减少组织IFN-γ 水平而促进博莱霉素诱导的皮肤纤维化。不少实验在一些纤维增生紊乱性疾病的研究中观察到IFN-γ 能抑制成纤维细胞分泌胶原[16]。Jordana 等[17]应用IFN-γ 治疗博莱霉素诱发的大鼠纤维化,发现组胺和羟脯氨酸的含量明显降低,肺纤维化的程度减轻。
本研究观察到4 ×105U/L 浓度的IFN-γ 对体外培养的成纤维细胞能达到最大抑制作用,并能抑制IL-13 的促Col1A1 转录和I 型胶原蛋白合成作用,说明I 型细胞因子的抗纤维化效应可以对抗II 型细胞因子的纤维化效应,也进一步证实了IFN-γ 有抑制纤维化的作用。Grassegger 等[18]确定了IFN-γ 在临床皮肤病中的显著作用,认为IFN-γ 是抗增殖和抗纤维化的关键的免疫调节因子,可应用于多种纤维化条件下,如硬皮病性皮肤纤维化、自发性肺纤维化、放射后皮肤纤维化等。分析其机制可能是:(1)抑制成纤维细胞有丝分裂;(2)降低I 和III 型前胶原α 链的mRNA 稳态水平;(3)刺激胶原酶的产生,并能抑制胶原合成所必需的脯氨酸羟化酶的产生,因此,IFN-γ 具有抑制创伤修复的作用,是创伤与瘢痕修复的负性调节因子。
[1] Borthwick LA,Wynn TA,Fisher AJ. Cytokine mediated tissue fibrosis[J]. Biochim Biophys Acta,2012,Oct 6.[Epub ahead of print]
[2] Wynn TA,Ramalingam TR.Mechanisms of fibrosis:therapeutic translation for fibrotic disease[J]. Nat Med,2012,18(7):1028-1040.
[3] Shao DD,Suresh R,Vakil V,et al. Pivotal Advance:Th-1 cytokines inhibit,and Th-2 cytokines promote fibrocyte differentiation[J]. J Leukoc Biol,2008,83(6):1323-1333.
[4] 肖 莉,敖 然,李振华,等. 重组白细胞介素13 促进成纤维细胞增殖及胶原合成[J]. 中国病理生理杂志,2005,21(8):1579-1583.
[5] Li F,Li QH,Wang JY,et al. Effects of interferon-gamma liposomes targeted to platelet-derived growth factor receptor-beta on hepatic fibrosis in rats[J]. J Control Release,2012,159(2):261-270.
[6] Navarro-Partida J,Martinez-Rizo AB,Gonzalez-Cuevas J,et al. Pirfenidone restricts Th2 differentiation in vitro and limits Th2 response in experimental liver fibrosis[J]. Eur J Pharmacol,2012,678(1-3):71-77.
[7] Bansal R,Post E,Proost JH,et al. PEGylation improves pharmacokinetic profile,liver uptake and efficacy of interferon gamma in liver fibrosis[J]. J Control Release,2011,154(3):233-240.
[8] 熊丽霞,石小玉,李文林,等. 白细胞介素13 刺激成纤维细胞胶原基因转录和胶原蛋白的合成[J]. 中国组织工程研究与临床康复,2007,11(23):4466-4469.
[9] 熊丽霞,李文林,蔡震宇,等. 白细胞介素13 通过STAT6 途径促进瘢痕成纤维细胞株胶原合成[J]. 中国细胞生物学学报,2010,32(6):868-872.
[10]高俊茶,王 妍,姜慧卿.索拉非尼抑制人肝星状细胞胶原合成[J].中国病理生理杂志,2012,28(1):85-89.
[11]张丽景,金成艳,王果元,等.蛋白酪氨酸磷酸酶SHP-2对Ang Ⅱ刺激的心肌成纤维细胞增殖的影响[J].中国病理生理杂志,2012,28(2):244-248.
[12]Tredget EE,Yang L,Delehanty M,et al. Polarized Th2 cytokine production in patients with hypertrophic scar following thermal injury[J]. J Interferon Cytokine Res,2006,26(3):179-189.
[13]Tredget EE,Wang R,Shen Q,et al. Transforming growth factor-beta mRNA and protein in hypertrophic scar tissues and fibroblasts:antagonism by IFN-alpha and IFN-gamma in vitro and in vivo[J]. J Interferon Cytokine Res,2000,20(2):143-151.
[14]Aliprantis AO,Wang J,Fathman JW,et al. Transcription factor T-bet regulates skin sclerosis through its function in innate immunity and via IL-13[J]. Proc Natl Acad Sci U S A,2007,104(8):2827-2830.
[15]Lakos G,Melichian D,Wu M,et al. Increased bleomycin-induced skin fibrosis in mice lacking the Th1-specific transcription factor T-bet[J]. Pathobiology,2006,73(5):224-237.
[16] Pacanowski MA,Amsden GW. Interferon gamma-1b in the treatment of idiopathic pulmonary fibrosis [J]. Ann Pharmacother,2005,39(10):1678-1686.
[17]Jordana M,Ohno I,Xing Z,et al. Cytokines in lung and airways fibrosis[J]. Reg Immunol,1993,5(3-4):201-206.
[18]Grassegger A,Hopfl R. Significance of the cytokine interferon gamma in clinical dermatology[J]. Clin Exp Dermatol,2004,29(6):584-588.

