槲皮素对重症急性胰腺炎肺损伤大鼠肺泡中性粒细胞凋亡的影响
徐晓武, 杨小敏, 金洲祥, 李利义, 朱少俊
(1温州医学院附属第二医院普外科,浙江 温州325027;2温州市第三人民医院病理科,浙江 温州325000)
急性肺损伤(acute lung injury,ALI)是重症急性 胰腺炎(severe acute pancreatitis,SAP)时胰外最常见的并发症,临床上发生率高达70%[1],相当一部分患者进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),是患者早期死亡的主要原因[2-3]。ALL 时大量的中性粒细胞(polymorphonuclear neutrophil,PMN)在肺泡聚集,并且由于局部炎症介质的作用使PMN 发生凋亡延迟,凋亡延迟的PMN 在炎症部位通过呼吸爆发产生大量自由基、蛋白水解酶及炎症介质等有害物质造成组织损伤,增加肺组织的炎症反应,从而导致加重肺损伤[4]。槲皮素(quercetin,Que)是一种黄酮类化合物,具有清除氧自由基、抗炎、调节免疫功能、降血压、减轻心肌缺血/再灌注损伤、钙拮抗和蛋白激酶C 抑制等多种生物学活性。有研究表明槲皮素对内毒素延迟中性粒细胞凋亡效应具有抑制作用[5],但对急性胰腺炎伴发肺损伤时肺组织中性粒细胞凋亡有何影响,尚缺乏深入研究,本实验研究槲皮素对重症急性胰腺炎肺损伤大鼠肺泡中性粒细胞凋亡的影响及机制,为槲皮素在重症急性胰腺炎肺损伤中的应用提供理论依据。
材 料 和 方 法
1 主要试剂、仪器及动物
槲皮素(Sigma),Percoll 分离液(Pharmacia),RPMI-1640(Gibco),caspase-3 活性检测试剂盒(Promega),Annexin V-FITC 凋亡检测试剂盒(Sigma),Bradford 蛋白质定量检测试剂盒(上海生工生物技术有限公司),兔抗Bax 单克隆抗体、兔抗Bcl-2 单克隆抗体、兔抗β-actin 单克隆抗体和聚偏二氟乙烯(PVDF)膜(北京中杉金桥生物工程有限公司)。FACSCalibur 流式细胞仪(BD),牛磺胆酸钠(Sigma),REVCO 二氧化碳培养箱(Asheville),高速冷冻离心机MR23i(Jouan),Elx808 全自动酶标仪(Bio-Tek)。其它试剂均为国产分析纯。清洁级SD 大鼠48 只(购自温州医学院动物实验中心),体重200 ~250 g,雌雄不拘。
2 动物模型与分组
清洁级SD 大鼠48 只(购自温州医学院动物实验中心),体重200 ~250 g,雌雄不拘,随机分为sham组、SAP 组、槲皮素低剂量组及槲皮素高剂量组,每组12 只。Sham 组仅行开关手术,胰腺炎组经胆胰管逆行注射5%牛磺胆酸钠(2 mL/kg)制作SAP 模型。槲皮素组在SAP 模型基础上予槲皮素干预,槲皮素溶于二甲亚砜溶液中,在注射制模前30 min 腹腔注射(分别为50 mg/kg 和100 mg/kg)。Sham 组和SAP 组给予等量生理盐水。术后24 h 处死大鼠,支气管肺泡灌洗分离收集肺泡PMN,取胰腺和肺标本送检。
3 支气管肺泡灌洗分离收集肺泡PMN
术后24 h 颈动脉放血处死大鼠,参照文献[6-7]分离收集肺泡PMN,将动物麻醉后,切开气管插管,行肺泡灌洗,注入25 mL PBS。总回收率为90.52%。将支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)离心(1 300 r/min)。沉淀的细胞涂片、瑞氏染色,高倍镜下计数200 个细胞进行分类。将BALF中沉淀的细胞用PBS 清洗后,用密度梯度离心液Percoll(密度分别为1.085 和1.095)分离肺泡PMN。
4 PMN 形态学观察
将肺泡PMN 接种在盖玻片上(1 ×109/L),4%多聚甲醛4 ℃固定5 min,PBS 洗3 次后,点加Hoechst 33258 染色液(10 mg/L),室温孵育10 min,PBS洗片3 次后,用滤纸沾去多余液体,封片剂封片后荧光显微镜观察。
5 Annexin V-FITC/PI 双染法检测肺泡PMN 凋亡指数
将肺泡PMN 用冰PBS 缓冲液冲洗后,悬浮于结合液中,调整浓度至1 ×109/L。取445 μL 液体加5 μL Annexin V-FITC 及50 μL PI(100 mg/ L),室温下黑暗处孵育15 min,FACSCalibur 流式细胞仪检测,同时以不加Annexin V-FITC 及PI 的一管作为阴性对照。Annexin V/PI 双坐标图上散点图右下象限即Annexin V+/PI-细胞,为凋亡细胞,以占所有细胞的百分数表示PMN 的凋亡指数。
6 Western blotting 检测Bax 和Bcl-2 蛋白表达
细胞裂解液裂解细胞,Bradford 法测定蛋白浓度,取总蛋白20 μg 加样,经15%SDS-PAGE 电泳后,电转移半干转法将蛋白转印至聚偏二氟乙烯(PVDF)膜上;含5%脱脂奶粉PBS 溶液封闭,4 ℃孵育过夜。次日复温1 h;弃去牛奶,加入Bax 和Bcl-2多克隆抗体(1∶200),4 ℃孵育过夜;PBS 洗膜3 次,每次15 min;应用辣根过氧化物酶标记的Ⅱ抗(1∶200)室温孵育1 h;PBS 洗膜3 次,每次15 min;荧光试剂盒显影曝光,采用Quantity One 软件进行图像灰度分析,计算Bax 和Bcl-2 与β-actin 的灰度比值,以表示Bax 和Bcl-2 的相对表达量。
7 检测caspase-3 活性
将细胞以1 ×108/L 浓度接种于96 孔板,每孔100 μL,独立重复5 次,以不加药组为空白对照,每孔加入混合后的caspase-3 试剂100 μL,孵育3 h 后取出96 孔板,检测荧光分光光度计波长405 nm 处的吸光度值,空白孔作对照,计算实验组吸光度与对照组吸光度的比值,确定活化程度。
8 组织学检查
将各组大鼠的肺组织标本常规固定、包埋、HE染色,病理医师单盲阅片,按Osman 等[8]的标准进行肺组织学评分。
9 统计学处理
结 果
1 PMN 形态学观察
Hoechst 33258 染色显示,sham 组见较多的肺泡PMN 凋亡,凋亡的肺泡PMN 表现为染色质凝集,细胞核变小,细胞核呈固缩状或斑块状;与sham 组比较,SAP 组凋亡的PMN 显著减少;槲皮素预处理后凋亡细胞数目较SAP 组增加,见图1。
2 流式细胞术检测PMN 凋亡指数
Sham 组肺泡PMN 凋亡指数为23.28%,SAP 组肺泡PMN 凋亡指数为7.32%,较sham 组明显降低(P <0.01);Que 组肺泡PMN 凋亡指数为16.13%,较SAP 组明显增高(P <0.05),见图2。
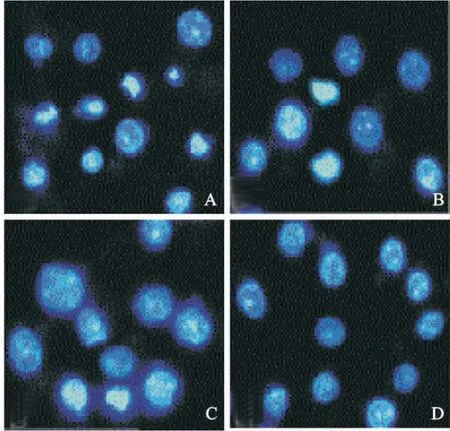
Figure 1. Effects of quercetin (Que)on morphology of alveolar polymorphonuclear neutrophils from severe acute pancreatitis (SAP)rats. A:sham;B:Que at high dose;C:Que at low dose;D:SAP group.图1 槲皮素对肺泡PMN 形态学改变的影响
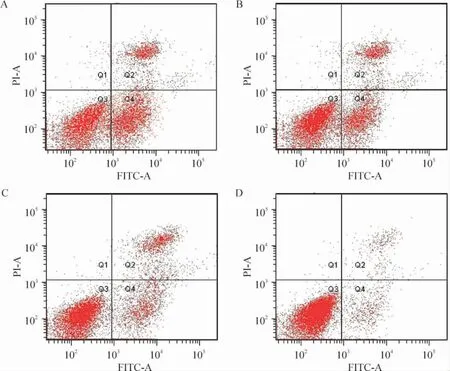
Figure 2. Effects of Que on apoptosis of alveolar polymorphonuclear neutrophils from SAP rats. A:sham;B:Que at high dose;C:Que at low dose;D:SAP group.图2 槲皮素对肺泡PMN 凋亡的影响
3 检测肺泡PMN caspase-3 活性
Sham 组、Que 高剂量组、Que 低剂量组及SAP 组的450 nm 吸光度值分别为:0.250 ±0.042、0.190 ±0.028、0.160 ±0.026 及0.110 ±0.032。与sham 组比较,SAP 组caspase-3 活性明显降低(P <0.01),与SAP 组比较,Que 组caspase-3 活性增强(P <0.01),且呈剂量依赖性(P <0.01)。
4 Western blotting 检测肺泡PMN Bax 和Bcl-2 蛋白的表达
Western blotting 结果显示,与sham 组比较,SAP组Bax 蛋白表达减弱,Bcl-2 蛋白表达增强(P <0.01),与SAP 组比较,Que 组Bax 蛋白表达明显增强,Bcl-2 蛋白表达减弱(P <0.05),见图3、表1。
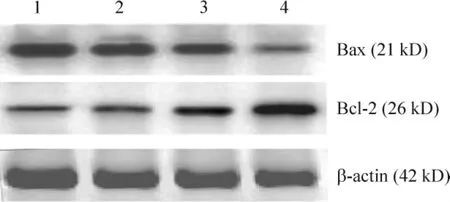
Figure 3. Effects of Que on Bax and Bcl-2 protein expression in alveolar polymorphonuclear neutrophils from SAP rats.1:sham;2:Que at high dose;3:Que at low dose;4:SAP group.图3 各组肺泡PMN Bax 和Bcl-2 蛋白的表达
表1 槲皮素对肺泡PMN Bax 和Bcl-2 蛋白表达的影响Table 1. Effects of Que on Bax and Bcl-2 protein expression in alveolar polymorphonuclear neutrophils from SAP rats(±s.n=12)
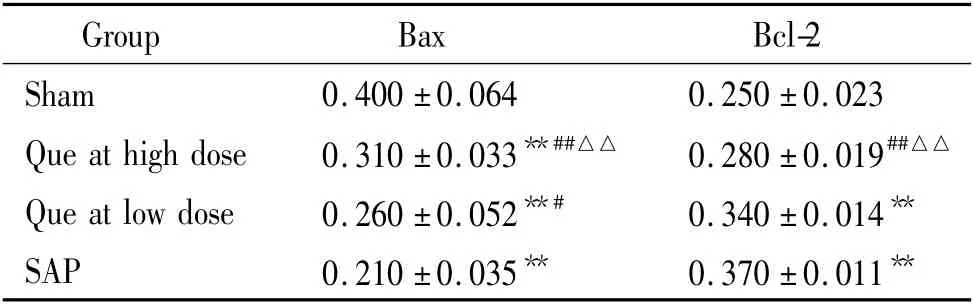
表1 槲皮素对肺泡PMN Bax 和Bcl-2 蛋白表达的影响Table 1. Effects of Que on Bax and Bcl-2 protein expression in alveolar polymorphonuclear neutrophils from SAP rats(±s.n=12)
**P <0.01 vs sham;#P <0.05,##P <0.01 vs SAP;△△P <0.01 vs Que at low dose.
Group Bax Bcl-2 Sham 0.400±0.064 0.250±0.023 Que at high dose 0.310±0.033**##△△ 0.280±0.019##△△Que at low dose 0.260±0.052**# 0.340±0.014**SAP 0.210±0.035** 0.370±0.011**
5 肺组织镜下病理评分结果
Sham 组未见明显病理改变;SAP 组可见肺间质中小血管扩张,肺泡腔内有炎症渗出物及淋巴细胞浸润;Que 组未见明显扩张血管,炎性渗出物及淋巴细胞浸润减轻,见图2。Sham 组、Que 高剂量组、Que低剂量组及SAP 组评分的平均秩次分别为:6.54、18.46、30.50 及42.50。与sham 组比较,SAP 组评分的平均秩次明显升高(P <0. 01),与SAP 组比较,Que 组评分的平均秩次明显降低(P <0.01)。
讨 论
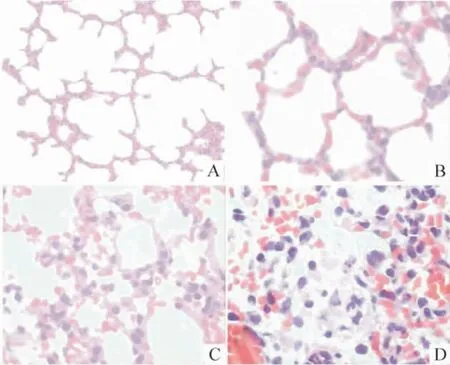
Figure 4. Effects of Que on pathological alteration of lung tissues in SAP rats(HE staining,×400). A:sham;B:Que at high dose;C:Que at low dose;D:SAP group.图4 槲皮素对大鼠肺组织病理学改变的影响
急性肺损伤是重症急性胰腺炎患者早期死亡的主要原因。Grommes 等[9]研究表明,PMN 凋亡延迟且过度活化可能是肺损伤的重要途径。PMN 的缺失可以减轻由胰腺炎引起的肺损伤[10]。PMN在循环系统中存活6 ~8 h,以细胞凋亡的形式清除。正常条件下,激活的PMN 在病原体消除后很快就会被机体清除,但是某些炎症因子如LPS、TNF-α、IL-8、IL-6、GM-CSF 抑制PMN 的凋亡。凋亡延迟导致PMN在ALI 发生过程中向肺组织聚集。ALI/ARDS 时PMN 在肺毛细血管内大量黏附、聚集,继之游出肺血管床,移至肺泡腔,并持续活化,一方面通过释放活性氧、蛋白酶及脂类代谢产物等炎症介质直接损伤肺组织;另一方面通过激活核因子κB(nuclear factor kappa B,NF-κB)诱导IL-1β、IL-8、TNF-α 等促炎症细胞因子的释放引起瀑布效应,在炎症部位生存时间明显延长。
本研究发现,SAP 组PMN 凋亡指数降低,Bax 蛋白表达减弱,Bcl-2 蛋白表达增强,caspase-3 活性减弱(P <0.01);而槲皮素预处理后PMN 凋亡指数升高,Bax 蛋白表达增强,Bcl-2 蛋白表达减弱,caspase-3 活性增强。提示SAP 时PMN 凋亡延迟且持续活化,导致大量炎症介质释放,加重肺损伤。调控细胞凋亡的基因可分为凋亡促进基因和凋亡抑制基因两类。bcl-2 基因属于bcl-2 家族基因,是最重要的细胞凋亡抑制基因。bax 是bcl-2 家族中重要的细胞凋亡诱导基因,其编码蛋白氨基酸序列有21%与Bcl-2 同源,Bax 可与Bcl-2 形成同源或异源二聚体,具有抑制Bcl-2、促进细胞凋亡的作用。Bcl-2 与Bax 两者之间的比例决定了细胞的命运,若Bax 占多数,则Bcl-2被抑制,凋亡被诱导,细胞死亡;反之则Bax 受到抑制,细胞得以生存[11]。
Caspase 是一组以天冬氨酸为底物的半胱氨酸蛋白酶家族,其家族成员在细胞凋亡过程中起着关键作用[12]。Caspase 高表达可诱发细胞凋亡的发生,其中caspase-3 是细胞凋亡过程中的主要效应因子。又是多种凋亡途径共同作用的因子,其表达水平的高低决定着细胞凋亡程度[13]。因此,本研究采用荧光分光光度计法检测caspase-3 活性,SAP 组caspase-3 活性减弱(P <0.01);而槲皮素预处理后caspase-3活性增强。因此,槲皮素能诱导PMN 发生凋亡,激活caspase-3 是其中机制之一。
总之,槲皮素通过上调Bax 蛋白表达,下调Bcl-2蛋白表达,增强caspase-3 活性,诱导PMN 发生凋亡,减轻SAP 大鼠肺损伤。具体机制有待进一步研究,深入研究其作用机制将有助于减轻SAP 引起的肺损伤,降低早期死亡率。
[1] Akbarshahi H,Rosendahl AH,Westergren-Thorsson G,et al. Acute lung injury in acute pancreatitis:awaiting the big leap[J]. Respir Med,2012,106(9):1199-1210.
[2] Elder AS,Saccone GT,Dixon DL. Lung injury in acute pancreatitis:mechanisms underlying augmented secondary injury[J]. Pancreatology,2012,12(1):49-56.
[3] De Campos T,Deree J,Coimbra R. From acute pancreatitis to end-organ injury:mechanisms of acute lung injury[J]. Surg Infect,2007,8(1):107-120.
[4] Perl M,Lomas-Neira J,Chung CS,et al. Epithelial cell apoptosis and neutrophil recruitment in acute lung injury:a unifying hypothesis?What we have learned from small interfering RNAs[J]. Mol Med,2008,14(7-8):465-475.
[5] 宋传旺,刘佳佳,段承刚,等. 槲皮素对LPS 延迟中性粒细胞自发性凋亡效应的抑制作用[J]. 中国免疫学杂志,2005,21(1):13-16.
[6] Reis A,Totsch M,Shennib H,et al. Bronchoalveolar lavage:results of sequential,selective techniques in viable murines[J]. Am J Respir Crit Care Med,1994,150(2):547-550.
[7] Callol L,Barbero EA,Blasco R,et al. New method of collection of bronchioloalveolar lavage in rat[J]. Respir Med,1994,88(5):399.
[8] Osman MO,Kristensen JU,Jacobsen NO,et al. A monoclonal anti-interleukin 8 antibody (WS-4)inhibits cytokine response and acute lung injury in experimental severe acute necrotising pancreatitis in rabbits[J]. Gut,1998,43(2):232-239.
[9] Grommes J,Soehnlein O. Contribution of neutrophils to acute lung injury[J]. Mol Med,2011,17(3-4):293-307.
[10] Bhatia M,Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome[J]. J Pathol,2004,202(2):145-156.
[11] Dong R,Chen X,Wu T,et al. Elemene for the treatment of lung cancer[J]. Cochrane Database Syst Rev,2007,17(4):CD006054.
[12] Chen JC,Lu KW,Lee JH,et al. Gypenosides induced apoptosis in human colon cancer cells through the mitochondria-dependent pathways and activation of caspase-3[J]. Anticancer Res,2006,26(6B):4313-4326.
[13] Törmänen-Näpänkangas U,Sonic Y,Kahlos K,et al. Expression of caspase-3,-6 and -8 and their relation to apoptosis in non-small cell lung carcinoma[J]. Int J Cancer,2001,93(2):192-198.

