Runx2 通过抑制细胞巨自噬以诱导C2C12 细胞向成骨细胞分化*
余守和, 洪 岸
(基因工程药物国家工程研究中心,教育部基因组药物工程研究中心,广东省生物工程药物重点实验室,暨南大学生命科学技术学院生物医药研究院,广东 广州510632)
Runx2(又称Cbfa1、AML3 或PEBPa2A)是调节成骨分化及骨发育的关键因子,由Runt 结构域介导与顺式原件OSE2(5'-TGTGGT-3')结合启动靶基因转录[1]。Runx2 缺陷型的纯合体小鼠缺乏骨骼矿化的能力,产后立即死亡;杂合体可存活,但骨骼系统存在缺陷[2]。Runx2 过表达的转基因小鼠出现骨质疏松的症状[3]。可见Runx2 在骨发育过程中的重要作用。
细胞巨自噬(macroautophagy,后称之为自噬)是互补于泛素-蛋白酶体的另外一种胞内蛋白降解途径,具有进化保守性[4],是维持细胞稳态的重要因素。细胞自噬的顺利进行依赖于胞内一种囊泡的形成,即自噬体(autophagosome)。在自噬体中包被有受损的细胞器,错误折叠的蛋白,或蛋白聚集体等,它通过与溶酶体(lysosome)融合形成自噬溶酶体(autolysosome)以降解这些包被物[5-6]。自噬具有高度选择性,这依赖于货物受体(cargo receptor)与包被物的识别与结合,如Nbr1 与p62[7]。在生理条件下,细胞存在基础水平的自噬,这种自噬具有维持细胞正常功能的作用[8]。在环境胁迫时自噬会被诱导增强,这种自噬则有抵御胁迫,延长细胞生存期,增强其活力的作用[9]。自噬可参与众多生理过程的调节,如神经退行性疾病发生,肿瘤形成,病原体感染及衰老等。目前发现自噬对机体骨形成及骨骼发育有重要调节作用[10],但相关分子机制并不清楚。
在本研究中,我们利用已有的单因子诱导成骨分化模型C2C12/Runx2Dox[11]解析Runx2 调控成骨分化与自噬的关联性。研究发现在诱导C2C12 细胞分化为成骨细胞过程中,Runx2 可抑制与自噬体形成密切相关基因微管相关蛋白1 轻链3b(microtubuleassociated protein 1 light chain 3 beta,LC3b)及Beclin-1 表达,并可抑制LC3-I 向LC3-II 的转换。抑制自噬可增强Runx2 诱导的成骨分化,而激活自噬则具有抑制作用。据此我们认为Runx2 通过阻断自噬过程以诱导C2C12 细胞向成骨分化。
材 料 和 方 法
1 细胞与试剂
1.1 细胞 C2C12/Runx2Dox细胞是利用Tet-On Advanced 基因表达系统在小鼠成肌细胞C2C12 中建立的由Dox 调节Runx2 表达的单因子诱导成骨分化模型,为本实验室自己构建。
1.2 试剂 Trizol reagent 与G418 购自Invitrogen;Tet-On System 专用胎牛血清与强力霉素(doxycycline,Dox)购自Clontech;潮霉素(hygromycin,Hyg)购自Merck;3-甲基腺嘌呤(3-methyladenine,3-MA)购自Santa Cruz;雷帕霉素(rapamycin,Rap)购自Sigma;LC3 抗体购自Novus;β-actin 抗体及相关II 抗购自Cell Signaling;ECL 化学发光显色试剂盒购自Pierce;BCIP/NBT 碱性磷酸酶显色试剂盒,WB/IP 细胞裂解液及BCA 蛋白定量试剂盒购自碧云天公司;RNA 逆转录及实时定量PCR 所用试剂均购自宝生物工程公司;柯达胶片购自广州威佳;其它所用试剂及引物均购自上海生工。
2 方法
2.1 细胞培养 用含有10% Tet-On System 专用胎牛血清的DMEM 培养基培养C2C12/Runx2Dox细胞,并加入500 mg/L Hyg 与800 mg/L G418,置于37℃、5% CO2培养箱中,隔日换液1 次,细胞经传代和收获,取对数生长期细胞进行实验。为分析Runx2 诱导C2C12 细胞向成骨分化与自噬的关系,在培养液中加入Dox (10 mg/L)分别培养0 d、1 d、3 d 及6 d 后收RNA 与蛋白样品进行相应分析。
2.2 总RNA 抽提 细胞培养好后用PBS 洗2 遍,并加入适量Trizol 试剂室温充分裂解10 min,后收集于1.5 mL Eppendorf 管中。每管样品加入1/5 倍体积的氯仿,剧烈振荡混匀30 s,室温静止10 min,4℃下12 000 r/min 离心15 min。取上清液至新的Eppendorf 管,加等体积异丙醇,-20 ℃静置15 min。4 ℃下12 000 r/min 离心15 min,弃上清,DEPC 水配制的75%乙醇0.5 mL 洗涤沉淀1 次,12 000 r/min 离心10 min。弃上清,空气干燥10 min,加50 μL DEPC 水溶解RNA 沉淀,置于-20 ℃冰箱保存备用。
2.3 逆转录PCR ( reverse transcription PCR) 取1 μg 总RNA 并加入DEPC 水到总体积为12 μL,65 ℃保温5 min 使RNA 变性。随后立即冰上冷却,以防RNA 复性。在该PCR 管中分别加入0.5 μL 随机引物,Oligo dT 引物,RNase inhibitor,逆转录酶MMLV,2 μL 10 μmol/L dNTP,4 μL 5 ×buffer,将上述20 μL 反应溶液30 ℃保温10 min,42 ℃保温60 min,72 ℃保温10 min,最终逆转为所需的cDNA。
2.4 实时定量PCR( real-time quantitative PCR) 采用SYBR Green PCR Master Mix 试剂,在基因公司的扩增仪上进行反应,PCR 反应体系为:cDNA 1 μL,基因上、下游10 μmol/L 引物各0.8 μL,SYBR Green PCR Master Mix 10 μL,加H2O 补至20 μL。同时按照相同方式准备检测内参表达水平的反应液。每个样品设3 个复孔。反应条件为:95 ℃10 s 预变性,95 ℃5 s,60 ℃30 s,72 ℃15 s,40 个循环。操作步骤按照说明书进行。反应结束后,使用系统软件分析PCR 过程各检测样本的Ct (threshold cycle)值。由熔解曲线判断PCR 反应的特异性,用基于2-ΔΔCt方法进行相对定量分析。检测分析时所用内参照是18S rRNA。所用PCR 引物都由上海生工合成,见表1。

表1 实时定量PCR 检测所用引物的序列Table 1. The sequences of the primers used for real-time qPCR detection
2.5 Western blotting 检测LC3-I 向LC3-II 的转换情况 按照碧云天WB/IP 细胞裂解液配送的蛋白提取说明书抽提总蛋白,并用BCA 蛋白定量试剂盒分析抽提蛋白浓度。采用15% 胶上样40 mg 总蛋白进行聚丙烯酰氨凝胶电泳,并在4 ℃条件下转至PVDF 膜,5%牛血清白蛋白室温封闭1 h,4 ℃Ⅰ抗孵育过夜,洗涤后Ⅱ抗室温孵育1 h。再次洗涤后使用ECL 化学发光显色试剂盒显影,胶片(柯达)曝光。
2.6 碱性磷酸酶( alkaline phosphatase,ALP) 染色
将培养好的细胞用PBS 洗3 次以去除培养基,而后用95%乙醇固定细胞10 min,晾干,依照碧云天的BCIP/NBT 碱性磷酸酶显色试剂盒所提供的相应操作步骤进行染色分析,并晾干拍照。
3 统计学处理
用SPSS 13.0 软件进行统计分析处理,数据以均数±标准差(mean ±SD)表示,使用单因素方差分析(One-way ANOVA),组间有显著差异者用LSD-t 检验进行两两比较,以P <0.05 为差异有统计学意义。
结 果
1 Runx2 诱导C2C12 细胞向成骨细胞分化时可下调LC3b 及Beclin-1 表达
用Dox (10 mg/L)处理C2C12/Runx2Dox细胞0 d、1 d、3 d 及6 d 后进行real-time qPCR 分析,首先检测了Runx2 及成骨分化标记基因ALP 及OC 的表达情况(图1A),结果发现三者的表达水平明显上调的,说明诱导分化模型的可靠性。在此基础上我们进一 步 分 析 了 LC3b、Beclin-1、SQSTM1/p62 和LAMP-2 的表达,结果发现Runx2 可明显下调LC3b(图1B)与Beclin-1(图1C)表达水平,特别是自噬体标记基因LC3b,但对SQSTM1/p62 与LAMP-2 无明显影响(未提供数据)。此结果说明,Runx2 诱导C2C12 细胞向成骨分化与自噬过程存在关联性。
2 Runx2 诱导C2C12 细胞向成骨细胞分化时可抑制LC3-I 向LC3-II 的转换
Western blotting 检测结果表明,随着诱导时间延长,Runx2 的表达持续增加,在诱导6 d 时达最高水平(图2A 与2B)。同时发现Runx2 表达对LC3-I 向LC3-II 转换具有明显抑制作用,且这种抑制作用具有明显的诱导时间依赖性(图2C)。在Dox 处理3 d后,抑制效果就很明显(图2C)。LC3-II 的灰度扫描结果也说明了这一点(图2D)。此结果说明,Runx2诱导C2C12 细胞向成骨分化时可抑制自噬体形成,阻滞自噬流。
3 抑制自噬可促进Runx2 诱导的成骨分化进程
用0、1、3、5、10 及20 mmol/L 的3-MA 预处理细胞1 h,随后加入Dox (10 mg/L)诱导14 d 后进行ALP 活性分析。结果表明,与Dox 处理样品相比,在使用低浓度3-MA 时(1、3 及5 mmol/L),ALP 活性随着处理浓度增加而增加;在使用高浓度时(10 与20 mmol/L),ALP 活性随着处理浓度增加而降低(图3A)。进一步分析发现,低浓度的3-MA 对细胞没有明显毒性,但高浓度会导致细胞大量死亡(图3B),这说明3-MA 高浓度所产生的ALP 活性降低现象是由于细胞数量减少导致的,揭示3-MA 增强ALP 活性的作用具有低浓度依赖性。此外,我们又用3-MA(5 mmol/L)分别处理细胞1 d、3 d 及6 d 后利用real-time qPCR 分析ALP 及OC 表达情况,结果发现3-MA 处理可明显促进二者表达(图3C 与3D)。此外,3-MA 处理对自噬相关基因的表达无明显影响(未提供数据)。以上研究结果说明,抑制自噬可增强Runx2 诱导C2C12 细胞分化为成骨细胞的能力。
4 激活自噬可抑制Runx2 诱导的成骨分化进程
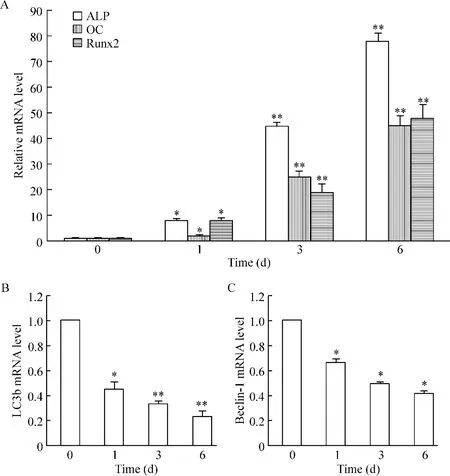
Figure 1. The expression levels of LC3b and Beclin-1 were down-regulated during Runx2-induced osteogenic differentiation of C2C12 cells. C2C12/Runx2Dox cells were treated with Dox (10 mg/L)for the times indicated.The mRNA levels of ALP (A),OC(A),Runx2(A),LC3b (B),and Beclin-1(C)were detected by real-time qPCR and normalized to 18S rRNA. Mean±SD. n=3. * P <0.05,**P <0.01 vs untreated sample (0 d).图1 Runx2 在诱导C2C12 细胞向成骨分化时下调LC3b 与Beclin-1 表达

Figure 2. The conversion of LC3-I into LC3-II was inhibited during Runx2-induced osteogenic differentiations of C2C12 cells. C2C12/Runx2Dox cells were treated with Dox (10 mg/L)for the times indicated. The protein levels of Flag-Runx2(A)and LC3(B)were detected by Western blotting. Mean±SD. n=3. * P <0.05,**P <0.01 vs untreated sample (0 d).图2 Runx2 诱导C2C12 细胞向成骨分化过程中抑制LC3-I 向LC3-II 的转换

Figure 3. The Runx2-induced osteogenic differentiation of C2C12 cells was promoted by 3-MA treatment. A:C2C12/Runx2Dox cells were pretreated with the indicated concentrations of 3-MA for 1 h. The cells were then treated with Dox (10 mg/L)in the presence of 3-MA for 14 d. The ALP activity was determined by ALP staining. B:Representative phase-contrast micrographs showing C2C12/Runx2Dox cells after 14 d of treatment with Dox or 3-MA (×100). C,D:C2C12/Runx2Dox cells were pretreated with 3-MA (5 mmol/L)for 1 h. The cells were then treated with Dox (10 mg/L)in the presence of 3-MA for the time indicated. The mRNA levels of ALP and OC were detected by real-time qPCR and normalized to 18S rRNA.Mean±SD.n=3. * P <0.05,**P <0.01 vs Dox-treated sample at each time point.图3 3-MA 处理可促进Runx2 诱导的C2C12 细胞向成骨分化进程
分别用0、0.05、0.1、1、5 和10 μmol/L 的Rap 预处理细胞1 h,随后用Dox(10 mg/L)处理14 d 后进行ALP 活性分析。结果发现,与Dox 处理样品相比,Rap 处理具有抑制ALP 活性的作用,且这种抑制作用具有浓度依赖性,在10 μmol/L 时Rap 具有显著的抑制效果(图4A),且对细胞无明显毒性。此外,我们用Rap (10 μmol/L)分别处理细胞1 d、3 d 及6 d 后利用real-time qPCR 分析ALP 及OC 表达情况,结果发现Rap 处理可明显抑制二者表达(图4B 与4C)。此外我们也证实Rap 处理对自噬相关基因的表达无明显调节作用(未提供数据)。以上研究结果说明,激活自噬可减弱Runx2 诱导C2C12 细胞分化为成骨细胞的能力。
讨 论
在本研究中,我们利用单因子诱导分化模型C2C12/Runx2Dox分析Runx2 诱导成骨分化与自噬的关系。通过分析自噬体形成标志LC3-I/LC3-II 比值,揭示了Runx2 诱导成骨分化与自噬之间存在负相关关系。通过联合使用自噬抑制剂3-MA 及自噬激活剂Rap,进一步确认了二者之间的负相关关系。由此我们认为Runx2 通过抑制自噬体形成,阻滞自噬流,进而诱导C2C12 细胞分化为成骨细胞。

Figure 4. The Runx2-induced osteogenic differentiations of C2C12 cells was inhibited by Rap treatment. A:C2C12/Runx2Dox cells were pretreated with the indicated concentrations of Rap for 1 h. The cells were then treated with Dox (10 mg/L)in the presence of Rap for 14 d. The ALP activity was determined by ALP staining. B,C:C2C12/Runx2Dox cells were pretreated with Rap (10 μmol/L)for 1 h. The cells were then treated with Dox (10 mg/L)in the presence of Rap for the time indicated. The mRNA levels of ALP and OC were detected by real-time qPCR and normalized to 18S rRNA. Mean ±SD.n =3.* P <0.05,**P <0.01 vs Dox-treated sample at each time point.图4 Rap 处理可抑制Runx2 诱导的C2C12 细胞向成骨分化进程
一般来说,自噬可分为5 步,即诱导自噬,货物分子的识别与选择,自噬体的形成,自噬体与溶酶体的融合,货物分子的降解。在诱导C2C12细胞向成骨分化时,Runx2 可能会对自噬的某些步骤进行调节。在分析Runx2 诱导分化与自噬相关性时,我们首先在基因水平解析了Runx2 与自噬相关基因LC3b与Beclin-1 之间的表达负相关关系(图1B 与1C)。为进一步明晰Runx2 与自噬的关系,我们又在蛋白水平分析了LC3-I 向LC3-II 的转换情况,并证实Runx2 可显著抑制LC3-II 的形成(图2C)。由于LC3-II 是参与自噬体膜形成的重要组分[12],其生成被抑制就会导致自噬体不能正常形成,自噬流被阻滞,可见Runx2 具有阻滞自噬流的作用。由于LC3-II 可以与自噬货物受体分子p62 结合,在自噬体与溶酶体融合后被降解掉,因此除通过分析LC3-II 水平分析自噬流外,检测p62 在蛋白水平的表达情况也是评估自噬流的一种方法[13],这也提示我们p62表达水平发生变化可能是在蛋白水平,而不是基因水平。LAMP-2 是溶酶体的一种驻留蛋白,位于溶酶体膜上,负责调节自噬体与溶酶体的融合,缺失可导致融合受阻[14]。本研究发现在基因水平,Runx2 对LAMP-2 表达无明显影响,这说明Runx2 对自噬的阻滞应该不是通过影响后期融合过程实现的。依据上述分析,我们初步推断Runx2 对自噬的影响可能是在自噬体形成阶段。
自噬体这种具有生物膜的囊泡结构的形成是被自噬相关蛋白(autophagy-related proteins)调节的[15],这也是自噬过程中最复杂的一个步骤。自噬体形成的双层膜是新生膜,其形成的基础是吞噬泡(phagophore)膜。Phagophore 膜有众多来源,可来自线粒体,高尔基体或是内质网[16],新生膜就是在这些来源膜的基础上延展而来。延展过程首先依赖于PtdIns3K(class III phosphatidylinositol 3-kinase)复合体的形成,该复合体的激酶活性可被3-MA 靶向抑制,因此当我们用3-MA(5 mmol/L)处理细胞后发现ALP 活性明显增加(图3A),这说明自噬体形成被抑制,自噬过程被阻滞后,Runx2 促C2C12 细胞向成骨分化能力增强了。此外,该复合体中有一个重要组分是Atg6/Beclin-1 在分化过程中,Runx2 可抑制该因子表达(图1C),这说明Runx2 阻滞自噬过程的一种方式是通过下调Beclin-1 表达以抑制PtdIns3K 激酶复合体的形成。新生膜在延展时,需要征募磷脂酰乙醇胺修饰的LC3 (LC3-II)至phagophore 膜上[12],这个过程对新生膜的形成是必须的。目前在分析胞内自噬体数量及自噬流强度时,都采用评估LC3-I/LC3-II 比 值 的 方法[17]。LC3-II 水 平 越 高,LC3-I/LC3-II 比值就越低,说明自噬体越多,胞内自噬流越强。在本研究中,我们发现Runx2 除抑制LC3b 转录外(图1B),还对LC3-I 向LC3-II 的转换过程进行负调控(图2C),最终阻滞新生膜的延展与自噬体的形成。综上可见,Runx2 一方面通过下调Beclin-1 表达的方式阻滞PtdIns3K 激酶复合体形成,导致起始phagophore 膜的组装受到影响,另一方面通过下调LC3-II 的水平,影响phagophore 膜的延展及新生膜的形成,最终通过抑制自噬体形成的方式阻滞自噬流,从而促进C2C12 细胞分化为成骨细胞。
自噬相关基因在转录水平上被调节是属于自噬的转录调节机制范畴,此外一些信号途径对自噬过程也有重要调节作用[15]。我们熟知的与自噬密切相关的就是雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)途径。细胞在处于胁迫条件下,如营养缺乏、缺氧、或是被病原体感染,会使该途径失活,从而诱发自噬过程以抵御环境胁迫,维持生存需求。Rap 是该途径的特异性抑制剂。在本研究中,为提供自噬具有抑制Runx2 诱导C2C12 细胞向成骨分化的正向证据,我们用Rap(10 μmol/L)处理后发现ALP 活性显著降低(图4A),这说明mTOR 途径与Runx2 诱导成骨分化的负相关关系。因此在后续研究中有必要分析在Runx2 诱导成骨分化过程中mTOR 途径的状态。
Runx2 是成骨分化、骨形成与骨骼发育的关键调节因子。Runx2 功能异常会引发一些遗传性疾病,如锁骨颅骨发育不全(cleidocranial dysplasia,CDD)综合征。依据我们的研究成果可初步推断,这些相关疾病的发生发展可能与自噬过程异常有一定的关联性。因此,该研究成果可能会为这些临床疾病的治疗提供一个全新的思路。
[1] Ducy P,Zhang R,Geoffroy V,et al. Osf2/Cbfa1:a transcriptional activator of osteoblast differentiation[J]. Cell,1997,89(5):747-754.
[2] Otto F,Thornell AP,Crompton T,et al. Cbfa1,a candidate gene for cleidocranial dysplasia syndrome,is essential for osteoblast differentiation and bone development[J].Cell,1997,89(5):765-771.
[3] Liu W,Toyosawa S,Furuichi T,et al. Overexpression of Cbfa1 in osteoblasts inhibits osteoblast maturation and causes osteopenia with multiple fractures[J]. J Cell Biol,2001,155(1):157-166.
[4] Wong E,Cuervo AM. Integration of clearance mechanisms:the proteasome and autophagy[J]. Cold Spring Harb Perspect Biol,2010,2(12):a006734.
[5] Wong AS,Cheung ZH,Ip NY. Molecular machinery of macroautophagy and its deregulation in diseases[J]. Biochim Biophys Acta,2011,1812(11):1490-1497.
[6] 陈 艾,董 煜,毛 萌. 小自噬的研究进展[J]. 中国病理生理杂志,2012,28(5):955-960.
[7] Kirkin V,Lamark T,Sou YS,et al. A role for NBR1 in autophagosomal degradation of ubiquitinated substrates[J]. Mol Cell,2009,33(4):505-516.
[8] Lee JY,Koga H,Kawaguchi Y,et al. HDAC6 controls autophagosome maturation essential for ubiquitin-selective quality-control autophagy[J]. EMBO J,2010,29(5):969-980.
[9] Mizushima N,Levine B,Cuervo AM,et al. Autophagy fights disease through cellular self-digestion[J]. Nature,2008,451(7182):1069-1075.
[10]Hocking LJ,Whitehouse C,Helfrich MH. Autophagy:a new player in skeletal maintenance[J]. J Bone Miner Res,2012,27(7):1439-1447.
[11]Yu SH,Geng QQ,Sun FY,et al. Osteogenic differentiation of C2C12 myogenic progenitor cells requires the Fosrelated antigen Fra-1:a novel target of Runx2[J]. Biochem Biophys Res Commun,2013,430(1):173-178.
[12]Suzuki K,Kirisako T,Kamada Y,et al. The pre-autophagosomal structure organized by concerted functions of APG genes is essential for autophagosome formation[J]. EMBO J,2001,20(21):5971-5981.
[13] Bjørkøy G,Lamark T,Brech A,et al. p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death[J]. J Cell Biol,2005,171(4):603-614.
[14]Tanaka Y,Guhde G,Suter A,et al. Accumulation of autophagic vacuoles and cardiomyopathy in LAMP-2-deficient mice[J]. Nature,2000,406(6798):902-906.
[15]He C,Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy[J]. Annu Rev Genet,2009,43:67-93.
[16]Juhasz G,Neufeld TP. Autophagy:a forty-year search for a missing membrane source[J]. PLoS Biol,2006,4(2):e36.
[17]Mizushima N,Yoshimori T. How to interpret LC3 immunoblotting[J]. Autophagy,2007,3(6):542-545.

