基于HPLC-MS/MS Q-TOF 分析糖尿病肾病维持性血透患者含糖透析的代谢特征*
徐 丹, 孟 宇, 胡 波, 冯艳艳, 尹良红
(暨南大学附属第一医院肾内科,广东 广州510630)
我国糖尿病肾病(diabetic nephropathy,DN)发展至终末期肾功能衰竭的人数逐渐增加[1],DN 维持性血透(maintenance hemodialysis,MHD)患者约为总血透人数的36.39%[2]。使用无糖透析液血液透析过程中,DN 患者低血压、低血糖等并发症发生率较高,影响透析质量,目前研究发现使用含糖透析液明显减少这些并发症的发生[3-4],然而含糖透析对患者机体代谢的影响尚未明确。代谢组学是研究生物体系受外部刺激而产生的所有代谢产物的变化及其动态变化的规律[5],可用于探索含糖透析的代谢特征。本研究采用高效液相色谱-四极杆飞行时间串联质谱仪(high-performance liquid chromatography/quadrupole time-of-flight mass spectrometry,HPLC-MS/MS QTOF),其具有分析速度快、灵敏度及分辨率高、质量范围宽的特点,有助于在分析血清样本全体代谢物,初步研究单次含糖透析的代谢特征。
材 料 和 方 法
1 研究对象
根据纳入及排除标准选择在我院门诊MHD 患者10 例,原发病均为2 型糖尿病、糖尿病肾病,采用自身对照研究,形成无糖透析组(glucose-added dialysate group,G-组)和含糖透析组(glucose-free dialysate group,G+组),另在我院体检中心随机选取10例健康人形成健康对照组(healthy control group,H组)。MHD 患者血液透析前不使用胰岛素。
1.1 纳入标准 (1)符合ESRD 的诊断标准,内生肌酐清除率≤10 mL/min;(2)年龄>18 岁,规律透析3 个月以上,每周3 次,每次4 h;(3)2 周内没有使用除胰岛素以外的影响血糖的药物及任何调脂药物,取血前2 d 空腹血糖及餐后2 h 血糖分别控制在7.77 mmol/L 与11.10 mmol/L 以内。实验前均使用无糖透析液血透。
1.2 排除标准 (1)研究进行时的现症感染患者;(2)1 个月内有严重心力衰竭、心肌梗死等心血管合并症,及严重贫血、心力衰竭、出血倾向,急性脑血管意外、肝功异常、肝硬化等疾病患者;(3)血透中发生低血糖或低血压患者退出本研究,低血糖的诊断标准:血糖<3.9 mmol/L(据2010 中国糖尿病指南);低血压的诊断标准:收缩压<90 mmHg(1 mmHg =0.133 kPa);(4)不愿签署知情同意书患者。
2 血液透析方法
采用德国费森尤斯4008S 透析机,聚风膜中空纤维透析器,膜面积为1.6 m2,超滤系数6.4 mL·h-1·mmHg-1。G-组采用广州康盛生物科技有限公司提供无糖碳酸氢盐透析液,其成分为:钠离子135.0 mmol/L,钾离子2. 0 mmol/L,钙离子1. 25 mmol/L,镁离子1.0 mmol/L,氯离子108.6 mmol/L,醋酸盐6.0 mmol/L,碳酸氢盐30.0 mmol/L,含糖透析液由相同厂家提供,葡萄糖浓度为5.5 mmol/L,余成分同无糖透析液。透析时间4 h,血流速200 ~230 mL/min,透析液流速500 mL/min、温度37 ℃,超滤量<干体重×5%,全身肝素化抗凝,首剂20 mg,6 mg/h 持续泵入,透析结束前30 min 停止泵入。
3 样本采集及制备
受试者样本均在空腹8 h 以上并于晨间7:30 食用统一标准餐后30 min 采集,MHD 受试者无菌采集血液透析前、后周围静脉血5 mL,健康对照组与MHD 患者采血间隔一致,作为血液透析前、后健康对照,采血间期均不进食。静脉血注入促凝采血管内,常温下静置15 min 后3 000 r/min 离心5 min,取上清液置于EP 管中储存于-80 ℃的冰箱内待测。检测时,样本于室温下解冻,取100 μL 样本加入无水甲醇300 μL 置于1.5 mL EP 管漩涡混匀,13 200 r/min 离心5 min,取上清液作为检测血清样本。
4 仪器与条件
4.1 色谱条件 美国Agilent 1200 系列高效液相色谱仪(Agilent 1200 HPLC):ZORBAX SB-C18 柱(150 mm ×2.1 mm,内径1.8 μm),柱温25 ℃;进样量20 μL,流速0.25 mL/min。流动相:A 为甲醇(色谱醇,J & K Chemica),B 为纯净水;梯度洗脱:1 ~5 min,A∶B 为50∶50;6 ~35 min,A∶B 为95∶5。
4.2 质谱条件 Bruker 公司microTOF-QⅡ质谱仪,电喷雾离子源(ESI),正离子电离模式,TOF 离子飞行方式采用V 模式,帽电压-500 V,毛细管电压3 500 V,雾化器压力0.6 bar,干燥气流速6.0 L/min,干燥气温度180 ℃,全程扫描质谱分析时碰撞电压7 eV,离子化电压5 eV,采集速度为0.1s,校正溶液进样速度100 μs/min,校正频率为5 s,四极杆扫描范围质荷比(mass charge ratio,M/Z)50 ~1 000;二级质谱分析时碰撞电压10 ~40 eV 不等。
5 数据处理及统计学处理
采用Markerlynx 软件对原始数据进行峰检测和匹配,利用SIMCA-P 12.0 软件将全部样本的质谱数据导出,以M/Z、保留时间(retention time,RT)和峰强度(intensity)为数据,使用SIMCA-P 12.0 自带程序进行正交信号校正(orthogonal signal correction,OSC),其中的组别变量为Y 变量,并用主成分分析(principal component analysis,PCA)和OSC-偏最小二乘判别分析(partial least square discriminate analysis,PLS-DA)来分析数据。数据以均数±标准差(mean±SD)表示,统计学处理采用SPSS 13.0 软件完成,采用独立或配对样本t 检验,以P <0.05 为差异有统计学意义。本实验使用METLIN Database 查询相关可能候选物信息(http://metlin. scripps. edu/metaba_search_alt2.php)。
结 果
1 研究对象一般情况
血液透析后患者血糖G-组和G+组有显著差异,G+组高于G-组,超滤量、空腹、血液透析前血糖等指标无显著差异。H 组与MHD 组在年龄、性别等方面无显著差异,而血红蛋白和血糖有显著差异,见表1。
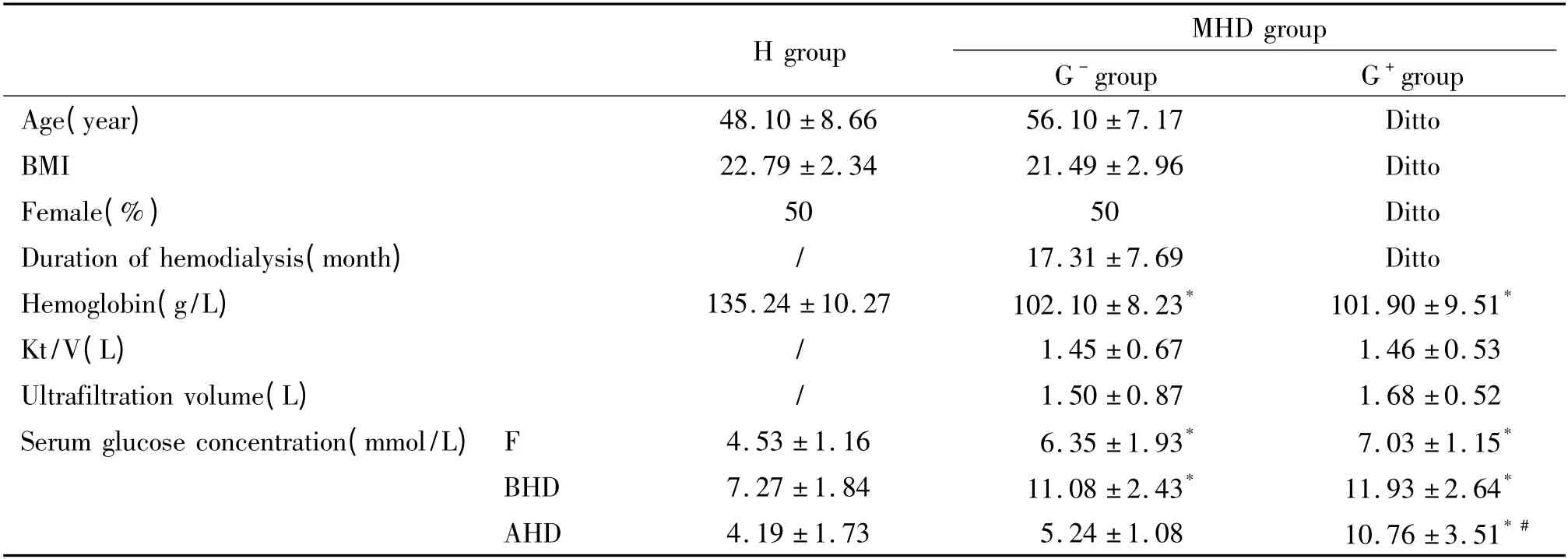
表1 研究对象一般情况Table 1. General characteristics of the subjects (mean±SD.n=10)
2 代谢组学结果与分析
2.1 G-组、G+组和H 组的TIC 图 血清样品经LC-MS/MS Q-TOF 分析,代表性单个总离子流图(total ion chromatograms,TIC)显示血液透析前G-组和G+组血清样本色谱峰总离子流在28 ~35 min 段有差异,说明血液透析前G-组和G+组部分代谢物可能存在差异;血液透析后G-组与G+组、H 组与血液透析前、后MHD 组血清样本色谱峰总离子流在同一保留时间色谱峰大小、高低表达有差异,说明血液透析后G-组和G+组代谢物存在差异,H 组与血液透析前、后MHD 组代谢物均存在差异,见图1。
2.2 G-组、G+组和H 组的PCA 分析 用SIMCA-P 12.0 软件对数据进行Pareto 缩放,将信号强度相对总强度进行归一化处理后进行PCA。各样品在第一主成分与第二主成分构成的平面上的投影得分图即PCA 得分图能够直观反映样品间的相似或差异性[4]。由图2、3 可见,PCA 模型可将血液透析前、血液透析后MHD 组与H 组样本完全区分,即MHD 患者与研究中健康人代谢状态不同。图2 中,G+组与G-组血清样本血液透析前分布较一致,即2 组透析前代谢状态无明显差异,具有可比性;图3 中,模型虽然不能有效区分血液透析后G+组与G-组,但G-组血液透析后组内代谢状态差异大。
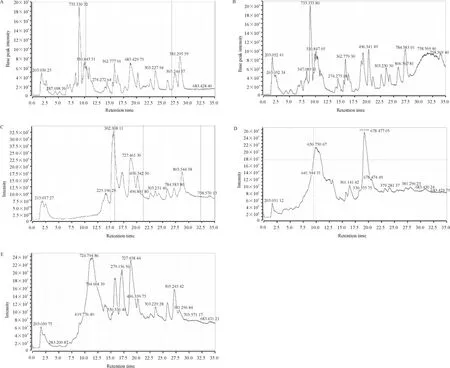
Figure 1. TIC of the 3 groups.A:G - group before hemodialysis;B:G + group before hemodialysis;C:H group one hour after meals;D:G - group after hemodialysis;E:G + group after hemodialysis.图1 3 组的TIC 图
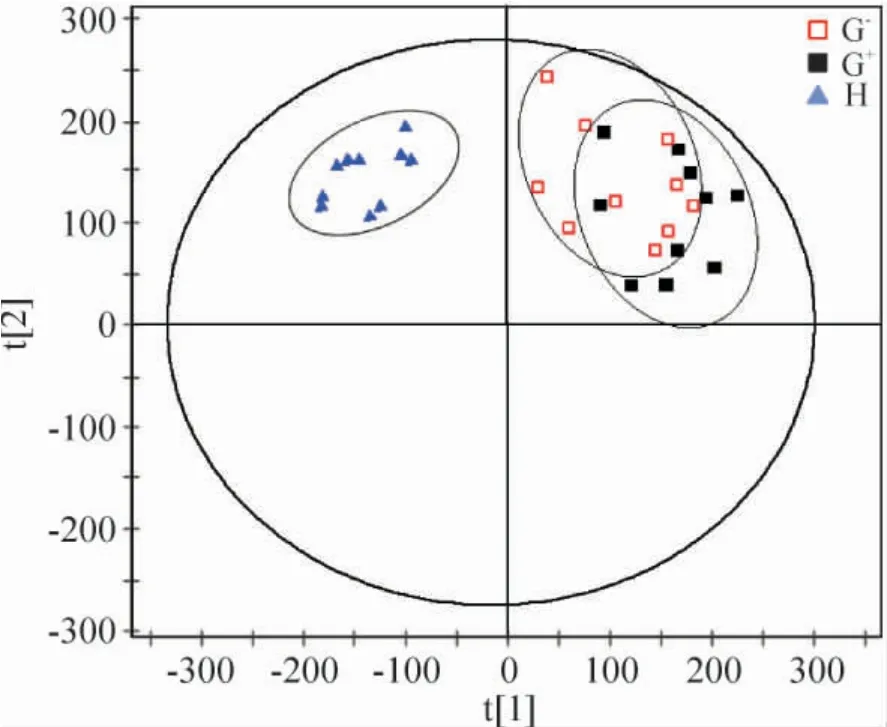
Figure 2. PCA score plot of the 3 groups before the hemodialysis.图2 血液透析前3 组样本的PCA 得分图
Figure 3. PCA score plot of the 3 groups after the hemodialysis.图3 血液透析后3 组样本的PCA 得分图
3 血液透析后G-组和G+组的OSC-PLS-DA 分析
PCA 模型示H 组与MHD 组患者代谢状态差异明显,且不能排除透析因素影响,本研究进一步对比分析未纳入H 组患者血清样本。为了减少除透析液因素外,血透患者的个体差异对分析结果的正确性影响,采用OSC 对数据滤噪,保留有效的数据信息,提高模型的效力和说明能力。OSC 后建立OSC-PLSDA 模型,R2X =0.395,R2Y =0.947,Q2 =0.918。图4、5 分别为透析后G-组和G+组的OSC-PLS-DA得分图(图4)和载荷图(图5)。与图3 相比,图4 中血液透析后G-组、G+组血清样本完全区分开,可见其代谢物状态存在差异,亦表明OSC-PLS-DA 比PCA 具有更好的分类能力。图5 表示样本中检测到的代谢物的分布,距离原点越远,对分离贡献越大,可能是差异代谢物。
4 血液透析后G-组和G+组差异代谢物鉴定
本研究质谱数据主要经过去噪音、质谱峰提取、反卷积处理、峰排列、对齐、合并、缝隙填补处理、数据导出等过程处理海量实验数据,以避免潜在标志物筛选受到干扰。VIP 值可以量化OSC-PLS-DA 载荷图上每个变量对分类的贡献。VIP 值越大变量在不同类间的区别最显著。对VIP >3 的变量进行配对样本t 检验,将t 检验中P <0.05 的变量作为主要差异性代谢物,再根据M/Z 在参考文献及METLIN代谢物数据库中查询,并与二级质谱数据进行比对从而确定差异代谢物分子式及名称(详见表2)。具体过程如下:以RT 28.25 min、M/Z 为377.0305 的目标代谢物为例,据分析物电喷雾正离子模式加H的机理,目标代谢物[M+H]+代谢物离子的M/Z 为377.0305,据RT 为28.25 min 的质谱图(图6A),离子代谢物[2M +H]+(M/Z 655.6008)、[M +Na]+(M/Z 394.0316)和[M-2H]-(M/Z 331.2276)可能来源于同一目标代谢物。以代谢物离子[M +H]+(M/Z 377.0305)为母离子,进行二级质谱扫描,同时优化碰撞能量,选择丰度较高的2 种碎片离子作为定性与定量特征离子,最大程度提高检测的灵敏度。其二级质谱分析得到[M-2H]-(M/Z 331.2276)及[MH]-(M/Z 44.9882)丰度最高(图6B),在METLIN Database 搜索与[M+H]+(M/Z 377.0305)相匹配的代谢物,并与其二级质谱进行分析对比,推断出此代谢物为石胆酸,分子量为376.2977,分子式见图6C。以此类推,得出其余4 种物质的分子量和分子式。
讨 论
本实验利用HPLC-MS/MS Q-TOF 分析单次使用含糖透析液与无糖透析液DN 维持性血液透析后患者血清代谢物差异,最终得到G+组氢化可的松、石胆酸和天冬氨酸较G-组含量低,而N-甲基烟酰胺和二羟基前列腺素F 较G-组含量高。
氢化可的松作为内源性糖皮质激素的一种,通过促进肝脏糖异生、脂肪细胞及肌肉组织对葡萄糖摄取和利用,升高血糖。同时还增强生长激素、胰高糖素等其它升糖激素的作用。4 h 无糖透析,患者丢失20 ~40 g 葡萄糖,造成人为饥饿状态,血糖降低,为维持血糖稳定,糖皮质激素升高,G-组氢化可的松水平较高也与机体这一生理过程相符。石胆酸通过激活糖原磷酸化酶(glycogen phosphorylase,GP)和分解糖原[6],也有维持血糖稳定的作用。G+组氢化可的松、石胆酸水平较低,提示使用含糖透析液较使用无糖透析液患者体内血糖稳定,糖异生及糖原分解水平可能低于无糖透析。结合透后PCA 得分图,含糖透析组DN 患者代谢状态组内差异小,代谢水平稳定。
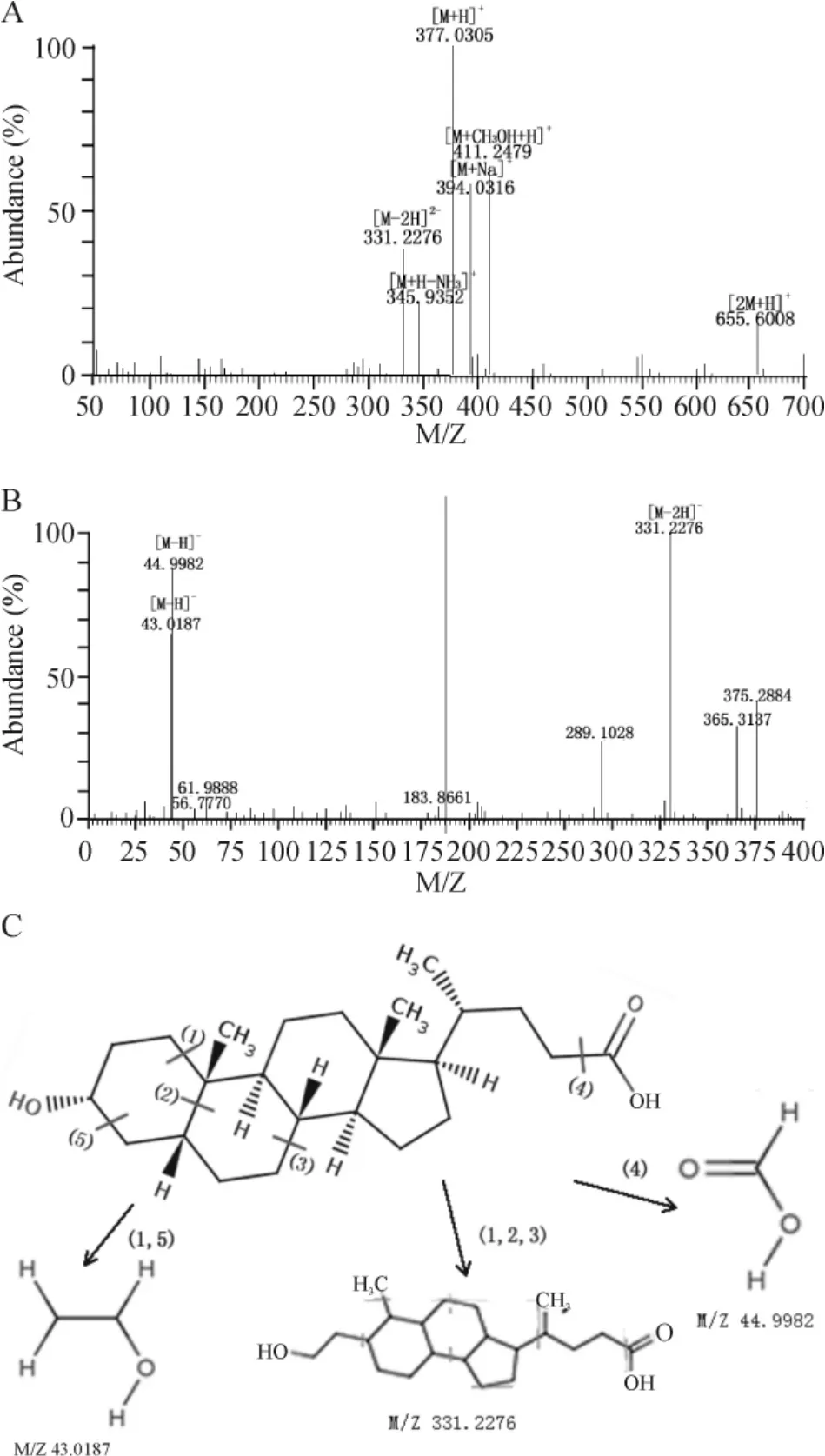
Figure 6. The identification procedure of differential metabolites at retention time (RT)28.25 min.A:the mass spectrum at RT 28.25 min;B:the MS/MS spectrum of ion of M/Z 377.3050 at 28.25 min in plasma sample;C:the formula and possible fragment mechanism of lithocholic acid.图6 保留时间28.25 min 处差异代谢物的鉴定
天冬氨酸作为能量物质可以通过糖异生转化为葡萄糖,亦是一种兴奋性神经递质[7]。有实验显示血浆氨基酸水平有可能间接反映颅内氨基酸水平[8-9]。大脑不能合成葡萄糖,且糖原储量极少,血糖降低,神经细胞供能不足,致神经元和神经胶质细胞去极化,天冬氨酸释放增加,再摄取减少,使N-甲基-天冬氨酸受体过度兴奋,引起离子通道病理性开放、钙离子大量内流,细胞内钙超载,严重时造成细胞中毒死亡[10]。G+组血清天冬氨酸含量较G-组低,可能与使用含糖透析液较使用无糖透析液患者体内血糖稳定、糖异生降低、蛋白分解少有关,也提示使用含糖透析液患者颅内兴奋性神经递质水平可能较低,对患者脑细胞可能有潜在保护作用。
体外红细胞孵育实验发现N-甲基烟酰胺呈剂量依赖性促进红细胞过氧化氢生成,降低红细胞NAD/NADH 比值,提示N-甲基烟酰胺与氧化应激有关[11]。G+组N-甲基烟酰胺升高,提示使用含糖透析液可能不利于降低DN 维持性血透患者体内氧化应激状态;二羟基前列腺素F 在人体内的生物学功能尚不明确。8-异前列腺素F2α是前列腺素F2α的异构体,可作为衡量机体氧化应激状态的重要指标[12],G+组二羟基前列腺素F 升高是否进一步提示含糖透析加重DN 维持性血透患者体内氧化应激状态,有待进一步研究。
本研究利用代谢组学的研究方法,初步分析单次使用含5.5 mmol/L 葡萄糖透析液与无糖透析液血液透析4 h 后DN 维持性血透患者的代谢特征。使用含糖透析液较无糖透析液患者体内血糖及代谢水平稳定,减少糖异生水平,可能对于改善患者营养状态具有优势,同时可能对透析患者脑细胞有潜在保护作用,但目前实验结果来看可能有加重患者氧化应激状态的风险。本研究结果亦显示,将代谢组学及其技术运用于对含糖透析血清全体代谢物的水平上综合评价是可行的,使用含糖透析液对DN 维持性血透患者代谢的影响及意义还有待深入研究。
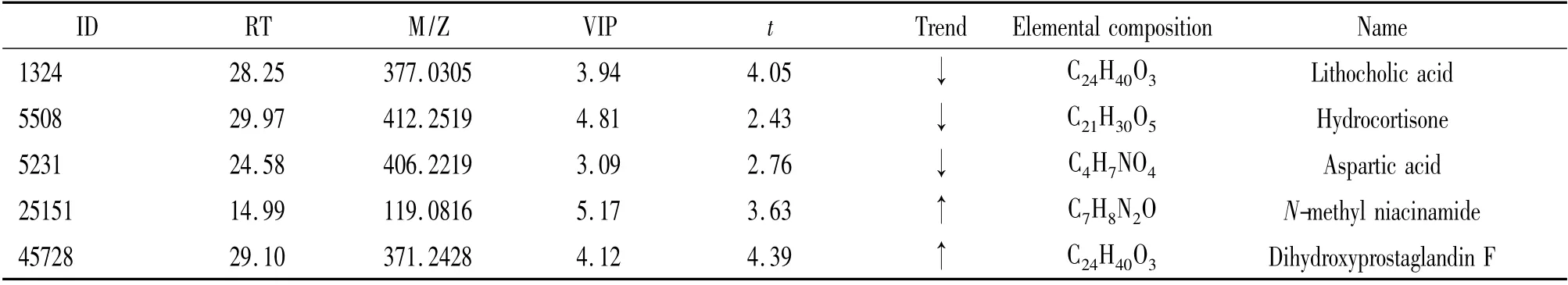
表2 含糖透析组与无糖透析组有显著差异的代谢物Table 2. The differential metabolites between G + group and G - group (n=10)
[1] 陈小明,黄丹丹,李自成.新西兰兔糖尿病肾病模型的建立方法[J]. 中国病理生理杂志,2012,28(4):765-768.
[2] 季大玺. 终末期糖尿病肾病治疗现状[J]. 中国中西医结合肾病杂志,2004,5(11):621-623.
[3] Burmeister JE,Scapini A,da Rosa Miltersteiner D,et al.Glucose added dialysis fluid prevents asymptomatic hypoglycaemia in regular haemodialysis[J]. Nephrol Dial Transplant,2007,22(4):1184-1189.
[4] Simic-Ogrizovic S,Backus G,Mayer A,et al. The influence of different glucose concentrations in haemodialysis solutions on metabolis and blood pressure stability in diabetic patients[J]. Int J Artif Organs,2001,24(12):863-869.
[5] 张 栩,杨 楠,李丽娟,等.基于液质联用系统的小鼠心血管疾病模型花生四烯酸代谢组学研究方法[J].中国病理生理杂志,2012,28(11):2095.
[6] Fu D,Wakabayashi Y,Lippincott-Schwartz J,et al.Bile acid stimulates hepatocyte polarization through a cAMPEpac-MEK-L-KB1-AMPK pathway[J]. Proc Natl Acad Sci U S A,2011,108(4):1403-1408.
[7] 宋海岩,邓晓慧,苗莹莹. Humanin 通过抑制一氧化氮发挥神经保护作用[J]. 中国病理生理杂志,2012,28(4):742-745.
[8] D'Souza DC,Gil R,Cassello K,et al. IV glycine and oral D-cycloserine effects on plasma and CSF amino acids in healthy humans[J]. Biol Psychiatry,2000,47(5):450-462.
[9] Hagenfeldt L,Bjerkenstedt L,Edman G,et al.Amino acids in plasma and CSF and monoamine metabolites in CSF:interrelationship in healthy subjects[J].J Neurochem,1984,42(3):833-837.
[10] Sobczyk A,Svoboda K. Activity-dependent plasticity of the NMDA-receptor fractional Ca2+current[J]. Neuron,2007,53(1):17-24.
[11]李 达.N1-甲基烟酰胺与胰岛素抵抗关系的初步研究[D]. 大连大学,2010.
[12]Morrow JD. Quantification of isoprostanes as indices of oxidant stress and the risk of atherosclerosis in humans[J].Arterioscler Thromb Vasc Biol,2005,25(2):279-286.

