软骨来源成体干细胞的分离及其鉴定
左 伟,吴志宏,苏新林,吴 南,邱贵兴
(中国医学科学院北京协和医学院北京协和医院骨科,北京100730)
由于关节软骨缺乏血管和神经支配,仅含有单一的软骨细胞,导致关节软骨损伤后自身修复能力很差。关节软骨损伤最终会导致软骨的剥脱,关节面不完整,给患者造成关节肿胀、疼痛及活动障碍等极大痛苦。目前,软骨损伤的修复已成为骨科医生的一项挑战,组织工程学的提出为软骨缺损的修复重建提供了新的治疗途径,但如何获得适合的种子细胞是软骨组织工程的关键。除了骨髓间充质干细胞,近年来已有学者从人的脂肪、皮肤、滑膜甚至椎间盘组织中分离出成体干细胞[1-4],但关于软骨来源成体干细胞的研究还比较少,本研究旨在观察关节软骨中是否存在有软骨干细胞,并对软骨干细胞进行分离、培养和鉴定,以期为将来的组织工程学提供依据。
1 材料与方法
1.1 主要试剂
DMEM培养基和胎牛血清(Hycolon公司);成脂肪、成骨、成软骨诱导培养基(R&D公司);纤连蛋白,油红O,茜素红和甲苯胺蓝(Sigma公司);CD45,CD90,CD73等流式检测抗体(BD公司);碱性磷酸酶检测试剂盒(碧云天公司);Ⅱ型胶原和蛋白多糖(Aggrecan)抗体(Abcam公司)。
1.2 实验方法
1.2.1 软骨干细胞的分离与培养:选择2011年10月至2012年4月在北京协和医院行膝关节表面置换手术的晚期骨关节炎患者6例,其中男性2例,女性4例,年龄63.2±3.5岁。经患者同意、医院伦理委员会许可,收集手术后废弃的软骨组织,用剪刀将软骨剪碎至1 mm×1 mm×1 mm大小,加入0.2%Ⅱ型胶原蛋白酶,37℃水浴摇床消化8 h后,70μm滤网过滤得到单个软骨细胞。将软骨细胞以4×103个/mL的密度接种至预先用10μg/mL纤连蛋白处理过的平皿中,20 mins后给予换液以去除未贴壁的细胞,然后加入含10%胎牛血清的DMEM培养基继续培养。两周后,用克隆环挑取平皿中所形成细胞数大于32的单个集落,放入培养瓶中培养,具体方法可参考文献[5]。
1.2.2 流式细胞仪检测:取生长状态良好的第3代软骨干细胞,胰蛋白酶消化后细胞计数板计数,每检测样本细胞量大约为2×105个。重悬细胞后加入适当浓度的流式检测抗体,4℃避光孵育30 mins。PBS洗涤2次后,用300μL PBS重悬,上流式细胞仪检测软骨干细胞表面CD分子表达情况,同时用PBS作为一抗设置阴性对照。
1.2.3 软骨干细胞的成脂诱导及鉴定:选择第3代软骨干细胞,经胰蛋白酶消化后以5×104个细胞数接种于12孔板中,常规培养细胞贴壁至90%汇合后改为成脂诱导培养基培养,每72 h给予换液,同时设置普通培养基培养为阴性对照。诱导3周4%多聚甲醛固定后行油红O染色。
1.2.4 软骨干细胞的成骨诱导及鉴定:选择第3代软骨干细胞,经胰蛋白酶消化后以5×104个细胞数接种于12孔板中,常规培养细胞贴壁汇合至80%后改为成骨诱导培养基培养,每隔72 h给予换液,同时设置普通培养基培养为阴性对照。诱导3周4%多聚甲醛固定后行茜素红染色及碱性磷酸酶活性测定。
1.2.5 软骨干细胞的成软骨诱导及鉴定:选取第3代软骨干细胞,胰蛋白酶消化后将1×106个细胞吸入到15 mL离心管中,经离心后形成细胞微团,给予成软骨诱导培养基进行诱导分化,每72 h换液1次,同时设置普通培养基培养为阴性对照。诱导4周后,4%多聚甲醛固定,常规组织包埋、切片,行甲苯胺蓝染色,并行诱导后组织的Ⅱ型胶原及Aggrecan免疫组化检测。
1.3 统计学分析
采用SPSS13.0统计软件进行数据处理,计量资料以均数±标准差)表示。
2 结果
2.1 软骨干细胞的分离与培养
软骨组织消化后的单个细胞接种到纤连蛋白处理过的平皿20 mins后,部分细胞即开始贴壁。在后期的培养中,细胞呈集落样生长,至2周时,已有较大集落的形成,部分集落与集落间相互汇合,细胞呈短梭形。经克隆环挑取细胞集落继续培养后,细胞生长迅速,3~4 d即可传1代。传至第3代时,细胞形态均一,呈长梭形或多角形(图1)。
2.2 流式细胞仪检测软骨干细胞表面标志物
大部分软骨干细胞表面表达 CD44、CD29、CD73、CD90和 CD166,但几乎不表达 CD45、CD34和 CD133(图2)。

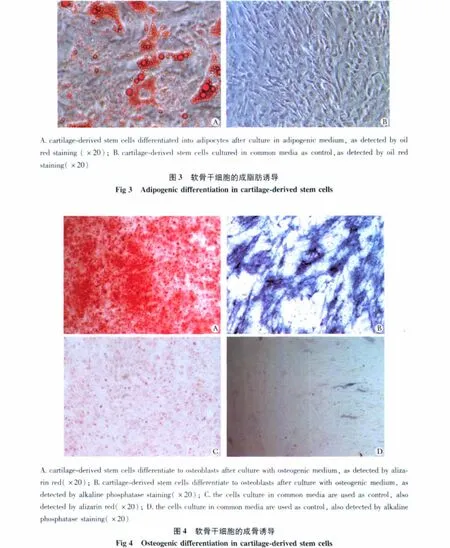
2.3 成脂肪诱导及其鉴定
在成脂诱导过程中,可以发现诱导后的细胞变大,胞核周围出现空泡样小脂滴颗粒,约2周后脂滴增大并相互融合。行油红O染色,可见细胞内有大量红色脂滴,而普通培养基培养组则无明显脂滴形成(图3)。
2.4 成骨诱导及其鉴定
软骨干细胞经成骨诱导后,可以发现细胞变成多角形,细胞内颗粒逐渐增多,细胞间可见有钙质沉积,经茜素红染色呈红色结节,碱性磷酸酶检测也可发现细胞呈阳性表达;普通培养基培养组则无明显钙质沉积,碱性磷酸酶检测发现细胞呈阴性或弱阳性表达(图4)。
2.5 成软骨诱导及其鉴定
细胞在15 mL离心管经离心后48 h,即可发现细胞聚集成不规则团块样,随着诱导时间的延长,诱导组细胞团块逐渐增大,变成球状,表面也变得光滑。培养4周后,可见诱导组的软骨团块大于普通培养基培养组,诱导后软骨组织包埋切片,可以发现甲苯胺蓝染色呈阳性,经免疫组化检测,诱导后的软骨组织也可表达Ⅱ型胶原和Aggrecan(图5)。
3 讨论
目前,针对有症状关节软骨损伤的修复已成为一种趋势,软骨组织工程的提出,为大面积的软骨缺损修复提供了新的途径。理论上,自体软骨细胞是构建软骨最为理想的种子细胞,但人体内软骨细胞来源非常有限,且在体外培养过程中,软骨细胞增殖能力较弱,也极易发生老化及去分化,丧失形成软骨的能力[6-7]。有学者以骨髓间充质干细胞作为种子细胞在体外构建组织工程软骨,但发现所形成的是一些类软骨样组织,其生物学性能明显不如正常软骨[8-9]。本研究试想,如果能从关节软骨中分离、鉴定出软骨干细胞,一方面能为软骨组织工程提供良好的种子细胞,另一方面也可能为软骨损伤的原位修复治疗提供新的希望。
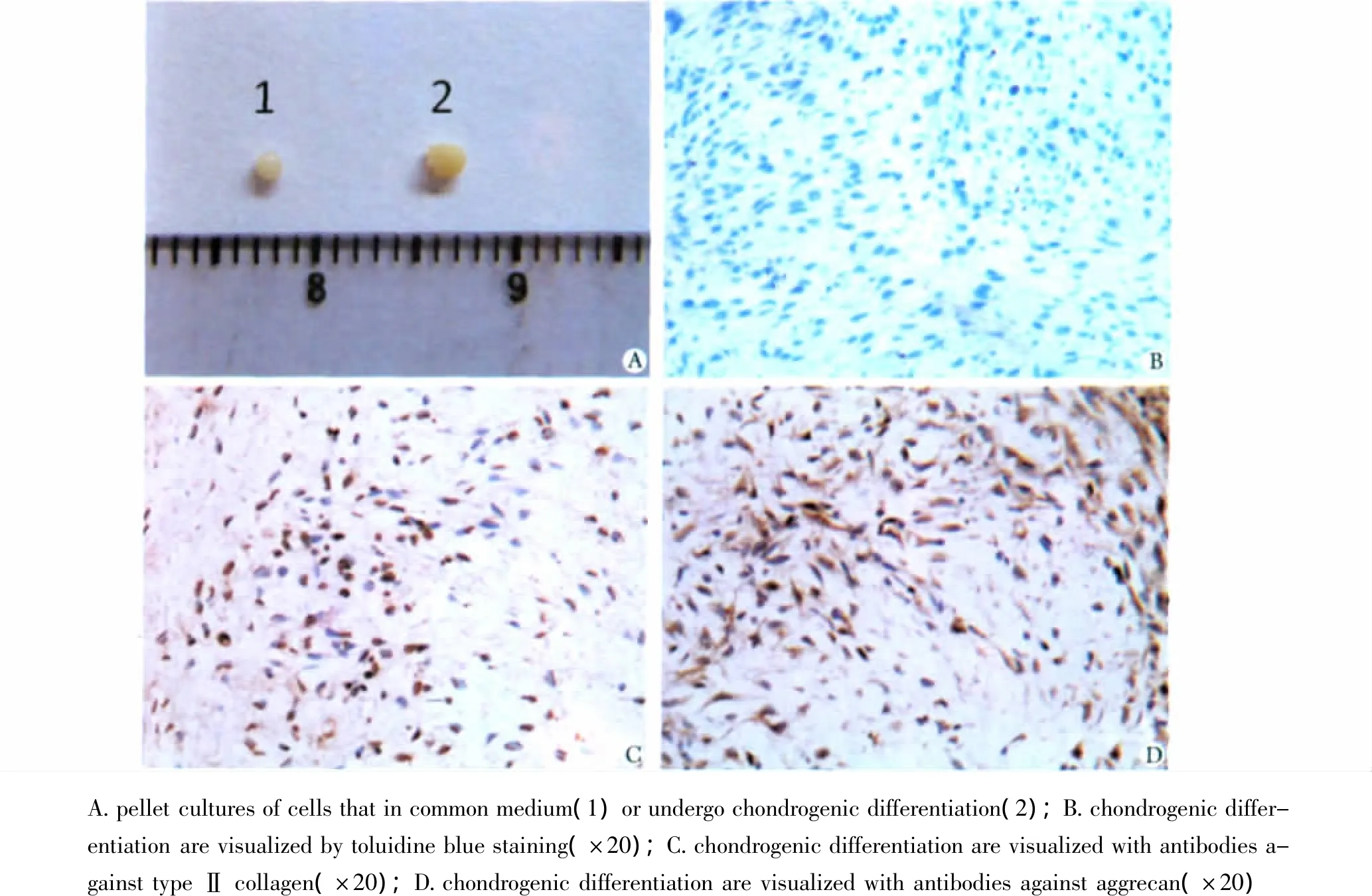
图5 软骨干细胞的成软骨诱导Fig 5 Chondrogenic differentiation in cartilage-derived stem cells
本实验依据干细胞贴壁生长形成单个集落的特性成功分离出软骨干细胞,流式细胞仪检测发现软骨干细胞表面表达 CD44、CD29、CD73、CD90和CD166等分子,且几乎不表达 CD45、CD34和CD133。在体外诱导分化实验中发现,软骨干细胞能成功向脂肪细胞和骨细胞进行分化;当给与成软骨诱导培养基时,软骨干细胞能聚集成团,免疫组化结果显示,诱导后的组织能成功表达Ⅱ型胶原及Aggrecan,Ⅱ型胶原和Aggrecan是关节软骨基质的主要成分,这说明在软骨诱导培养基的作用下,软骨干细胞能成功的向软骨细胞进行分化。根据国际干细胞治疗协会的标准[10],本研究分选出的细胞满足了绝大部分对干细胞定义的要求。
总的来说,本研究认为软骨中存在着软骨干细胞,并成功的对软骨干细胞进行了鉴定,从而可能为软骨组织工程提供了新的种子细胞来源,也为软骨损伤的原位修复提供了希望,但对软骨干细胞的生物学特性,还需要进一步的研究。
[1]Eom YW,Lee JE,Yang MS,et al.Rapid isolation of adipose tissue-derived stem cells by the storage of lipoaspirates[J].Yonsei Med J,2011,52:999 -1007.
[2]Riekstina U,Muceniece R,Cakstina I,et al.Characterization of human skin-derived mesenchymal stem cell proliferation rate in different growth conditions[J].Cytotechnology,2008,58:153 -162.
[3]De Bari C,Dell Accio F,Tylzanowski P,et al.Multipotent mesenchymal stem cells from adult human synovial membrane[J].Arthritis Rheum,2001,44:1928 -1942.
[4]Blanco JF,Graciani IF,Sanchez-Guijo FM,et al.Isolation and characterization of mesenchymal stromal cells from human degenerated nucleus pulposus:comparison with bone marrow mesenchymal stromal cells from the same subjects[J].Spine,2010,35:2259 -2265.
[5]Jones PH,Watt FM.Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression[J].Cell,1993,73:713-724.
[6]Dehne T,Schenk R,Perka C,et al.Gene expression profiling of primary human articular chondrocytes in high-density micromasses reveals patterns of recovery,maintenance,re-and dedifferentiation[J].Gene,2010,462:8 -17.
[7]Schnabel M,Marlovits S,Eckhoff G,et al.Dedifferentiation-associated changes inmorphology and gene expression in primary human articular chondrocytes in cell culture[J].Osteoarthritis Cartilage,2002,10:62-70.
[8]Connelly JT,Wilson CG,Levenston ME.Characterization of proteoglycan production and processing by chondrocytes and BMSCs in tissue engineered constructs[J].Osteoarthritis Cartilage,2008,16:1092-1100.
[9]Adesida AB,Mulet-Sierra A,Jomha NM.Hypoxia mediated isolation and expansion enhances the chondrogenic capacity of bone marrow mesenchymal stromal cells[J].Stem Cell Res Ther,2012,3:9 -20.
[10]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8:315-317.

