以转染CDMP1基因的BMSCs修复软骨缺损
崔 颖,王月田,姚 梅,胡 晶,李俊霞,王 宇,张 本
(辽宁医学院附属第一医院耳鼻咽喉科,辽宁锦州121000)
创伤和疾病引起的头颈部软骨缺损的修复是耳鼻咽喉科头颈外科医师面临的难题。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是源于中胚层的一类多能干细胞,是目前公认的理想的种子细胞。近年来的研究已证明转化生长因子、骨形态发生蛋白、生长分化因子等在诱导BMSCs向软骨细胞分化的过程中发挥着重要的调节作用。但是目前有关选用何种生长调节因子以及如何保证其持续高效的刺激作用还处于探索阶段。软骨源性形态发生蛋白1(cartilage-derived morphogenetic protein 1,CDMP1)是近年来发现的一种多肽生长因子,具有特异的软骨诱导能力,可在异位诱导形成软骨。有关CDMP1对BMSCs诱导作用的研究多数是重组细胞因子的直接刺激作用,但细胞因子在体内代谢快,持续时间短,诱导效率低,并且价格昂贵,使其应用受到一定的限制。随着组织工程和基因工程的发展,细胞治疗[1-4]和基因治疗成为很有前途的治疗方法。因此,通过基因工程技术将外源CDMP1基因导入BMSCs,使其持续稳定高效表达是解决上述问题的一种措施。本实验将重组hCDMP1腺病毒感染的BMSCs与PLGA复合修复喉软骨缺损,为基因工程化软骨提供一种新的思路和方法。
1 材料与方法
1.1 动物
清洁级1月龄新西兰白兔[辽宁医学院动物中心,SYXK(辽)2009-0004]。
1.2 主要试剂
DMEM、胎牛血清、青霉素、链霉素、胰蛋白酶、兔抗人CDMP1多克隆抗体及甲苯胺蓝(Sigma公司),病毒液Ad-CMV-hCDMP1-IRES-eGFP和病毒液Ad-CMV-eGFP(广州赛业生物科技有限公司),胃蛋白酶(福州迈新生物科技开发公司),聚乳酸-羟基乙酸共聚物(济南岱罡公司),Ⅱ型胶原蛋白多克隆抗体(上海优宁维生物科技公司),免疫组化试剂盒(北京博奥森公司)。
1.3 BMSCs的分离和培养
无菌条件下,取1月龄的健康新西兰白兔股骨骨髓,100目筛网过滤,滤液转入离心管,淋巴细胞分离液进行梯度离心[5],取单核细胞层,无血清的L-DMEM洗涤细胞两次,2%锥虫蓝染色,细胞计数,以4×105/mL的浓度接种于培养瓶中。48 h首次半换液,以后每隔2~3 d换液1次。
1.4 CDMP基因转染BMSCs
取第3代兔BMSCs以5×105/孔的浓度接种于6孔板中常规培养24 h,待细胞贴壁后吸去上清。按照感染复数(MOI)=50、100、200和300四个值转染BMSCs,留下2孔作为阴性对照。37℃孵育3 h,换成完全培养基常规培养48~72 h,荧光倒置显微镜下检测eGFP,以不引起明显细胞病变效应(cytopathic effect,CPE)的最大MOI作为腺病毒的最佳MOI值。取第3代生长状态良好、生长至约80%汇合的BMSCs,随机分为3组。转染组:感染 Ad-CMV-hCDMP1-IRES-eGFP(A组);未转染组:感染Ad-CMV-eGFP(B组);对照组:未感染病毒(C组)。各组病毒液以最佳MOI值分别转染BMSCs,48~72 h在荧光倒置显微镜下观察感染效果,计算感染效率。
1.5 RT-PCR检测基因转染后的CDMP1 mRNA表达
提取细胞总RNA,1%琼脂糖凝胶电泳检测,RT-PCR检测hCDMP1的表达。引物序列(表1)。
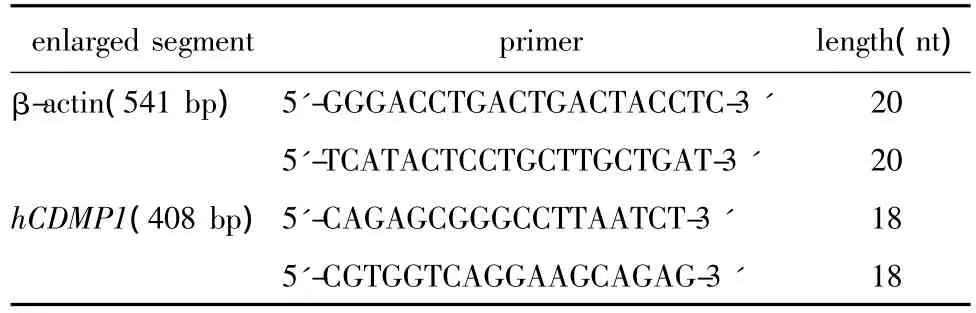
表1 引物序列Table 1 Sequence of primer
1.6 免疫印迹法(Western blot)检测CDMP1蛋白的表达
制备蛋白样品,测定蛋白含量,据标准曲线计算出蛋白浓度,上样,电泳,转膜,凝胶成像系统分析膜上目的条带与内参照。
1.7 免疫组化方法检测转染后细胞Ⅱ型胶原的表达
取感染后72 h的上述3组细胞爬片(每组10张),丙酮固定。免疫组化方法检测细胞Ⅱ型胶原的表达。医学图像分析系统测定染色的吸光度。200倍镜下切片随机选取3个阳性视野测量吸光度,取其均值表示该标本的蛋白表达强度。
1.8 转染细胞支架复合物修复软骨缺损的动物实验
新西兰大白兔12只(3月龄,雌雄不限,体质量2.0~2.5 kg),随机分为3组。Ⅰ组:植入转染组细胞与PLGA复合物;Ⅱ组:植入BMSCs与PLGA复合物;Ⅲ组:植入单纯PLGA;每组4只。建立甲状软骨局部缺损的动物模型[6],于左侧做一1.0 cm ×1.0 cm全层软骨缺损,不穿透喉黏膜。将上述3组细胞支架复合物移植缺损处,缝线稍做固定。术后每日耳缘静脉注射青霉素160万单位,连续应用3 d。术后观察动物呼吸、活动及进食情况,分别于术后4和8周无痛处死动物,对所获得的工程化软骨进行大体和组织切片观察。
1.9 统计学分析
应用SPSS17.0软件对各组结果进行统计分析。数值以均数±标准差表示。
2 结果
2.1 细胞培养
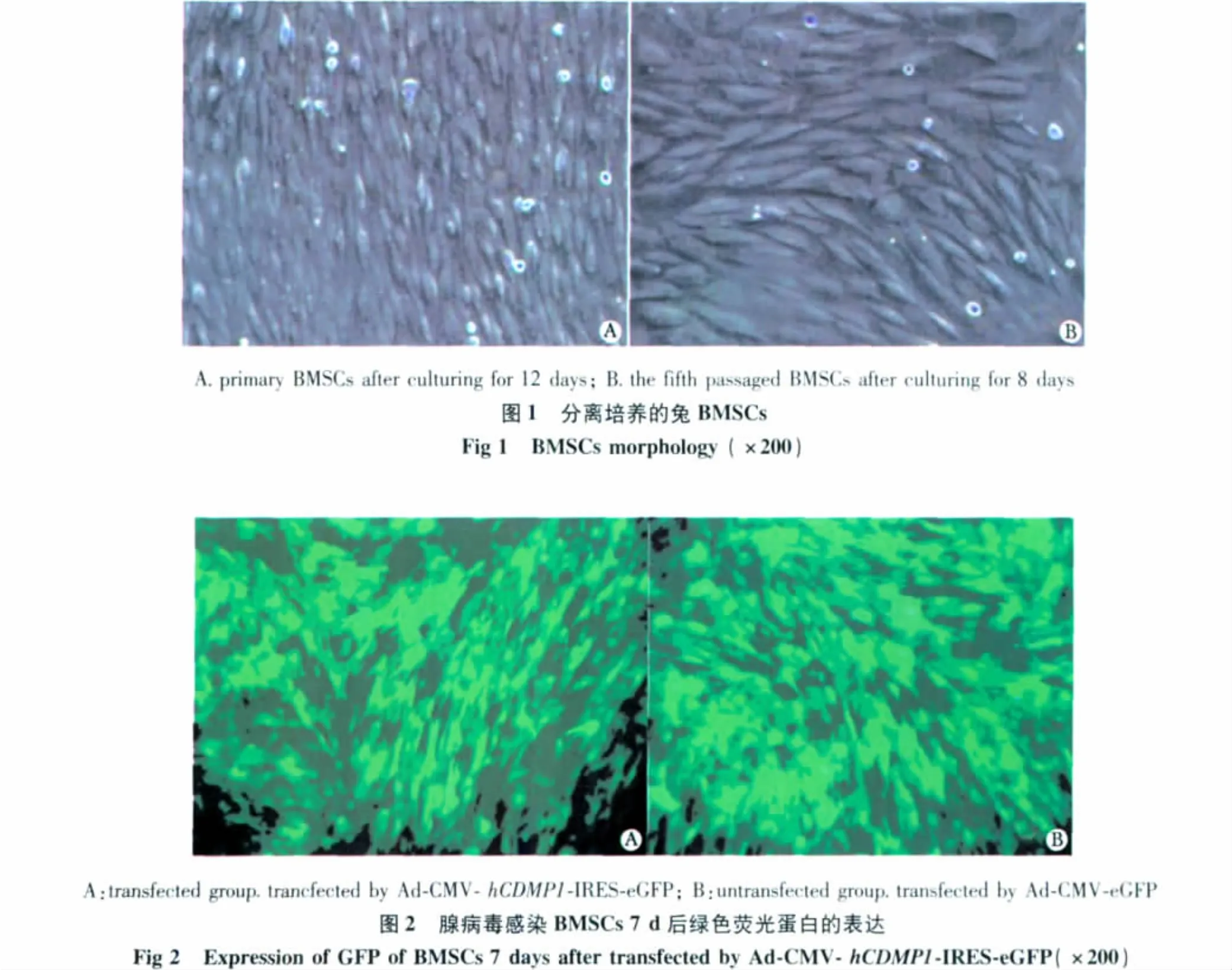
BMSCs刚接种时,其内有血细胞混杂,成分不易分辨。3 d后首次换液,可见贴壁细胞呈三角形、多角形或短梭形,部分区域有细胞的小集落形成,数个至数十个不等。6~7 d后贴壁的细胞体积增大,细胞形态基本一致,呈典型的成纤维细胞形态。10~12 d后贴壁的细胞逐渐增多并连接成片,呈鱼群状排列。传代培养细胞比原代细胞成分纯净,2 d后大部分细胞贴壁,细胞形态较舒展,3~4 d可见细胞增殖,呈典型的长梭形,细胞数明显增加,7~8 d长满瓶底(图1)。
2.2 感染后hCDMP1基因的表达
感染后24 h,A和B两组细胞在荧光倒置显微镜下均可见到少量绿色荧光,48 h绿色荧光明显增多,72 h则可见到大量绿色荧光,荧光与细胞轮廓一致,转染率为90% 以上,持续14 d以上(图2),C组细胞未见绿色荧光。
2.3 RT-PCR检测基因转染后的CDMP1 mRNA表达
A组出现约443 bp大小的电泳条带,和hCDMP1 cDNA大小一致。而B组、C组均未出现电泳条带(图3)。

图3 基因转染后BMSCs中hCDMP1 mRNA的表达Fig 3 Expression of hCDMP1 mRNA of BMSCs after transfection by RT-PCR
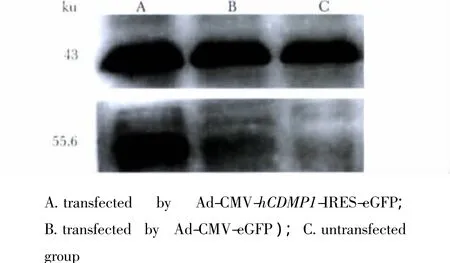
图4 感染后BMSCs中hCDMP1蛋白的表达Fig 4 Expression of hCDMP1 protein of BMSCs after transfection by Western blot
经计算机图像分析,各组Ⅱ型胶原表达(以积分吸光度IA表示)IA(表2)。
2.4 免疫印迹法(Western blot)检测CDMP1蛋白的表达
转染组出现分子质量大小约55.6 ku的明显电泳条带(与hCDMP1蛋白质分子质量相符),而未转染组和对照组则无电泳条带显示(图4),内参β-actin大小是43 ku。
2.5 免疫组化方法检测转染后细胞Ⅱ型胶原的表达
转染组胞质出现较明显Ⅱ型胶原的表达;而未转染组和对照组显色较弱(图5)。

表2 感染后BMSCs细胞外基质染色的吸光度值(IA)Table 2 Analysis of IAD of BMSCs after transfection(n=10)
2.6 转染细胞支架复合物修复软骨缺损的动物实验
所有动物术后4~8 h均可以进食,24 h后活动基本正常,颈部切口Ι期愈合。
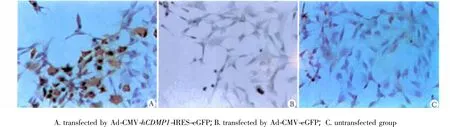
图5 感染后BMSCs中Ⅱ胶原蛋白的表达Fig 5 Expression of collagen typeⅡ of BMSCs after transfection by immunohischemistry(×200)
术后4周和8周分别处死每组动物,对软骨缺损修复区进行观察。术后4周可见Ⅰ组动物缺损处色泽淡红,表面光滑,和周围软骨基本平齐。Ⅱ、Ⅲ组缺损处大体形态无明显差异,创面明显,色泽暗红,与周围正常软骨界限清晰。缺损处充填组织质地较软,创面均未见明显感染及坏死表现。术后8周见Ⅰ组动物缺损处创面稍显灰白,呈现软骨样外观,表面光滑,与正常软骨边界模糊。Ⅱ、Ⅲ组动物缺损处创面淡红,凹陷,质地较韧,与周围正常软骨界限清晰(图6)。
对所获得的组织工程化软骨进行组织学观察。4周时,缺损区未见明显炎性反应。Ⅰ组动物颈部缺损区有不成熟的软骨细胞生成,无明显软骨陷窝,Ⅱ型胶原蛋白和甲苯胺蓝染色阳性,Ⅱ、Ⅲ组动物颈部缺损区无明显软骨细胞生成,Ⅱ型胶原蛋白和甲苯胺蓝染色阴性。8周时,Ⅰ组动物颈部缺损处软骨样细胞明显增多,大量软骨陷窝形成,Ⅱ型胶原蛋白和甲苯胺蓝染色阳性,Ⅱ、Ⅲ组动物缺损区基本为纤维瘢痕组织代替,Ⅱ型胶原蛋白和甲苯胺蓝染色阴性(图7,8,表3)。
表3 工程化软骨GAG、Ⅱ型胶原阳性染色面积和吸光度分析Table 3 Analysis of GAG and collagenⅡpositive area and intensity of different groups(,n=10)
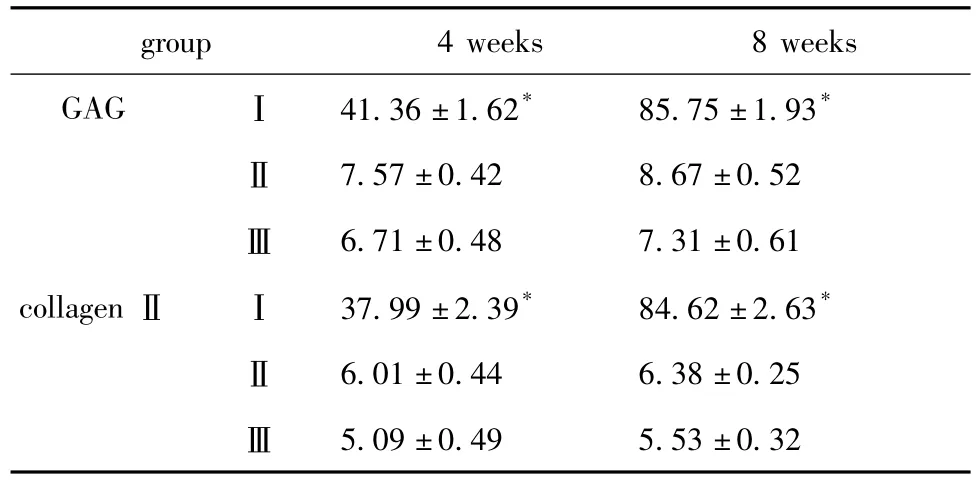
表3 工程化软骨GAG、Ⅱ型胶原阳性染色面积和吸光度分析Table 3 Analysis of GAG and collagenⅡpositive area and intensity of different groups(,n=10)
*p<0.05 compared with other groups.
group 4 weeks 8 weeks GAG Ⅰ 41.36±1.62* 85.75±1.93*5.09±0.49 5.53±0.32Ⅱ 7.57±0.42 8.67±0.52Ⅲ 6.71±0.48 7.31±0.61 collagenⅡ Ⅰ 37.99±2.39* 84.62±2.63*Ⅱ 6.01±0.44 6.38±0.25Ⅲ
3 讨论
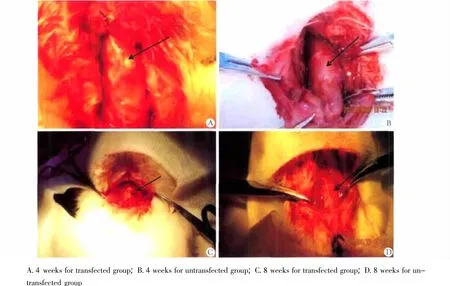
图6 转染细胞支架复合物移植后修复软骨缺损的大体观察Fig 6 The transfected and untransfected cell scaffold culture systems were implanted into the rabbit thyroid cartilage defects and the culturing systems were analyzed at the gross level
hCDMP1即生长分化因子5,是转化生长因子β(TGF-β)超家族的成员,也是骨形态发生蛋白家族中的新亚型[7-11],在软骨形成的初期主要是促进间充质前软骨细胞黏附、聚集和分化,后期则显著促进软骨细胞的成熟和肥大。目前国内外已经将CDMP1用于软骨组织工程,但多数学者都是将CDMP1蛋白添加到体外研究体系中或注射到体内进行实验。虽然取得了较为可观的结果,但是作用时间短、CDMP1蛋白的快速降解、反复追加致成本价格的昂贵以及反复干预的操作繁琐限制了它的应用。通过将外源的CDMP1基因导入细胞并使其稳定表达的基因疗法是解决以上问题的良方。用脂质体转染法将CDMP1基因导入兔骨髓基质干细胞,用以修复兔关节软骨缺损。在用CDMP1转染同源BMSCs植入兔关节软骨缺损处8周后,修复的软骨表面形态可以与分化成熟的透明软骨相比拟,而且软骨下组织也完全由接近宿主软骨下骨的新生厚层骨组织修复。用脂质体介导法成功将hCDMP1基因转染兔BMSCs并诱导成软骨细胞,但所得工程化软骨不及正常软骨[1]。本实验采用的腺病毒载体缺失E1区,即病毒复制缺失,故作为载体进行基因治疗时不会在体内不断复制,也不会整合到宿主染色体内,因而对于机体相对是安全的,但基因表达的可控性有待提高。本实验采用腺病毒携带hCDMP1基因成功导入兔BMSCs,RT-PCR及Western blot等方法证实目的基因得到了稳定表达,并持续2周以上,MTT检测结果证明腺病毒携带hCDMP1基因感染BMSCs未引起BMSCs的过度增殖或抑制 (结果未在本文显示),说明腺病毒转染相对是安全的,这为基因转染应用于软骨组织工程提供了依据。
PLGA具有良好的机械强度、生物相容性和可控制性[12],广泛应用于组织工程和药物缓释材料等方面。PLGA具有极高的生物相容性,安全性好,异物反应及免疫原性也极低,物理和化学性能稳定,为BMSCs增殖和分化提供适宜的三维空间。
软骨细胞间质的化学成分主要包括胶原蛋白和蛋白多糖。软骨组织中的胶原主要是Ⅱ型胶原,占胶原总量的90%以上。因此Ⅱ型胶原蛋白和糖胺聚糖是软骨细胞的特殊标志。本实验中,基因转染后BMSCs合成细胞外基质的能力增强,与对照组和未转染组相比,转染组Ⅱ型胶原蛋白和糖胺聚糖表达水平显著提高,因此提示hCDMP1有诱导BMSCs向软骨细胞表型分化的能力。动物实验中观察到4周时Ⅰ组动物颈部缺损区新生组织的Ⅱ型胶原蛋白和甲苯胺蓝染色阳性,Ⅱ、Ⅲ组动物颈部缺损区上述染色阴性。8周时Ⅰ组缺损区类软骨样细胞增多,Ⅱ型胶原蛋白和甲苯胺蓝染色阳性面积增多,Ⅱ、Ⅲ组缺损区为纤维组织修复,上述染色无明显阳性。Ⅰ组Ⅱ型胶原蛋白和糖胺聚糖的分泌强于其他两组,说明腺病毒携带hCDMP1基因感染BMSCs能使其持续表达具有生物学效应的hCDMP1。
本实验采用腺病毒携带hCDMP1基因感染的BMSCs与PLGA复合修复喉软骨缺损,从形态和组织学上分别证实了缺损区类软骨的形成和喉软骨缺损的成功修复。综上所述,用转染效率较高的腺病毒携带hCDMP1基因感染BMSCs,然后与PLGA三维生物支架结合所获得的组织工程化软骨可以有效地修复喉软骨缺损。
[1]任晓勇,张银刚,陈文弦.hGDF5基因转染对骨髓间充质干细胞增殖和分化的影响[J].西安交通大学学报:医学 版,2006,27:15-19.
[2]Arnalich-Montiel F,Paster S,Blazquez-Martinez A,et al.Adipose-derived stem cells are a source for cell theraphy of the corneal stroma[J].Stem Cells,2008,26:570-579.
[3]Sun XJ,Xia LG,Chou LL,et al.Maxillary sinus floor elevation using a tissue engineered bone complex with BMP-2 gene modified bMSCs and a novel porous ceramic Scaffold in rabbits[J].Arch Oral Biol,2010,55:195-202.
[4]Subhash HM,Xie H,Smith JW,et al.Optical detection of indocyanine green encapsulated biocompatible poly(lacticco-glycolic)acid nanoparticles with photothermal optical coherence tomography[J].Opt Lett,2012,37:981-983.
[5]崔颖,马林祥,朱丽明,等.CDMP和TGF联合诱导BNSCs修复软骨缺损[J].基础医学与临床,2011,31:155-160.
[6]罗家胜,陈文弦,崔鹏程,等.异种骨载体复合骨形态发生蛋白修复兔甲状软骨缺损的实验[J].中国临床康复,2005,18:70-71.
[7]Miyamoto Y,Mabuchi A,Dong QS,et al.A functional polymorphism in the 5'UTR of GDF5 is associated with suscep-tibility to osteoarthritis[J].Nat Genet,2007,39:529-532.
[8]Dines JS,Cross MB,Dines D,et al.In vitro analysis of an rhGDF-5 suture coating process and the effects of rhGDF-5 on rat tendon fibroblasts[J].Growth Factors,2011,29:1-7.
[9]Yin S,Cen L,Wang C,et al.Chondrogenic transdifferentiation of human dermal fibroblasts stimulated with cartilagederived morphogenetic protein 1[J].Tissue Eng Part A,2010,16:16333-1643.
[10]Yao L,Wang S,Cui W,et al.Effect of functionalized micropatterned PLGA on guided neuring growth[J].Biomaterials,2009,5:580-588.
[11]Sun XJ,Xia LG,Chou LL,et al.Maxillary sinus floor elevation using a tissue engineered bone complex with BMP-2 gene modified bMSCs and a novel porous ceramic Scaffold in rabbits[J].Archives of Oral Biology,2010,55:195-202.
[12]Li JW,Guo XL,He CL,et al.In vitro chondrogenesis of the goat bone marrow mesenchymal stem cells directed by chondrocytes in monolayer and 3-dimetional indirect coculture system[J].Chin Med J(Engl),2011,124:3080-3086.

