HMGB1及TLR2、TLR4在类风湿关节炎中的表达及意义
米亚英,杨丽丽,孙利平
(1.大同大学医学院免疫学研究所,山西大同037009;2.山西省中西医结合医院检验科,山西太原030013;3.山西省大同市第五人民医院免疫风湿科,山西大同037006)
类风湿关节炎 (rheumatoid arthritis,RA)是最常见的系统性自身免疫病之一,其病理改变为对称性、进行性及侵蚀性的多关节慢性炎性反应,主要表现为关节肿胀、疼痛,病变若侵蚀关节滑膜下层的软骨和骨组织,最终可造成关节结构破坏、功能障碍。随着高迁移率族蛋白1(high mobility group box chromosomal protein l,HMGB1)及相关配体 TLR2、TLR4的发现[1-3],越来越多的证据表明,HMGB1/TLR与 RA 有着密切关系[4-5]。本实验用ELISA检测不同分期RA患者血清中HMGB1的表达,用FCM检测外周血单核细胞表面TLR2和TLR4的表达,旨在探求HMGB1/TLR通路在类风湿关节炎发病机制中的作用,为进一步寻找治疗RA的新方法提供实验依据。
1 资料与方法
1.1 资料
1.1.1 一般资料:所有标本的选取均获得知情同意,受试病例均为2009年10月至2010年4月大同市第五人民医院风湿免疫科门诊及住院患者。排除在纳入前1个月内服用过激素、免疫抑制剂或其他影响免疫功能的药物及感染,肿瘤等疾病。
据美国风湿病协会在ACR1987年RA诊断标准,将患者分为活动期和非活动期:其中活动期29例,男9例,女20例,年龄(53.6 7.0)岁;非活动期20例,男5例,女15例,年龄(51.7 15.6)岁。对照组18例,男6例,女12例,均为性别、年龄与RA患者相匹配的健康体检者(均获得患者知情同意)。
1.1.2 主要试剂:HMGB1 ELISA试剂盒(R&D公司),TLR4-PE(eBioscience 公 司),CD14-FITC、TLR2-APC、小鼠IgG1 APC同型对照、小鼠 IgG1 PE同型对照(BD公司)。
1.2 方法
1.2.1 ELISA检测血清中HMGB1的含量:所有受试者于清晨空腹抽取新鲜静脉血2 mL,离心分离血清,-20℃保存。常规双抗体夹心法检测,450 nm处检测A值,CurveExpert分析,求得血清中HMGB1的实际浓度。
1.2.2 FCM检测单核细胞表面TLR2、TLR4的表达:每管取新鲜EDTA抗凝全血100μL;一管加入20μL CD14-FITC、10μL Mouse-IgG1-APC、20μL Mouse-IgG1-PE作为同型对照,一管加入20μL CD14-FITC、20 μL TLR2-APC、5 μL TLR4-PE;混匀后4℃下避光保存20 min;加入2 mL红细胞裂解液,充分振荡混匀室温静置10 min,1 500 r/min,离心7 min,弃上清;加 PBS 2 mL洗涤,同速离心,弃上清;再加PBS 2 mL洗涤,同速离心,弃上清;加PBS 200μL待测,每次上机测试前需振荡混匀,BD FACSAria流式细胞仪检测;在BD FACSDiva软件下,用FCSExpress Version 3进行分析。CD14+单核细胞表面TLR2、TLR4表达率以检测样品阳性细胞表达率减去样品同型对照阳性细胞表达率表示,TLR2、TLR4蛋白相对含量以平均荧光指数(mean fluorescence index,MFI)表示,MFI=(样品蛋白表达的平均荧光强度-同型对照样品蛋白表达的平均荧光强度)/正常对照样品平均荧光强度。
1.3 统计学分析
2 结果
2.1 HMGB1蛋白在RA患者与健康对照者血清中的表达水平
活动期RA患者血清HMGB1蛋白水平为63.48±3.39μg/L,明显高于非活动期的18.70±1.83μg/L和对照者的 16.01±0.57μg/L(p<0.05);非活动期RA患者与对照者无差异。
2.2 TLR2在CD14+单核细胞上的表达水平
活动期RA患者CD14+单核细胞上TLR2的表达率及蛋白相对含量,均显著高于非活动期及对照者(P <0.05)(图1,表1)。
2.3 TLR4在CD14+单核细胞上的表达水平
活动期RA患者CD14+单核细胞上TLR4的表达率及蛋白相对含量,均显著高于非活动期及对照者(p<0.05);非活动期RA患者CD14+单核细胞上TLR4的表达率及蛋白相对含量亦显著高于对照者(P <0.05)(图2,表1)。
2.4 相关分析
活动期RA患者血清HMGB1蛋白含量与TLR2、TLR4蛋白相对含量呈正相关(p<0.05)。

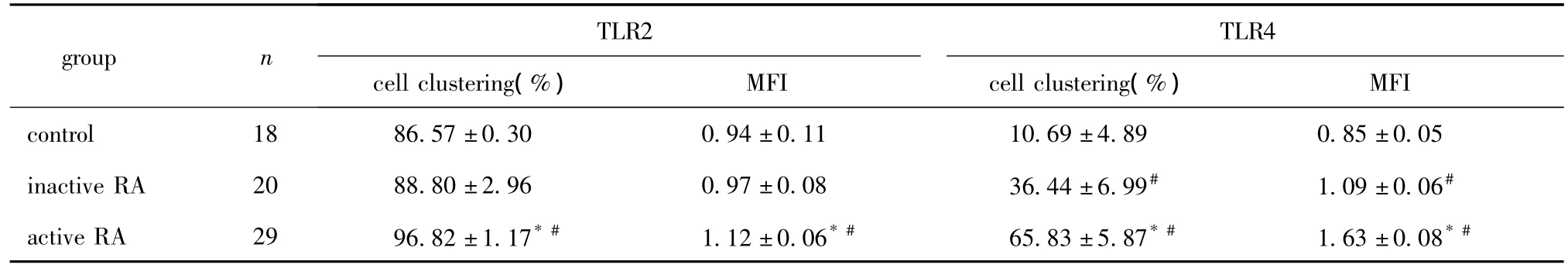
表1 TLR2和TLR4在RA患者和健康对照者CD14+单核细胞上的表达Table 1 The expression of TLR2 and TLR4 on CD14+monocytes of RA patients and healthy controls(x±s)
3 讨论
RA是常见的以关节组织慢性炎性反应为主要表现的系统性自身免疫病。其发病机制目前尚未完全明了。近年来,各国学者都在探索直接针对RA发病过程的生物制剂,以期对RA进行彻底治疗。先前人们公认导致RA的主要细胞因子为TNF-α和IL-1与TNF-α和IL-1相比,HMGB1出现时间较晚,持续时间较长,被称为晚期炎性细胞因子[6]。本研究通过对RA患者血清HMGB1的检测,试图探讨RA患者HMGB1的变化。结果显示,活动期RA患者血清HMGB1明显高于非活动期RA和对照者,认为血清HMGB1可作为评价RA病情活动的指标。
新近研究证实,Toll样受体(TLR2和TLR4)参与 HMGB1 的识别[7-8],荧光能量共振转移(fluorescence resonance energy transfer,FRET)和免疫沉淀反应显示HMGB1和TLR2、TLR4分子表面的相互作用。本研究检测RA患者及对照者外周血CD14+单核细胞表面TLR2和TLR4的表达,发现活动期RA患者TLR2、TLR4表达率及蛋白相对含量均显著高于非活动期RA患者和对照者,提示TLR2、TLR4的表达与RA病情的发生、发展和转归有关系。推测TLR2、TLR4可增强外周血单核细胞的活化和下游信号传导效应,并通过激活TLRs信号通路参与RA病情进展。相关分析表明:在活动期 RA患者HMGB1与 TLR2、TLR4的表达呈正相关,说明HMGB1与TLR2、TLR4在活动期RA患者中表达同步,推测当某些因子刺激PBMC合成HMGB1,会导致其大量释放入血,HMGB1可能通过单核细胞胞膜上的TLR2、TLR4进行信号传导,激活下游炎性介质释放的瀑布效应。
总之,我们推测HMGB1/TLR通路可能是RA发病中炎性反应信号的重要启动因素,探讨其在RA发生和发展中的确切机制及信号传导途径,进而研制出一种阻断或抑制这条途径激活的药物,对阻断RA炎性反应的进一步放大,有效预防和治疗类风湿关节炎具有一定意义。当然,本研究样本量小,只是将HMGBI/TLR与RA之间关系做了初步探讨,至于HMGBI/TLR在RA中的确切作用机制还有待进一步研究。
[1]Andersson U,Tracey KJ.HMGB1 as a mediator of necrosis induced inflammation and a therapeutic target in arthritis[J].Rheum Dis Clin North Am,2004,30:627 -637.
[2]Monaco C,Gregan SM,Navin TJ,et al.To-ll-like receptor 2 mediates inflamma tion and matrix degradation in human atherosclerosis[J].Circulation,2009,120:2462 -2469.
[3]李鸿昌,赵跃然.高迁移率族蛋白1及其受体在系统性红斑狼疮中的作用[J].医学综述,2012,18:505 -509.
[4]Andreakos E,Sacre S,Foxwell B M,et al.The toll-like receptor-nuclear factor kappa B pathway in rheumatoid arthritis[J].Front Biosci,2005,10:2478 - 2488.
[5]Van Beijnum JR,Buurman WA,Griffioen AW.Convergence and amplification of toll-like receptor(TLR)and receptor for advanced glycation end products(RAGE)signaling pathways via high mobility group B1(HMGB1)[J].Angiogenesis,2008,11:91 -99.
[6]Wang H,Li W,Goldstein R,et al.HMGB1 as a potential therapeutic target[J].Novartis Found Symp,2007,280:73-85.
[7]Jong Sung Park,Daiva Svetkauskaite,Qianbin He,et al.Involvement of toll-like receptors 2 and 4 in cellular activation by high mobility group box 1 protein[J].Biol Chem,2004,279:7370 -7377.
[8]董秋萍,李涛,熊自忠.TLR接头蛋白研究进展[J].基础医学与临床,2011,31:97-100.

