MMP-9 R279Q基因多态性与冠心病易感性的Meta分析
陈卫强,王浩然,张 健,齐向前*
(1.天津医科大学心血管病临床学院泰达国际心血管病医院心内科,天津300457;2.国家心血管病中心中国医学科学院北京协和医学院阜外心血管病医院心血管疾病国家重点实验室,北京100037)
造成动脉粥样硬化斑块纤维帽厚度和抗损伤强度降低、粥样斑块稳定性下降的主要机制包括动脉粥样硬化斑块内单核/巨噬细胞聚集、内源性基质金属蛋白酶抑制物减少和(或)合成基质金属蛋白酶(matrix metalloproteinase,MMPs)增多[1]。MMP-9以前酶原的形式合成,是血管壁细胞表达和分泌的最主要的MMP,分子质量为92 ku,作用底物包括Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原及明胶、弹性蛋白等。MMP-9能高效降解Ⅳ型胶原,而Ⅳ型胶原是粥样硬化斑块基底膜和纤维帽的重要组成部分。因此MMP-9在炎性反应、动脉粥样病变中起关键作用。
年龄、性别、吸烟、高血压、高胆固醇、糖尿病、肥胖和久坐不动的生活方式都与冠心病的发生有关,但是冠心病的确切机制尚不明确。现有的研究认为,环境因素和遗传因素对冠心病的发生均具有一定的作用,其中遗传因素在冠心病的发生发展中具有非常重要的作用[1-2]。MMP水平与很多心血管疾病相关,包括动脉粥样硬化、心肌梗死和心力衰竭[2-4]。在高血压、急性冠脉综合征和急性心肌梗死的患者中 MMP-9 水平升高[3,5-6]。MMP-9 R279Q单核苷酸多态性(single nucleotide polymorphism,SNP)位点位于MMP-9的催化区域,是精氨酸至谷氨酰胺的氨基酸变化[7-8],有确切的证据表明该突变为降低MMP-9功能的突变[9],与冠心病的发病风险可能有关。冠心病发病风险与MMP-9 R279Q基因多态性研究较多,但研究结果并不一致。为明确MMP-9 R279Q单核谷氨酸SNP位点与冠心病易感性的关系,本研究搜索相关的病例对照研究,通过Meta分析,对MMP-9 R279Q基因多态性与冠心病发病风险的相关性进行定量评价。
1 材料与方法
1.1 材料
在PubMed数据库中检索英文文献,检索词为matrix metalloproteinase,coronary heart disease,cardiovascular disease,polymorphism,辅以文献追溯法去查找相关文献。
1.2 方法
1.2.1 文献纳入标准:1)关于MMP-9 R279Q基因多态性与冠心病易感性关系的独立的病例对照研究,并在2012-01-01以前发表;2)能直接或间接提供统计指标OR及95%CI,文中报告数据完整;3)有数据重复的多篇文献,选取信息最为详细或病例样本数最大的文献。
1.2.2 文献排除标准:1)无法提取相关数据或数据不完整的文献;2)重复文献。
1.2.3 数据提取:对于纳入的文章,研究者均按照作者、发表年份、国家、人种、样本量以及冠心病组和对照组各基因型携带者的数量进行整理。
1.3 统计学分析
进行异质性检验通过计算Q检验统计量,若P>0.10,各合并的数据认为无显著的异质性,采用固定效应模型,否则采用随机效应模型分析。计算各研究及合并数据的OR值及其95%CI,绘制森林图,展示各研究结果及其特征。横坐标为各研究OR自然对数值的标准误,纵坐标为OR值的自然对数,绘制漏斗图(Begg's funnel plot)描述发表偏倚,STATA 11.0软件的线性回归模型(Egger法)检验漏斗图的对称性,评估发表偏倚。
2 结果
2.1 研究资料概况
共5篇文献符合标准,均为英文文献,其中研究中国人群的文献2篇。MMP-9 R279Q多态性位点有5 项研究[10-14],累计冠心病病例3 630例,对照1 834例(表1)。
2.2 Meta分析结果
MMP-9 R279Q多态性位点中,进行异质性检验,纳入5项研究,在4种模式中,各研究之间均未存在明显的异质性,因此采用固定效应模型,结果显示基因型比较模型中合并OR值为0.925(95%CI=0.847-1.009),纯合子比较模型中合并OR值为0.866(95%CI=0.713-1.052),显性模型中合并OR值为0.909(95%CI=0.809-1.020),隐性模型中合并OR值为0.902(95%CI=0.750-1.086)(图1~3)(表2)。
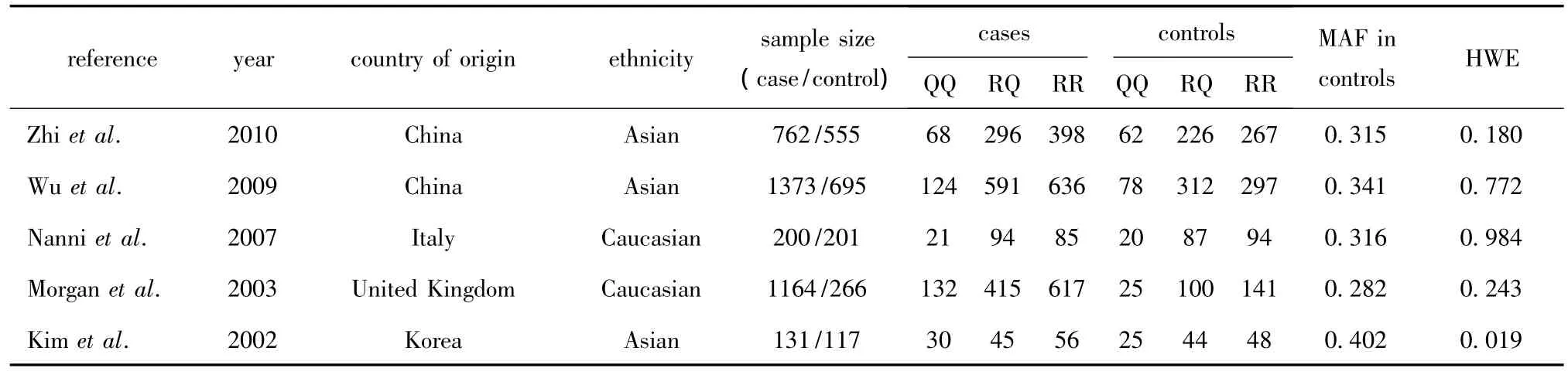
表1 纳入Meta分析的MMP-9 R279Q多态性位点与冠心病易感性的相关性研究Table 1 Studies about the relationship between MMP-9 R279Q polymorphism and susceptibility to coronary heart disease into meta-analysis

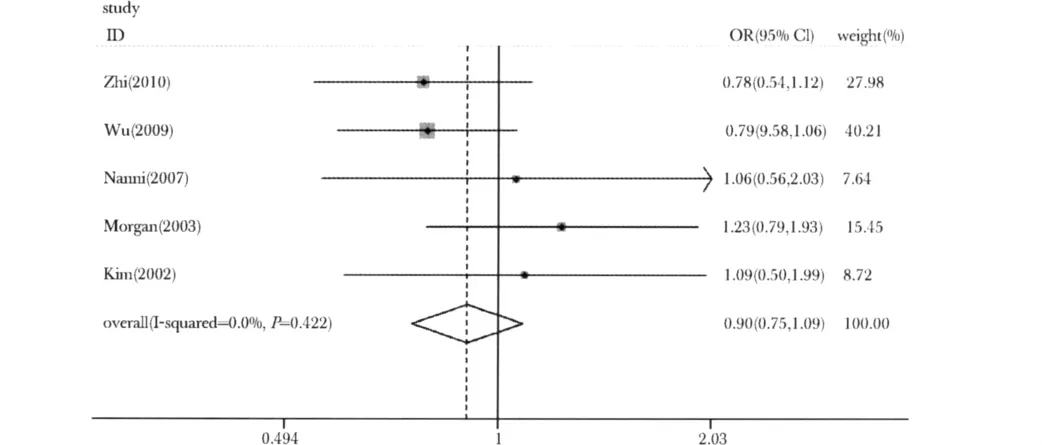
图3 MMP-9 R279Q多态性位点与冠心病易感性隐性模型的森林图Fig 3 Forest plot for association of MMP-9 R279Q polymorphism and susceptibility to coronary heart disease from a recessive genetic model
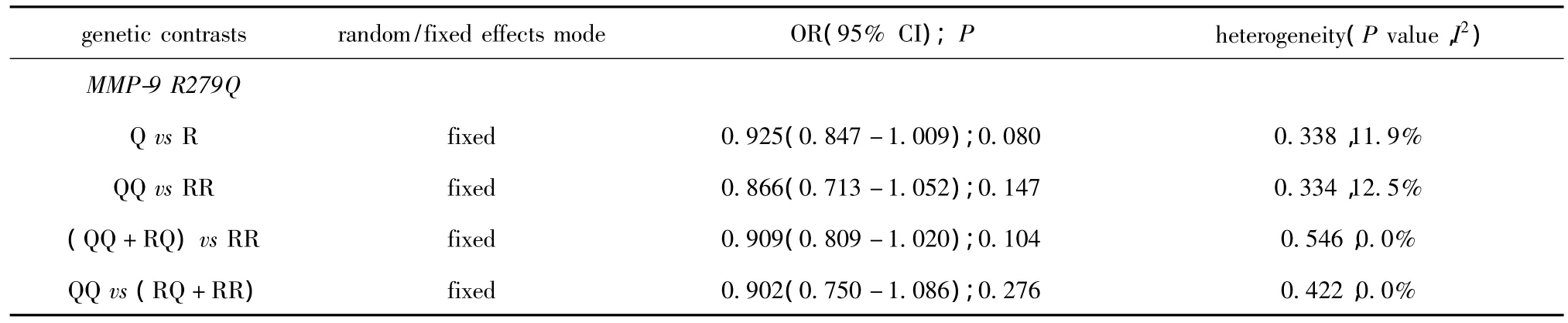
表2 MMP-9 R279Q多态性位点与冠心病易感性的Meta分析结果Table 2 The relationship between MMP-9 R279Q polymorphism and susceptibility to coronary heart disease in meta-analysis
2.3 发表偏倚评估
MMP-9 R279Q多态性位点比较模型的Begg漏斗图示P>|z|=0.221,各点基本对称,分别均匀,绝大部分点都在95%可信区间内。Egger检验示,P>|t|=0.078>0.05(图4),故不能认为有显著性发表偏倚。MMP-9 R279Q多态性位点中,纯合子比较模型中Begg漏斗图示P>|z|=0.221,Egger检验显示,P>|t|=0.082>0.05;显性模型中Begg漏斗图示P>|z|=0.221,Egger检验显示,P>|t|=0.103>0.05;隐性模型中Begg漏斗图示P>|z|=0.462,Egger检验显示,P > |t|=0.105>0.05。
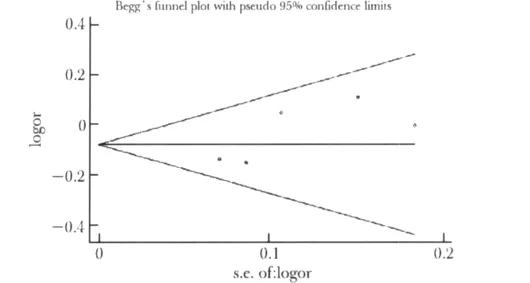
图4 MMP-9 R279Q多态性位点基因型比较的漏斗图Fig 4 Funnel plot for association of MMP-9 R279Q polymorphism and susceptibility to coronary heart disease
3 讨论
基质金属蛋白酶(MMP)可降解基底膜的细胞外基质成分,是一组锌依赖性酶。斑块中巨噬细胞可分泌多种MMP,它们参与了动脉粥样硬化病变重构的全过程,能降解细胞外基质,与血管管腔的狭窄或扩张有关,由此可引发心血管事件。对MMP-9 R279Q多态性位点的Meta分析结果提示MMP-9 R279Q基因多态性可能不是冠心病的易感性因素。
Meta分析通过合并同类研究,使统计效率增加,可得到更符合实际的结果。但Meta分析必然也会引入其他混杂因素,例如不同研究之间结果的异质性、阳性结果的研究相对易发表而导致的发表偏倚等。遗传学研究中的基本定律包括Hardy-Weinberg遗传平衡(HWE),样本的代表性可通过HWE检验。对纳入文献进行HWE检验,结果表明MMP-9 R279Q多态性位点除1篇文献外均符合HWE定律,剔除该研究后,本研究结果并无明显的改变。采用Egger检验和Begg漏斗图分别评估发表偏倚,发现发表偏倚均无显著性差异,说明结论比较可靠。本研究进一步明确了MMP-9 R279Q多态性与冠心病的相关性,为探索冠心病发生发展的分子机制、寻找冠心病相关的易感性基因进行了初步探索。
Meta分析具有一定的局限性,它是在总结既往发表文献的基础上进行的分析,受到诸多的条件限制,所以下结论也应慎重。本研究存在的局限性:1)不能完全排除选择性偏倚,因为研究的大部分对照为医院对照;2)未考虑基因-环境、基因-基因的交互作用;3)存在一定的发表偏倚。因此,有必要进一步深入研究MMP-9 R279Q基因多态性与冠心病易感性的关系。
[1]Xu XP,Meisel SR,Ong JM,et al.Oxidized low-density lipoprotein regulates matrix metalloproteinase-9 and its tissue inhibitor in human monocyte-derived macrophages[J].Circulation,1999,99:993 -998.
[2]Galis ZS,Khatri JJ.Matrix metalloproteinases in vascular remodeling and atherogenesis:the good,the bad,and the ugly[J].Circ Res,2002,90:251 -262.
[3]Hlatky MA,Ashley E,Quertermous T,et al.Matrix metalloproteinase circulating levels,genetic polymorphisms,and susceptibility to acute myocardial infarction among patients with coronary artery disease[J].Am Heart J,2007,154:1043-1051.
[4]Hutchinson KR,Stewart JA,Lucchesi PA.Extracellular matrix remodeling during the progression of volume overload-induced heart failure[J].J Mol Cell Cardiol,2010,48:564-569.
[5]Zhou S,Feely J,Spiers JP,et al.Matrix metalloproteinase-9 polymorphism contributes to blood pressure and arterial stiffness in essential hypertension[J].J Hum Hypertens,2007,21:861 -867.
[6]Kai H,Ikeda H,Yasukawa H,et al.Peripheral blood levels of matrix metalloproteases-2 and-9 are elevated in patients with acute coronary syndromes[J].J Am Coll Cardiol,1998,32:368 -372.
[7] Blankenberg S,Rupprecht HJ,Poirier O,et al.Plasma concentrations and genetic variation of matrix metalloproteinase 9 and prognosis of patients with cardiovascular disease[J].Circulation,2003,107:1579 -1585.
[8]Hirose Y,Chiba K,Karasugi T,et al.A functional polymorphism in THBS2 that affects alternative splicing and MMP binding is associated with lumbar-disc herniation[J].Am J Hum Genet,2008,82:1122 -1129.
[9]Natividad A,Cooke G,Holland MJ,et al.A coding polymorphism in matrix metalloproteinase 9 reduces risk of scarring sequelae of ocular Chlamydia trachomatis infection[J].BMC Med Genet,2006,7:40.doi:10.1186/1471-2350-7-40.
[10]Zhi H,Wang H,Ren L,et al.Functional polymorphisms of matrix metallopeptidase-9 and risk of coronary artery disease in a Chinese population[J].Mol Biol Rep,2010,37:13-20.
[11]Wu N,Lu X,Hua Y,et al.Haplotype analysis of the stromelysin-1(MMP3)and gelatinase B(MMP9)genes in relation to coronary heart disease[J].Ann Hum Genet,2009,73:404-410.
[12]Nanni S,Melandri G,Hanemaaijer R,et al.Matrix metalloproteinases in premature coronary atherosclerosis:influence of inhibitors,inflammation,and genetic polymorphisms[J].Transl Re,2007,149:137 -144.
[13]Morgan AR,Zhang B,Tapper W,et al.Haplotypic analysis of the MMP-9gene in relation to coronary artery disease[J].J Mol Med(Berl),2003,81:321 -326.
[14]Kim JS,Park HY,Kwon JH,et al.The roles of stromelysin-1 and the gelatinase B gene polymorphism in stable angina[J].Yonsei Med J,2002,43:473 -481.

