bFGF和EGF诱导大鼠骨髓间充质干细胞分化成神经样细胞
何丁文,殷嫦嫦,顾玉荣,陈伟才,矢庆明,殷 明*
(南昌大学1.第二附属医院骨一科;2.研究生院医学部,江西南昌330006;3.九江学院分析与检测实验室,江西九江332000)
周围神经因自我修复能力差,损伤后常导致感觉、运动功能损害甚至残疾,给社会和家庭带来巨大损失和沉重的经济负担,已成为全球所面临的严峻健康问题之一[1],细胞移植治愈为治愈周围神经损伤提供了可能。胚胎干细胞、神经干细胞等一直被认为是移植治疗神经疾病的首选细胞,但其来源及伦理道德限制了其大规模应用[2]。近期研究发现骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有强大的自我增殖能力和多向分化潜能,不仅可向成骨细胞、成软骨、成脂肪细胞分化,在特定条件下还可向神经元样细胞、星形胶质样细胞和少突胶质样细胞分化[3],被作为周围神经组织工程的重点种子细胞进行研究。本研究应用bFGF和EGF体外诱导大鼠BMSCs向神经样细胞分化,探讨其向神经分化潜能及联合诱导优势,为BMSCs移植治疗周围神经疾患提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物:清洁级4周龄SD大鼠4只,雌雄不限,合格证号:HNASLKJ20122049。
1.1.2 主要试剂:DMEM/F-12(Hyclone公司),胎牛血清(FBS,Gibco公司),胰蛋白酶、琼脂糖、甘氨酸、SDS、TRIS(Solarbio 公司),CD90-FITC、CD45-FITC单抗(eBioscience公司),碱性成纤维生长因子(bFGF)、表皮生长因子(EGF)、兔抗大鼠胶质纤维酸性蛋白(GFAP)、甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(Peprotech公司),兔抗神经元特异性烯醇化酶(NSE)多克隆抗体(PL Laboratories公司),辣根过氧化物酶标记的山羊抗兔二抗、高灵敏度化学发光检测试剂盒、HiFi-MMLV cDNA第一链合成试剂盒(北京康为世纪生物科技有限公司),预染彩虹蛋白Marker(Fermentas公司),总蛋白提取试剂盒(普利莱基因技术有限公司),GREENspin组织/细胞RNA快速提取试剂盒(北京庄盟国际生物基因科技有限公司),PCR试剂盒、DNA Marker(北京全式金生物技术有限公司)。
1.2 方法
1.2.1 BMSCs的分离、纯化和鉴定:全骨髓贴壁法分离BMSCs。P3代BMSCs常规消化离心后PBS重悬至细胞浓度为1×107/mL,100 μL每管分装于EP管中,分别加入 CD90-FITC、CD45-FITC 单抗5 μL,室温避光孵育30 min后流式细胞仪检测。
1.2.2 BMSCs的诱导:P3代 BMSCs消化后按1.5×105/mL接种至6孔板,24 h后更换成含1%FBS的DMEM/F-12培养液:1)对照组:不加生长因子;2)EGF组:添加20 ng/mL EGF;3)bFGF组:添加20 ng/mL bFGF;4)EGF+bFGF组:添加20 ng/mL EGF和bFGF。倒置相差显微镜观察并拍照。
1.2.3 Western blot检测NSE、GFAP蛋白表达水平:诱导7 d后,按细胞总蛋白提取试剂盒提取各组细胞总蛋白,制备 SDS-PAGE 凝胶后上样30 μg,70~120 V恒压电泳,250 mA恒流转膜70 min,5% ~20%脱脂牛奶封闭2~4 h,4℃孵育一抗 NSE抗体(1∶100)、GFAP 抗 体 (1∶1 000)及 GAPDH 抗 体(1∶2 000)过夜,洗膜,孵育二抗(1∶4 000),显影、定影,用Image J吸光度分析软件对蛋白条带进行分析。
1.2.4 RT-PCR检测NSE、GFAP mRNA表达水平:诱导7 d后,按RNA快速提取说明书提取各组细胞总RNA,按说明书进行反转录和扩增后电泳,凝胶成像系统照相,Image J软件分析,结果以 NSE区带/GAPDH区带的相对吸光度值和GFAP区带/GAPDH区带的相对吸光度值表示,引物由南京金斯瑞生物科技有限公司合成(表1)。
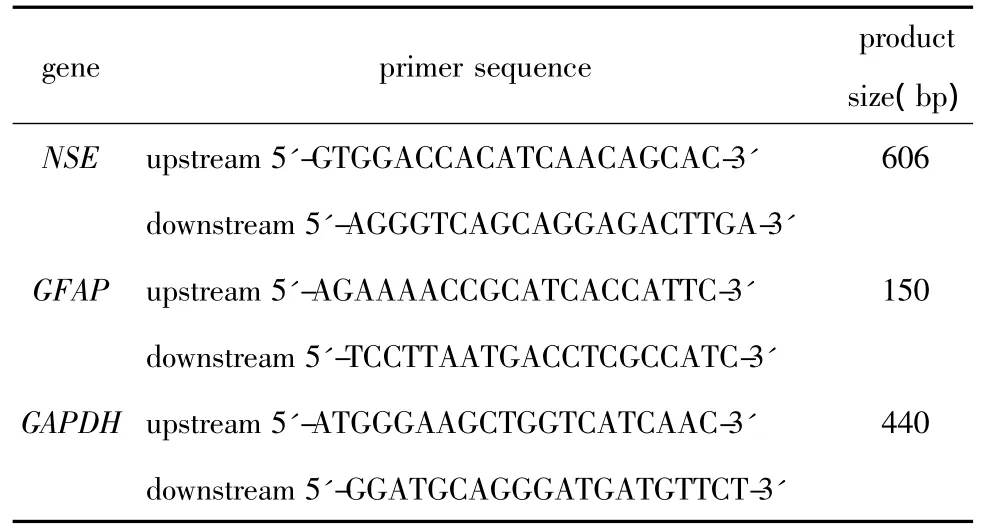
表1 RT-PCR引物序列及产物大小Table 1 RT-PCR primer sequence of target gene and product size
1.3 统计学分析
用SPSS19.0统计软件进行数据分析,数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用t检验。
2 结果
2.1 大鼠BMSCs分离、纯化及鉴定
原代培养9~12 d左右可达80% ~90%汇合(图1A),P3代BMSCs呈典型的长梭形或扁平形,紧密漩涡样排列(图1B)。细胞表面骨髓基质标志CD90高达 98.72%,而造血细胞标志 CD45仅1.05%(图2)。
2.2 BMSCs神经分化后形态学观察
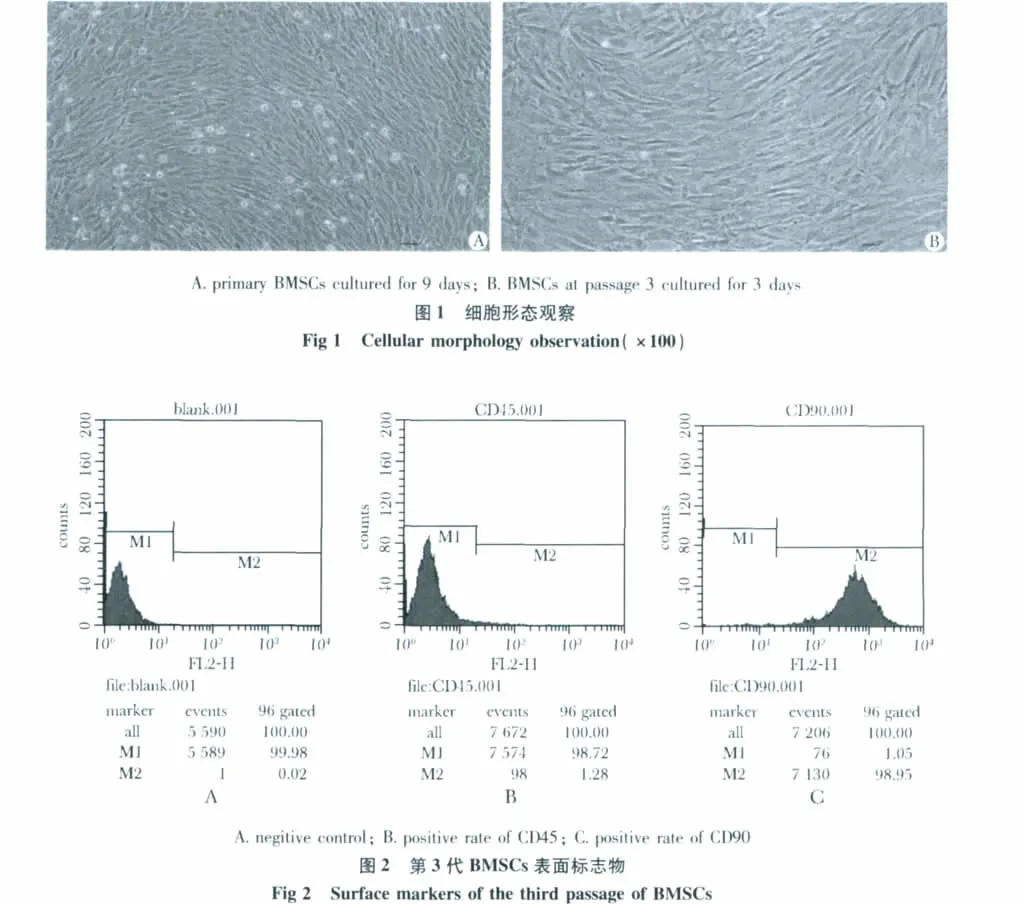
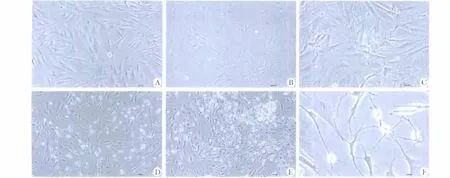
图3 bFGF和EGF诱导后BMSCs形态变化Fig 3 BMSCs morphological changes induced by bFGF and EGF
EGF、bFGF及EGF+bFGF组诱导3 d后部分细胞体积变小,立体感增强(图3A);7 d后bFGF和EGF+bFGF组细胞折光性增强,胞体为圆形或椭圆形,见简单的双极和复杂的多极细胞,向周围伸出突起并分支,呈典型的神经元样细胞形态(图3D、E),相邻的突起间存在连接(图3F),EGF组仅见简单的双极、三极细胞(图3C),而对照组罕见类似细胞(图3B)。
2.3 Western blot检测结果
EGF组、bFGF组和 EGF+bFGF组 NSE、GFAP蛋白表达高于对照组,bFGF组和EGF+bFGF组高于EGF组,且EGF组高于空白对照组,EGF+bFGF组高于bFGF组(P<0.05)(图4,表2)。
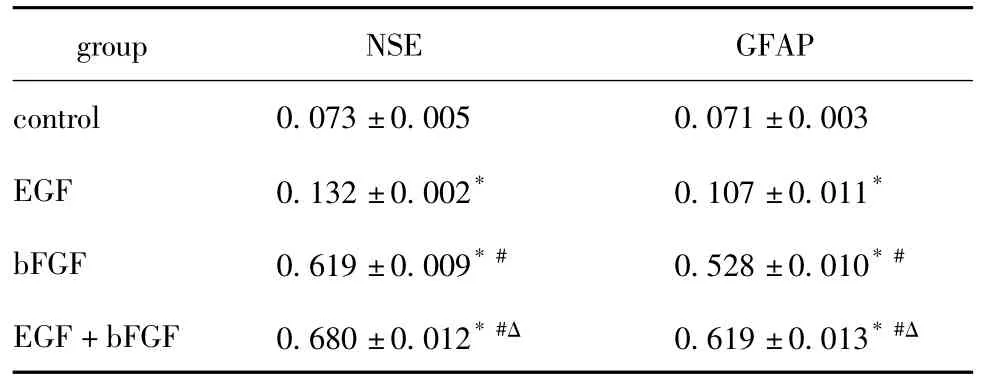
表2 诱导7 d各组NSE和GFAP蛋白相对表达水平Table 2 Relative expression of NSE and GFAP collagens in each group at 7 days after induction(x ± s,n=3)
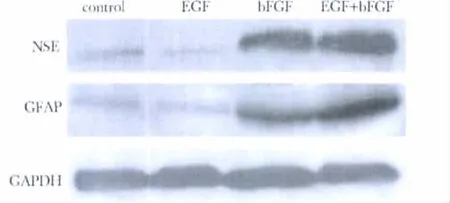
图4 bFGF和EGF对骨髓间充质干细胞NSE和GFAP蛋白表达的影响Fig 4 Electrophoresis of NSE and GFAP proteins expression in bone marrow mesenchymal stem cells induced by bFGF and EGF
2.4 RT-PCR检测结果
NSE、GFAP在 EGF组、bFGF组和 EGF+bFGF组均高于对照组,bFGF组和 EGF+bFGF组高于EGF组,且EGF组高于对照组(P<0.05);EGF+bFGF组NSE高于bFGF组(P<0.05);EGF+bFGF组GFAP与bFGF组无明显差异(图5)。
3 讨论
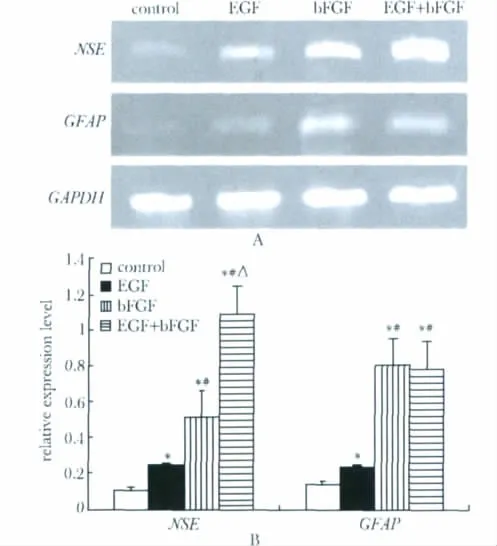
图5 bFGF和EGF对骨髓间充质干细胞NSE和GFAP mRNA表达的影响Fig 5 NSE and GFAP mRNA expression in bone marrow mesenchymal stem cells induced by bFGF and EGF
BMSCs是一类未分化的具有多向分化潜能的成体干细胞,在特定条件下可向神经表型分化[3],目前常用的神经定向诱导剂主要为抗氧化剂和生长因子[4],在各种诱导方法中化学诱导法分化快,但细胞坏死较多,细胞生长状态差于生长因子诱导法[5],生长因子中bFGF、EGF的研究最多且应用最广泛,bFGF在胚胎期和成年期的中枢和周围神经系统发育中均有表达,维持神经元和神经胶质细胞的存活,促进交感和副交感神经元的轴突生长,能促进损伤神经的修复和突起生长[6];bFGF是肾上腺嗜铬细胞瘤细胞-12(Adrenal pheochromocytoma cells-12,PC12)神经突起延伸、人NPCs神经再生及诱导神经细胞分化的重要生长因子[7]。EGF在神经系统中可促进神经元轴突的延长和维持神经元的存活,具有丝裂原样作用,可促进 BMSCs分化增殖[8]。bFGF、EGF对神经前体细胞增殖具有协同作用[9],对胚胎源性神经干细胞在分化方向上的作用有明显差异,bFGF干预后的子代细胞大多数表达神经元特异性抗原标记NSE、微管相关蛋白2(mirotubulin-associated protein 2,MAP2)等[7],而 EGF 作用的子代细胞大多数为胶质样细胞[10],联合作用时以成神经元样细胞为主,对BMSCs的诱导可得到上述相同结果[11]。这些研究结果表明生长因子的作用取决于作用的细胞类型、细胞分化阶段及其辅助因子[7]。在神经系统中NSE为成熟神经元特异性标志物[13],GFAP 为星形胶质细胞的特异性标志物[14]。本研究应用bFGF和EGF诱导BMSCs成神经分化,细胞形态呈典型的神经元样细胞形态,部分相邻的突起间存在连接,尤以EGF+bFGF组最为显著。诱导后bFGF组和EGF+bFGF组NSE和GFAP蛋白及其mRNA显著高于EGF组,且EGF+bFGF组NSE蛋白和mRNA表达量最高。从蛋白及mRNA水平发现对照组 BMSCs也表达 NSE、GFAP,说明BMSCs具有表达神经和胶质细胞标志物的能力。
bFGF和EGF可促进大鼠BMSCs向神经细胞分化,联合应用时效果最显著,但各组所得神经元和星形胶质细胞比例不同,且bFGF诱导BMSCs向神经分化的能力强于EGF。另外,尽管本实验从细胞形态、特异性标志及mRNA方面证明了神经细胞的形成,但所得细胞是否存在功能不能完全依赖于此,如细胞之间的连接是否为突触联系、相连的神经突起中是否有释放神经递质的突触小泡及神经元样细胞是否有神经电位等问题均需进一步研究证明。
[1]Schohz T,Krichevsky A,Sumarto A,et al.Peripheral nerve injuries:an international survey of current treatments and future perspectives [J].J Reconstr Micresurg,2009,25:339-344.
[2]Petros TJ,Tyson JA,Anderson SA.Pluripotent stem cells for the study of CNS development[J].Front Mol Neurosci,2011,4:30.
[3]Ma K,Fox L,Shi G,Generation of neural stem cell-like cells from bone marrow-derived human mesenchymal stem cells[J].Neurol Res,2011,33:1083 -1093.
[4]Scuteri A,Miloso M,Foudah D,et al.Mesenchymal stem cells neuronal differentiation ability:a real perspective for nervous system repair[J].Curr Stem Cell Res Ther,2011,6:82-92.
[5]Rismanchi N,Floyd CL,Berman RF,et al.Cell death and long-term maintenance of neuron-like state after differentiation of rat bone marrow stromal cells:a comparison of protocols[J].Brain Res,2003,991:46 -55.
[6]Tobin JE,Xie M,Le TQ,et al.Reduced axonopathy and enhanced remyelination after chronic demyelination in fibroblast growth factor 2(Fgf2)-null mice:differential detection with diffusion tensor imaging[J].J Neuropathol Exp Neurol,2011,70:157 -165.
[7]Lam HJ,Patel S,Wang A,et al.In vitro regulation of neural differentiation and axon growth by growth factors and bioactive nanofibers[J].Tissue Eng Part A,2010,16:2641-2648.
[8] Sanchez-Ramos J,Song S,Cardozo-Pelaez F,et al.Adult Bone marrow stromal cells differentiate into neural cells in vitro[J].Exp Neurology,2000,164:247 - 256.
[9]Tamama R,Fan VH,Griffith LG,et al.Epidermal growth factor as a candidate for ex vivo expansion of bone marroederived mesenchymal stem cells[J].Stem Cells,2006,24:686-695.
[10]Sanalkumar R,Vidyanand S,Lalitha Indulekha C,et al.Neuronal vs.Glial fate of embryonic stem cell-derived neural progenitors(ES-NPs)is determined by FGF2/EGF during proliferation[J].J Mol Neurosci,2010,42:17 -27.
[11]Wu XJ,Wei MF,Chai CW,et al.Expression of glial cell line-derived neurotrophic factor during differentiation of rat bone marrow stromal cells into nerve cells[J].J Appl Clin Pediatr,2009,24:1806 -1808.
[12]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neurosci Res,2000,61:364 -370.
[13]Tao H,Rao R,Ma DD.Cytokine-induced stable neuronal differentiation of human bone marrow mesenchymal stem cells in a serum/feeder cell-free condition[J].Dev Growth Differ,2005,47:423-433.

