顺磁性铁纳米粒促进人淋巴细胞对乳腺癌细胞的体外杀伤
张 亮,孙 昭,段金虹,熊 非,张 宇,顾 宁,许海燕,杨先达*
(1.中国医学科学院基础医学研究所,北京100005;2.北京协和医院肿瘤内科,北京100730;3.东南大学生物科学与医学工程学院,南京210009)
乳腺癌是严重威胁女性健康的常见肿瘤,其治疗除手术、放疗和化疗以外,抗肿瘤免疫疗法也是十分重要的治疗手段[1-2]。免疫治疗有可能激发患者自身的免疫系统产生针对肿瘤的免疫反应,因而极有利于清除患者体内的肿瘤细胞。与传统化疗相比,免疫疗法具有不良反应低、患者耐受性好等优点,并能在一定程度上改善患者的预后[3-4]。现阶段抗肿瘤免疫治疗的主要问题在于其疗效往往有限,迫切需要进一步的提升。已有研究显示纳米科技有可能提升抗肿瘤免疫反应[5],但迄今为止铁纳米材料对抗肿瘤免疫的影响尚无研究报道。鉴于铁是身体必需元素[6],生物相容性较好,因而研究铁纳米材料对抗肿瘤免疫的调节作用具有较为重要的医学意义。本研究将磁性铁纳米颗粒与肿瘤裂解蛋白相连接,用于体外刺激人外周血单个核细胞(PBMC),并评估了PBMC对MCF-7乳腺癌细胞的体外杀伤作用。
1 材料与方法
1.1 材料与试剂
顺磁性氧化铁纳米颗粒(东南大学顾宁教授实验室制备并提供)。健康人外周血(志愿者提供),人乳腺癌细胞MCF-7(中国医学科学院细胞中心),RPMI 1640培养基(Gibco公司),胎牛血清(HyClone公司),BCA蛋白测定试剂盒(北京康润生物公司),MTS试剂(Promega公司),Ficoll淋巴细胞分离液(天津灏洋生物公司)。
1.2 纳米粒子的理化性质表征
取纳米铁悬液或连接有肿瘤裂解蛋白的纳米铁悬液,滴入扫描电镜的样品台上,待其自然干燥后溅射以镀金膜,在扫描电镜下观察形貌。采用动态光散射法测定了粒子的大小及分布。
1.3 外周血单个核细胞的分离与体外培养
采集健康志愿者外周血20 mL,肝素抗凝。与D-Hanks液1∶1混合均匀,加入到等体积的淋巴细胞分离液上,离心20 min,吸取淋巴细胞层,加入2倍体积的 D-Hanks,离心10 min。重悬细胞沉淀,用D-Hanks洗2次,用含10%血清的RPMI1640重悬细胞,记数备用。
1.4 MCF-7肿瘤细胞裂解蛋白的提取
收集MCF-7细胞并用PBS液洗2次,离心弃上清收集细胞沉淀,加入按1∶100的比例稀释的蛋白酶抑制剂,充分混匀后反复冻融数次,在4℃离心;收集上清,少量用于BCA法测蛋白浓度;其余-80℃保存备用。
1.5 纳米铁与MCF-7细胞裂解蛋白的连接
将纳米铁与MCF-7裂解蛋白按质量比1∶1混合,加 入 偶 联 剂 EDC(8 mg/mL)和 NHS(1.15 mg/mL),37℃振荡反应45 min,用强力磁铁分离2 h,收集沉淀备用;并取上清液测蛋白含量,计算连接效率。
1.6 PBMC对肿瘤细胞的杀伤
制备不同浓度(0.1、1和10 mg/L)的纳米铁溶液、肿瘤裂解蛋白溶液、纳米铁-裂解蛋白溶液,将PBMC分别与上述3种不同浓度的溶液共孵育3d,收集刺激后的PBMC,与MCF-7肿瘤细胞按20∶1的效靶比例共孵育3 d,用MTS试剂检测肿瘤细胞存活状况。PBMC对肿瘤细胞的杀伤率=[1-(实验孔读数-空白孔读数)/(阳性对照孔读数-空白孔读数)]×100%。
1.7 纳米铁对肿瘤细胞的杀伤
将不同浓度(0.1、1、10和100 mg/L)的纳米铁溶液,分别与一定量的 MCF-7细胞共孵育3 d后,用MTS试剂检测肿瘤细胞存活率。
1.8 统计学分析
实验数据采用SPSS 12.0软件进行统计分析,数据以均数±标准差(±s)表示,组间比较采用独立样本t检验。
2 结果
2.1 纳米铁-蛋白复合物的制备及理化表征
纳米铁与肿瘤蛋白的共价连接过程如图1A所示。连接前扫描电镜(图1B)与粒径测定结果(图1D)均显示纳米铁的粒径较小(均值128 nm),而连接后扫描电镜(图1C)和粒径测定结果(图1E)均显示颗粒粒径有显著增加(均值230 nm)。
2.2 PBMC对靶细胞的杀伤
与1和10 mg/L的纳米铁-肿瘤蛋白共孵育后,PBMC对MCF-7的杀伤率分别能够达到54%和44%,比单独使用肿瘤裂解蛋白时的杀伤率(15%和24%)有显著提升(P<0.05);而0.1 mg/L的纳米铁-肿瘤蛋白复合物没能提升PBMC对靶细胞的杀伤(图2)。
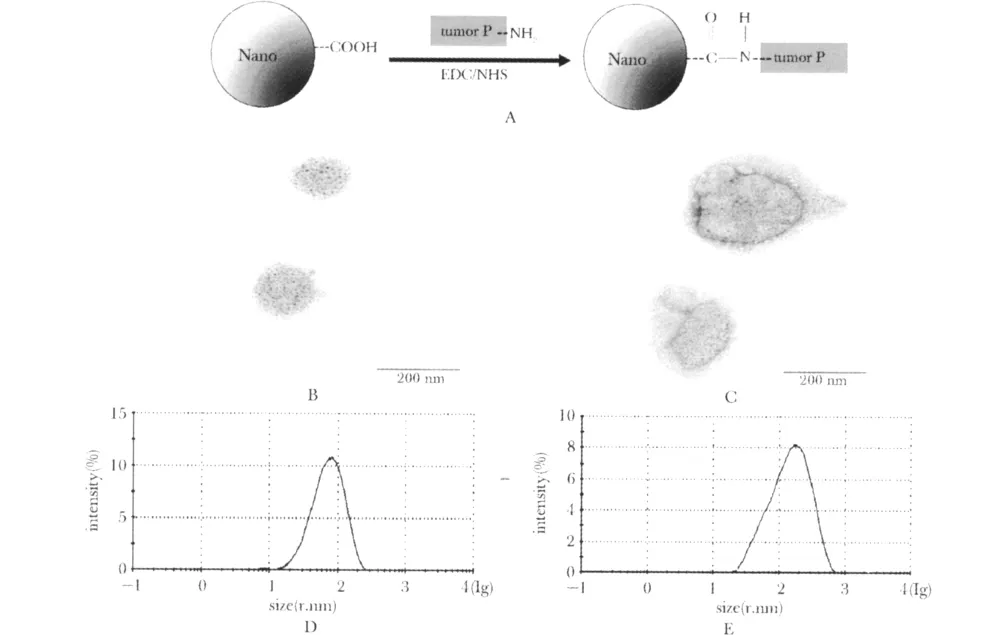
图1 纳米铁与蛋白的连接示意图(A)及其连接前后的尺度表征(B-D)Fig 1 The schematic drawing and the character of the conjugation between iron nanoparticle and tumor lysate protein
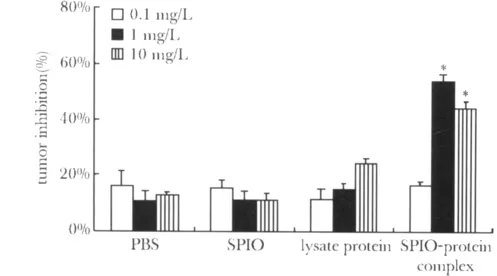
图2 与纳米铁、肿瘤蛋白、纳米铁-肿瘤蛋白共孵育后的PBMC对MCF-7的杀伤作用Fig 2 Anti-tumor cytotoxicity generatated by PBMC that had been exposed to SPIO,lysate protein,or SPIO-protein complex(x ± s,n=6)
2.3 纳米铁材料自身对靶细胞的影响
0.1、1、10 和100 mg/L的纳米铁溶液均对MCF-7的存活没有显著影响,与对照组相比无显著差异(图3)。
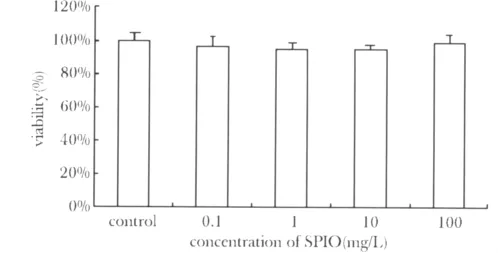
图3 不同浓度的纳米铁与MCF-7细胞共孵育72 h后的细胞存活率Fig 3 Viability of MCF-7 cells 72 hours after coincubation with SPIO of various concentrations(x ± s,n=6)
3 讨论
抗肿瘤免疫治疗有助于清除术后体内残存的肿瘤细胞并改善预后,是一种重要的癌症辅助治疗手段。该疗法目前所面临的主要问题是已有肿瘤抗原的免疫原性一般较低,所激发的免疫反应迫切需要提升。纳米科技为解决这一问题提供了全新的技术手段。纳米材料具备体积小、表面积大、可穿透各种生物屏障等性质[7],能够将肿瘤抗原带入到免疫细胞内,从而引发更强的抗肿瘤免疫反应。以往的研究发现,碳纳米管等纳米材料能够使树突状细胞吞噬更多的肿瘤抗原,并增强淋巴细胞对肿瘤细胞的杀伤[8-9]。为切实促进纳米科技在抗肿瘤免疫方面的临床应用,目前极有必要研究低毒纳米材料的免疫调节作用[10]。铁是人体内一种必需的元素,铁纳米材料因此具有较好的生物安全性,并已应用于胶质瘤治疗[11]和体内示踪[12]等领域。然而目前铁纳米材料对于抗肿瘤免疫的调节作用尚未见文献报道,因此我们研究了铁纳米颗粒是否可调节PBMC对MCF-7人乳腺癌细胞的免疫杀伤。
本研究所采用的纳米铁材料是一种平均粒径在128 nm左右的粒子,其表面具有羧基基团(-COOH),可以与肿瘤裂解蛋白表面的氨基基团(-NH2)共价连接,形成平均粒径在230 nm左右的纳米颗粒(图1)。在PBMC对MCF7肿瘤细胞的杀伤试验中,该研究发现一定浓度的纳米铁-肿瘤蛋白的复合物能够显著提升PBMC对肿瘤细胞的杀伤(图2),推测这一现象可能是因为纳米铁能将更多地肿瘤抗原带入到树突状细胞,提升肿瘤抗原的递呈,从而促进免疫细胞对肿瘤细胞的杀伤。此外,该研究观察到铁纳米粒自身对MCF-7细胞没有显著的杀伤作用(图3),从而提示纳米铁-肿瘤蛋白复合物的作用主要是通过免疫机制来实现的,而并非是出于纳米铁本身对靶细胞的毒性。
综上所述,本研究将纳米铁与肿瘤细胞裂解蛋白共价连接,构建了纳米铁-肿瘤蛋白的复合物,并发现该复合物能够显著提升PBMC对MCF-7人乳腺癌细胞的杀伤,且排除了纳米铁本身对MCF-7细胞的直接杀伤作用。该结果提示,纳米铁有可能在针对人乳腺肿瘤的免疫治疗中具有潜在的应用价值。
[1]Vermorken JB,Claessen AM,van Tinteren H,et al.Active specific immunotherapy for stage II and stage III human colon cancer:a randomised trial[J].Lancet,1999,353:345 -350.
[2]Takayama T,Sekine T,Makuuchi M,et al.Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma:a randomised trial[J].Lancet,2000,356:802-807.
[3]Berd D,Sato T,Maguire HC Jr,et al.Immunopharmacologic analysis of an autologous,hapten-modified human melanoma vaccine[J].J Clin Oncol,2004,22:403 -415.
[4]Yu JS,Liu G,Ying H,et al.Vaccination with tumor lysatepulsed dendritic cells elicits antigen-specific,cytotoxic T-cells in patients with malignant glioma[J].Cancer Res,2004,64:4973 -4979.
[5]应景艳.紫杉醇PLGA纳米粒注射剂对小鼠肺转移黑色素瘤的治疗作用[J].医药导报,2012,31:839 -843.
[6]Corem-Salkmon E.Design of near-infrared fluorescent bioactive conjugated functional iron oxide nanoparticles for optical detection of colon cancer[J].Int J Nanomedicine,2012,7:5517 -5527.
[7]Chouhan R,Bajpai A.Real time in vitro studies of doxorubicin release from PHEMA nanoparticles[J].J Nanobiotechnol,2009,7:5 -16.
[8]Sun Z,Wang W.Multi-walled carbon nanotubes conjugated to tumor protein enhance the uptake of tumor antigens by human dendritic cells in vitro[J].Cell Res,2010,20:1170-1173.
[9]Meng J.Carbon nanotubes conjugated to tumor lysate protein enhance the efficacy of an antitumor immunotherapy[J].Small,2008,4:1364 -1370.
[10] Liu Y.Understanding the Toxicity of Carbon Nanotubes[J].Acc Chem Res,2012,Epub ahead of print.doi:10.1021/ar300028m
[11]张建超,杨天明.磁性纳米铁治疗大鼠胶质瘤的实验研究[J].东南大学学报,2010,29:254 -259.
[12]Tavaré R,Sagoo P,Varama G,et al.Monitoring of in vivo function of superparamagnetic iron oxide labelled murine dendritic cells during anti-tumour vaccination[J].PloS One,2011,6:e19662.

