组织工程化软骨对兔膝关节全层软骨缺损的修复效果
郝永壮,张宇明,苏云星,宋洁富,常保国,王小健,刘建荣,秦 琴(山西省人民医院急诊科,太原
关节软骨缺乏血管、神经分布,其损伤后自身修 复能力有限,目前尚无结构、成分、生物学特性与正常软骨类似的软骨缺损修复组织。因此修复关节软骨缺损仍是临床上的难题之一。目前临床上运用的多种软骨修复方法,如软骨下骨钻孔术、微骨折术、骨膜移植术等,多以纤维样修复为主。近几年来,三维立体生物修复材料的研制及细胞培养技术的提高为软骨组织工程修复的临床应用展示了广阔的前景。之前已经有人用过海藻酸钠[1]、去端肽胶原[2]、Plruonic F127[3]、聚乙醇酸-乳酸共聚物(PLGA)[4]等支架材料作为载体,复合软骨细胞或者骨髓间充质干细胞修复关节软骨缺损,并取得了一定的研究成果。目前,同种异体软骨细胞复合人胎盘Ⅰ型胶原蛋白海绵是否能达到软骨缺损的透明样软骨修复,尚未见文献报道。本研究就是探讨该复合物修复膝关节软骨缺损的可行性,为组织工程化软骨在临床修复软骨缺损提供一条新的途径。
1 材料和方法
1.1 实验材料
2周龄新西兰兔1只,8月龄54只,由山西省畜牧养殖中心提供。Pronase酶、Ⅱ型胶原酶、Dispase酶购自美国Sigma公司,DMEM-F12培养液购自美国Hyclone公司,胎牛血清购自杭州四季青公司。Ⅱ型胶原单克隆抗体(鼠抗兔)和二抗(羊抗鼠)购自德国Merke公司。人胎盘Ⅰ型胶原蛋白海绵购自上海其胜制剂实业公司。
1.2实验方法
1.2.1 软骨细胞培养和传代 锐刀刮取2周龄乳兔关节软骨,加入0.4%Pronase酶,在37℃ CO2培养箱消化90 min后,加入0.025%Ⅱ型胶原酶消化过夜得到原代软骨细胞,计数、离心、接种,并体外培养约两周至第2代。
1.2.2 软骨细胞与支架材料的结合 将人胎盘Ⅰ型胶原蛋白海绵用角膜环钻做成直径约4 mm的圆形小块后酒精浸泡过夜,无菌 PBS冲洗3次,15 min/次,然后于24孔培养板中DMEM浸泡过夜。选择生长状态良好的第2代软骨细胞,计数,台盼蓝染色保证细胞存活率≥80%,加入DMEM液配制成浓度为1.2×107个/ml,与制作好的蛋白海绵小圆块复合,置入37℃、5%CO2、饱和湿度的培养箱培养8 h。
1.2.3 动物模型制备 取雄性八月龄新西兰兔54只,体重4.0-4.5 kg,平均 4.28 kg,随机分为3 组,每组18只。首先用3%戊巴比妥钠(1ml/kg)静脉注射麻醉,常规消毒,铺无菌巾,以髌骨中点为中心,沿膝外侧缘做纵行切口约5 cm,逐层切开。将髌骨向内侧牵拉显露股骨髁,于股骨髁间窝以直径3.8 mm牙科电钻做一深约2 mm的全层软骨缺损模型。实验组分别植入软骨细胞、软骨细胞+支架材料复合物后,缝合周围骨膜覆盖缺口。对照组于软骨缺损处单纯缝合周围骨膜覆盖缺口。术区无菌生理盐水充分冲洗后,髌骨复位,逐层缝合关节囊、皮下组织及皮肤。术后膝关节不固定,置兔笼养,允许其自由活动。
1.2.4 大体观察 分别于术后12,24,36周每组各处死6只动物,取出手术区域组织,观察缺损区修复情况。
1.2.5 组织形态学观察 将标本于甲醛液中固定,EDTA脱钙,梯度乙醇脱水,二甲苯透明,石蜡包埋切片(5 μm)后行HE染色、甲苯胺蓝及Ⅱ型胶原免疫组化染色观察。
1.2.6 主要观察指标 各组膝关节股骨端标本大体及组织学观察结果。
2 结果
2.1 大体观察
对照组:12周时修复组织为纤维样修复,表面欠光滑,光泽差,缺损区部分凹陷。24周时仍为纤维样修复,可见有空洞形成,与正常软骨界限清楚。36周时修复区呈退行性改变,空洞直径变大,与正常组织界限明显,周围关节软骨亦呈退行性改变。
软骨细胞组:术后12周缺损区部分填充,修复组织呈半透明乳白色,结构相对粗糙,可见多数针尖样结构,与周围软骨界限明显。24周,缺损区表面光滑,可见较多白色组织形成,透明度较前降低,呈半软骨半纤维样结构,与周围软骨结合较好,但仍存在部分缺损未修复。36周,缺损区已完全填充,填充组织与正常软骨相比,色泽稍偏黄,透明度较前更低,呈纤维样结构。
软骨细胞+支架材料组:术后12周修复组织多与软骨面平,缺损区表面相对光滑,但不完整,色泽不均。部分修复区轮廓模糊不清,部分界限可见。24周,缺损区可见较明显的半透明白色组织覆盖,表面较光滑,有一定光泽,与周围正常软骨有较好吻合。36周,缺损区修复组织类似于正常的透明关节软骨,呈淡蓝色,表面光滑有光泽,与周围软骨连接紧密(图1)。
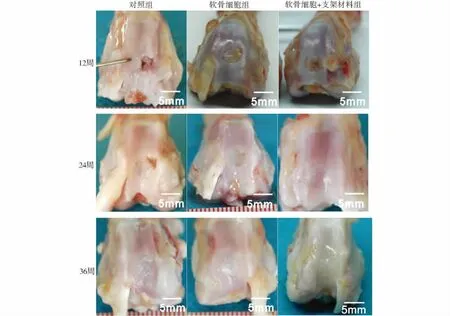
图1 不同组别在不同时间的大体观察Figure 1 Gross specimen at different time in three groups
2.2 组织形态学观察
对照组:12周时修复区可见纤维组织填充,组织中含少量纤维样细胞,深层有少量再生软骨组织,形态凹陷且不规则,HE染色可见到不同于周围正常软骨的新生组织,蛋白多糖沉积较少,Ⅱ型胶原染色可见少量黄染颗粒(图2)。24周时修复区呈纤维软骨修复,表层不平整,呈虫蚀样改变,修复组织中细胞较少,周围软骨退变明显。缺损处甲苯胺蓝及免疫组化染色未见明显的蛋白多糖和Ⅱ型胶原沉积(图3)。36周时可见缺损处表层组织不完整,更多空洞形成,HE染色表明新生组织由纤维样细胞组成,有少量的蛋白多糖分泌,Ⅱ型胶原表达阴性,黄染出现很少(图4,见封3)。
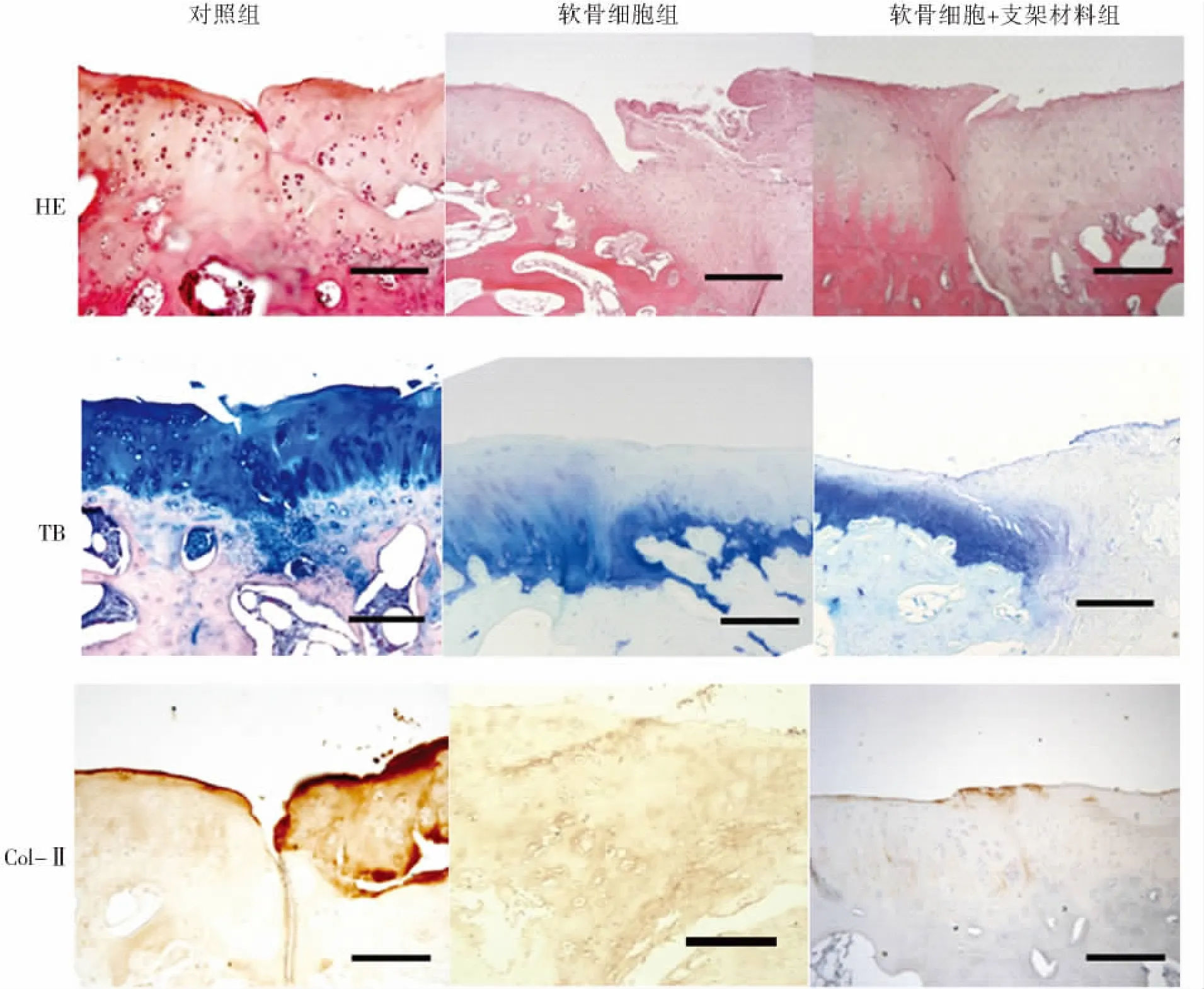
图2 不同组别术后12周组织切片染色 (bar=100 μm)Figure 2 Histomorphology of cartilage tissues in defects at week 12 after surgery in three groups (bar=100 μm)
软骨细胞组:12周时缺损区部分填充,新生软骨呈边缘不规则的小蜂窝状结构,软骨细胞周围可见软骨陷窝形成。HE染色可见软骨细胞呈椭圆形,排列不规整。甲苯胺蓝及免疫组化染色提示新生软骨细胞可表达少量蛋白多糖及Ⅱ型胶原(图2)。24周时缺损区相对平整,新生组织由不典型软骨细胞及多角形纤维样细胞组成,横向排列,未见软骨陷窝。甲苯胺蓝染色可见新生软骨细胞被染成棕红色,周围可见甲苯胺蓝变色反应的软骨基质,细胞分布也较不均匀。免疫组化染色可见胞内少量黄褐色颗粒,说明新生组织表达蛋白多糖及Ⅱ型胶原进一步减少(图3)。36周时,缺损区除少量未修复外,大部由纤维组织填充,组织中含大量纤维样细胞,HE染色表明修复组织为与周围正常软骨组织异源性的组织,甲苯胺蓝及免疫组化染色表明修复区无蛋白多糖及Ⅱ型胶原沉积(图4,见封3)。

图3 不同组别术后24周组织切片染色 (bar=100 μm)Figure 3 Histomorphology of cartilage tissues in defects at week 24 after surgery in three groups (bar=100 μm)
软骨细胞+支架材料组:12周时缺损处相对平整,有部分软骨陷窝形成以及分布不均的类软骨样细胞。HE染色可见修复组织为与周围组织同源的正常组织。甲苯胺蓝染色可见修复区有一定量的蛋白多糖沉积。Ⅱ型胶原表达呈弱阳性,黄染细胞不多,出现少量黄褐色颗粒(图2)。24周时新生软骨层更加规整,表层软骨细胞呈扁平状,横向排列,深层软骨细胞多呈圆形放射状排列,可见软骨陷窝形成。移植物与缺损底部直接接触的区域由于发生了骨化而成为软骨下骨,然而新生软骨层与正常软骨层相比厚度较薄,且与临近正常软骨间多存在裂隙,无完整的潮线形成。甲苯胺蓝染色着色较深提示有更多的蛋白多糖沉积,免疫组织化学染色可见较多黄褐色颗粒,说明基质中有更多的 II型胶原生成(图3)。36周时修复区细胞排列接近正常透明软骨组织,表层完整光滑,可见软骨细胞呈典型球形放射状排列,并形成软骨陷窝,与邻近正常软骨组织愈合良好。软骨下骨进一步增多,可见完整潮线形成。甲苯胺蓝染色表明缺损处有大量的蛋白多糖沉积,细胞中及细胞外基质Ⅱ型胶原表达阳性,出现大量黄褐色或棕黄色颗粒(图4)。

图4 不同组别术后36周组织切片染色 (bar=100 μm)Figure 4 Histomorphology of cartilage tissues in defects at week 36 after surgery in three groups (bar=100 μm)
3 讨论
关节软骨损伤后的修复一直是骨科临床研究的热点。研究表明,单层培养的软骨细胞有去分化倾向,易形成纤维组织并丧失聚集细胞外基质的能力[5-7],并且随着关节运动植入的细胞有可能溢出缺损区,因而有学者开始利用组织工程学的方法修复关节软骨损伤。
运用组织工程方法修复关节软骨损伤,主要涉及以下几个方面:种子细胞、支架材料和细胞因子。种子细胞可以是自体或异体来源的软骨细胞以及骨髓间充质干细胞。支架材料多为具有良好生物相容性的生物材料,可以保证种子细胞很好地附着在其表面,并促进细胞增殖和活性的稳定[8]。既可以为种子细胞生长提供三维空间,也可以为其提供细胞外基质样结构[9]。支架材料的性能对种子细胞的增殖、分化及表型的维持有重要影响[10]。
目前,在组织工程研究中,多选用同种异体的软骨细胞作为种子细胞,因为其来源方便,可以于短期内获得大量细胞。因此,本研究采用同种异体软骨细胞为种子细胞。软骨细胞在体外培养传代的过程中,会逐渐出现表型的变化,即软骨细胞合成、分泌Ⅱ型胶原及糖胺多糖减少,而Ⅰ、Ⅲ型胶原的合成和分泌增多。这种失去特异性表型的现象称为软骨细胞的去分化。研究[11]表明,第2代软骨细胞无论在表型的维持上还是增殖能力方面均为最佳。本实验选用的人胎盘Ⅰ型胶原蛋白海绵支架,其孔径约为25-100 μm,作为一种小孔径的支架材料,具有吸附细胞能力强、生物相容性好及降解性强等优点,被认为是体外培养软骨细胞的优良载体。因此,本研究以体外培养第2代软骨细胞为种子细胞,复合人胎盘Ⅰ型胶原蛋白海绵支架修复兔股骨髁间窝全层软骨缺损。
黄永波等[1]运用同种异体软骨细胞复合海藻酸钠在体外联合培养4周形成组织工程软骨后植入兔股骨内侧髁关节软骨缺损处,术后24周发现新生软骨组织与正常软骨颜色接近,表面完整光滑,软骨下骨也得以重建,但缺乏正常软骨的分层结构,修复组织与邻近正常软骨之间多存在裂隙。姜洪丰等[2]则采用体外培养2周的同种异体软骨细胞与去端肽胶原凝胶复合,植于兔膝关节股骨髁间窝全层软骨缺损处,结果显示,术后8周缺损区由具有一定弹性和韧性的软骨样组织填充,与周围正常软骨界限模糊,可见软骨陷窝底部细胞密集。Ochi等[12]运用人自体软骨细胞复合胶原前体凝胶(atelocolagengel)体外培养,用于临床上膝关节全层软骨缺损的患者,缺损区新生软骨的生物力学研究表明,其力学特性与正常软骨相似。本研究中,我们选择同种异体软骨细胞复合已商品化的支架材料人胎盘Ⅰ型胶原蛋白海绵修复兔膝关节股骨髁间窝全层软骨缺损。制作软骨缺损模型时,缺损未超过软骨下骨(深约2 mm),因为若缺损超过软骨下骨,有自行修复的可能[13]。
本研究结果表明,软骨细胞+支架材料组术后12周缺损区有类软骨样细胞及软骨陷窝形成,甲苯胺蓝染色可见新生类软骨样细胞分泌的胶原被染成红色。Ⅱ型胶原表达呈弱阳性,黄染细胞不多,出现少量黄褐色颗粒。术后24周缺损区表层软骨细胞呈扁平状,横向排列,深层软骨细胞多呈圆形放射状排列,可见软骨陷窝及软骨下骨形成。与正常软骨比较,新生软骨层厚度较薄,且与临近正常软骨间多存在裂隙,无完整的潮线形成。术后36周缺损区细胞排列接近正常透明软骨组织,表层完整光滑,可见软骨细胞呈典型球形放射状排列,并形成软骨陷窝,与邻近正常软骨组织愈合良好。软骨下骨进一步增多,可见完整潮线形成。软骨细胞组术后12周缺损区部分填充,新生软骨呈边缘不规则的小蜂窝状结构,甲苯胺蓝及免疫组化染色提示新生软骨细胞可表达少量蛋白多糖及Ⅱ型胶原。24周缺损区相对平整,新生组织由不典型软骨细胞及多角形纤维样细胞组成,甲苯胺蓝及免疫组化染色提示新生组织表达蛋白多糖及Ⅱ型胶原进一步减少。36周缺损区除少量未修复外,大部由纤维组织填充,组织中含大量纤维样细胞。对照组随着缺损修复时间的延长,出现越来越明显的纤维样修复表现。
可以发现,随着组织工程化软骨修复关节软骨缺损时间的延长,出现越来越明显的透明样软骨修复表现,蛋白多糖及Ⅱ型胶原的表达逐渐增强,去分化现象不明显。而单纯软骨细胞组则出现较明显的去分化表现,并最终导致纤维组织样修复。对照组由于没有细胞的填充,仅靠自身修复,仅出现不完全的纤维组织样修复表现。
综上所述,同种异体软骨细胞复合人胎盘Ⅰ型胶原蛋白海绵可以较好地修复关节软骨缺损,其所形成的新生软骨组织,具有关节透明软骨的特性。
[1] 黄永波,卫小春,翁习生,等.海藻酸钠-成年软骨细胞培养移植修复成年兔关节软骨缺损的研究[J].中华实验外科杂志,2004,21(8):988-991.
[2] 姜洪丰,魏巍,解云川,等.组织工程化软骨修复兔膝关节软骨缺损的实验研究[J].中华显微外科杂志,2006,29(3):206-209.
[3] 林建华,吴朝阳,许卫红,等.同种异体组织工程化软骨修复关节软骨缺损[J].骨与关节损伤杂志,2001,16(4):290-291.
[4] 熊高鑫,查振刚,谭文成,等.PLGA复合Ⅱ型胶原和生长因子诱导组织工程软骨修复兔关节软骨缺损[J].中山大学学报:医学科学版,2010,31(3):315-320.
[5] Kimura T,Yasui N,Ohsawa S,et al.Chondroeytes embedded in collagen gels maintain cartilage phenotype during long-term cultures[J].Clin Orthop,1984,186:213-239.
[6] Matsusaki M,Oehi M,Uvhio Y,et al.Effects of basic fibroblast growth factor on proliferation and phenotype expression of chondrocytes embedded in collagen gel[J].Gen Pharmacol,1988,31:759-764.
[7] Yasui N,Osawa S,Ochi T,et al.Primary culture of chondrocytes embedded in collagen gels[J].Exp Cell Biol,1982,50:95-100.
[8] Russlies M,Behrens P,Wünsch L,et al.A cell-seeded biocomposite for cartilage repair[J].Ann Anat,2002,184:317-323.
[9] Terada S,Sato M,Sevy A,et al.Tissue engineering in the twenty first century[J].Yonsei Med J,2000,41:685-688.
[10] Langer R,Vacanti JP.Tissue engineering[J].Science,1993,15:260-920.
[11] 杨志明.组织工程基础与临床[M].成都:四川科学技术出版社,2000:152-155.
[12] Ochi M,Uchio Y,Kawasaki K,et al.Transplantation of cartilagelike tissue made by tissue engineering in the treatment of cartilage defects of the knee[J].J Bone Joint Surg Br,2002,84:571-576.
[13] Hayes DW,Brower RL,John KJ.Articular cartilage[J].Clin Podiatr Med Surg,2001,18:35-37.

