去乙酰化酶3在胃癌中的表达及其临床意义
丁 瑜,付雪琼,余长寿,杨 兵(广东省深圳市龙岗中心医院消化内科,深圳 586;遵义医学院珠海校区;通讯作者,E-mail:yangbing6708@63.com)
研究发现主要的致癌信号通路最后都会汇聚到肿瘤细胞代谢上来,因为肿瘤细胞的代谢决定着肿瘤细胞的生长和存活,细胞代谢的改变可作为肿瘤的一个重要特点[1,2]。很多研究表明,去乙酰化酶3(SIRT3)在肿瘤细胞代谢中发挥重要作用[3]。SIRT3是沉默信息调节因子相关酶家族(sirtiuns)的一员,显著分布于细胞线粒体中,通过调控细胞葡萄糖的代谢,影响肿瘤细胞的新陈代谢,与肿瘤的发生和发展密切相关[4]。但SIRT3的表达与胃癌的关系尚不清楚,本研究采用Western blot和免疫组织化学的方法检测胃癌组织和癌旁组织中SIRT3的表达情况,并探讨其与临床病理特征的关系。
1 资料与方法
1.1 组织标本
收集深圳龙岗中心医院及深圳市人民医院2012-07~2012-12手术切除且病理资料完整的20例胃癌组织及癌旁组织(距手术切缘2-5 cm处正常胃组织)标本,所取组织置于液氮中保存24 h,后转-80℃冰箱保存,采用Western blot方法检测以上20例组织中SIRT3的表达。另外收集深圳龙岗中心医院2006-03~2007-12手术切除后的胃癌蜡块包埋标本30例,切缘组织为癌旁正常对照组,采用免疫组化方法检测以上50例标本中SIRT3的表达,并分析其与胃癌病理特征的关系。所有标本术前均未行放化疗,且病理诊断明确为胃癌。免疫组化标本中男42例,女8例;年龄 30-82岁,平均年龄(60.9±12.3)岁;按照国际抗癌联盟/美国癌症联合委员会(UICC/AJCC,2010)胃癌 TNM 分期:Ⅰ-Ⅱ期 22例,Ⅲ-Ⅳ期28例;有淋巴结转移34例,无淋巴结转移16例;高、中分化胃癌24例,低分化胃癌26例。
1.2 材料
SIRT3兔抗人单克隆抗体、鼠抗人单克隆β-actin抗体购自Cell Signaling Technology,免疫组化试剂盒、DAB显色试剂盒购自福州迈新生物技术有限公司。
1.3 研究方法
1.3.1 Western blot 取保存于-80℃冰箱的组织样本,用RIPA裂解液(含蛋白酶抑制剂)提取总蛋白,采用BCA法检测蛋白浓度后加入上样缓冲液,100℃煮沸5-10 min变性,12.5%的分离胶进行SDS-PAGE电泳,每孔上样总蛋白约30 μg左右,后进行转膜,5%脱脂奶粉室温封闭1 h,TBST洗膜后加入SIRT3及β-actin抗体,用5%BSA稀释,稀释比例均为1∶1 000,4℃摇床过夜,TBST洗膜后二抗室温孵育1 h,运用ECL试剂盒(Milipore公司)发光、显影、定影、冲洗晾干、拍照并成像分析。
1.3.2 免疫组织化学 采用免疫组化Max Vision二步法,具体步骤严格按免疫组化化学试剂盒说明书进行操作,DAB染色,苏木素复染后中性树胶封片。以PBS缓冲液代替一抗作阴性对照,已证实的SIRT3染色阳性的切片作阳性对照。
1.4结果判定
1.4.1 Western blot结果判断 运用 Quantity One软件分析蛋白条带的灰度值,将SIRT3/β-actin的比值作为蛋白表达的相对量。
1.4.2 免疫组化结果判断[5]所有切片采用双盲法由2-3位有经验的病理科医师阅片。SIRT3染色阳性表达位于胞质内,呈清晰棕黄色颗粒。每张切片随机观察5个高倍视野,判断标准根据显色细胞数和显色强度两个方面来评估。按显色细胞数评分:未见显色细胞为0分;细胞显色比例<50%为1分;细胞显色比例≥50% 为2分。按显色强度计分:无细胞显色为0分,呈淡黄色为1分,呈棕黄色为2分。两者积分乘积<2分表示阴性,≥2分表示阳性。
1.5 统计学分析
采用 SPSS 17.0软件进行统计学分析,对Western blot检测的蛋白相对表达量运用t检验,免疫组化测定结果进行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 Western blot检测SIRT3在胃癌组织中的表达
免疫印迹法结果显示,SIRT3在胃癌中表达阳性率为35%,其在胃癌组织中的表达水平明显低于其对应的癌旁正常胃组织,SIRT3在胃癌中的表达水平(0.960±0.126)较胃癌癌旁组织的表达水平(1.932 ±0.130)比较差异有统计学意义(P<0.05,见图1)。
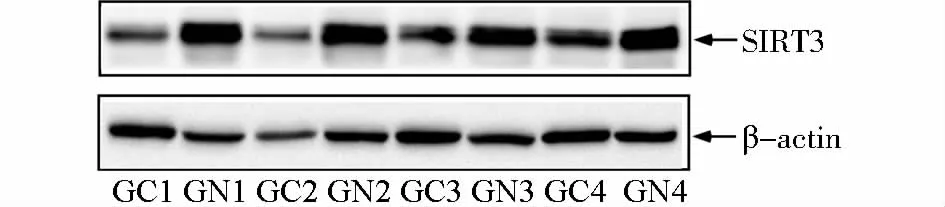
图1 Western blot检测SIRT3在胃癌组织及癌旁正常组织中的表达Figure 1 The expression of SIRT3 protein in gastric carcinoma tissues and peripheral normal tissues by Western blot
2.2 免疫组化检测SIRT3在胃癌组织中的表达
免疫组化染色结果显示,SIRT3在胃癌细胞中的表达主要位于细胞质内(图2),并且在胃癌组织中的表达阳性率为34%,明显低于癌旁正常胃组织(64%,P<0.05,见表1)。
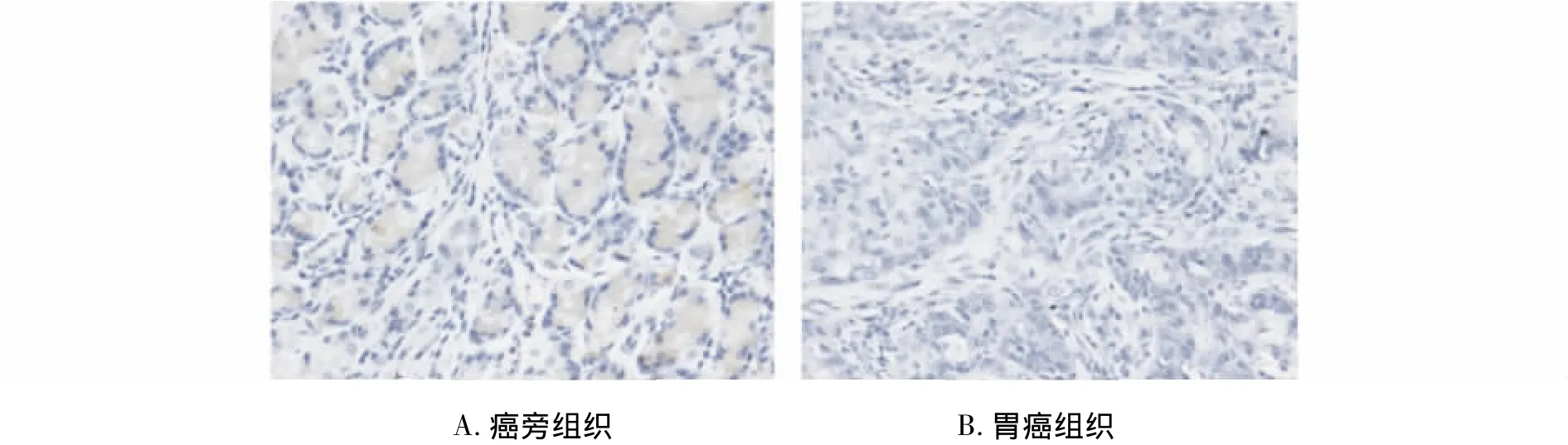
图2 SIRT3在胃癌组织及癌旁组织中的表达 (Max Vision法,×200)Figure 2 The expression of SIRT3 protein in gastric carcinoma tissues and peripheral normal tissues by immunochemistry(Max Vision,×200)
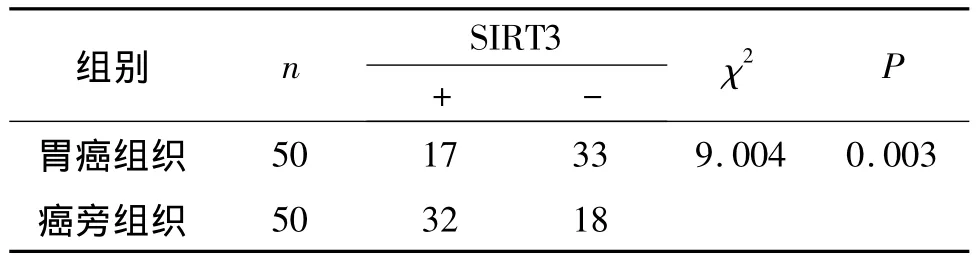
表1 SIRT3在胃癌组织及癌旁正常组织中的表达 (例)Table 1 Expression of SIRT3 protein in gastric carcinoma tissues and peripheral normal tissues (cases)
2.3 SIRT3的表达与临床各病理特征的关系
SIRT3在胃癌组织中的表达与年龄、性别、淋巴结转移无相关性(P>0.05),但与浸润深度、分化程度及TNM分期有关(P<0.05,见表2)。
3 讨论
SIRT3是沉默信息调节因子相关酶家族(sirtiuns)成员之一,sirtiuns家族被认为是Ⅲ类组织蛋白去乙酰化酶(HDAC),该家族蛋白在进化上高度保守,已经成为对衰老和长寿有重要作用的调控因子,它们通过NAD+依赖的酶催化活性,在细胞代谢、抗逆性、细胞增殖、存活和凋亡等过程起重要作用[6]。SIRT3是线粒体中主要的去乙酰化酶,具有去乙酰基酶活性,定位在11号染色体(11p15.5),基因长度21 kb,在肌肉、肝脏、心脏和褐色脂肪组织等代谢活动活跃的组织中高表达[7]。研究表明,肿瘤细胞主要通过葡萄糖的有氧糖酵解为细胞增殖、分化提供能量[4],而SIRT3正是以新陈代谢的许多酶类作为发挥去乙酰化作用的靶点,进而激活有氧代谢路径,影响肿瘤细胞的能量代谢[6]。目前大多数研究认为,SIRT3通过多种细胞代谢通路调控肿瘤细胞的代谢和生长,发挥肿瘤抑制的作用[8,9]。
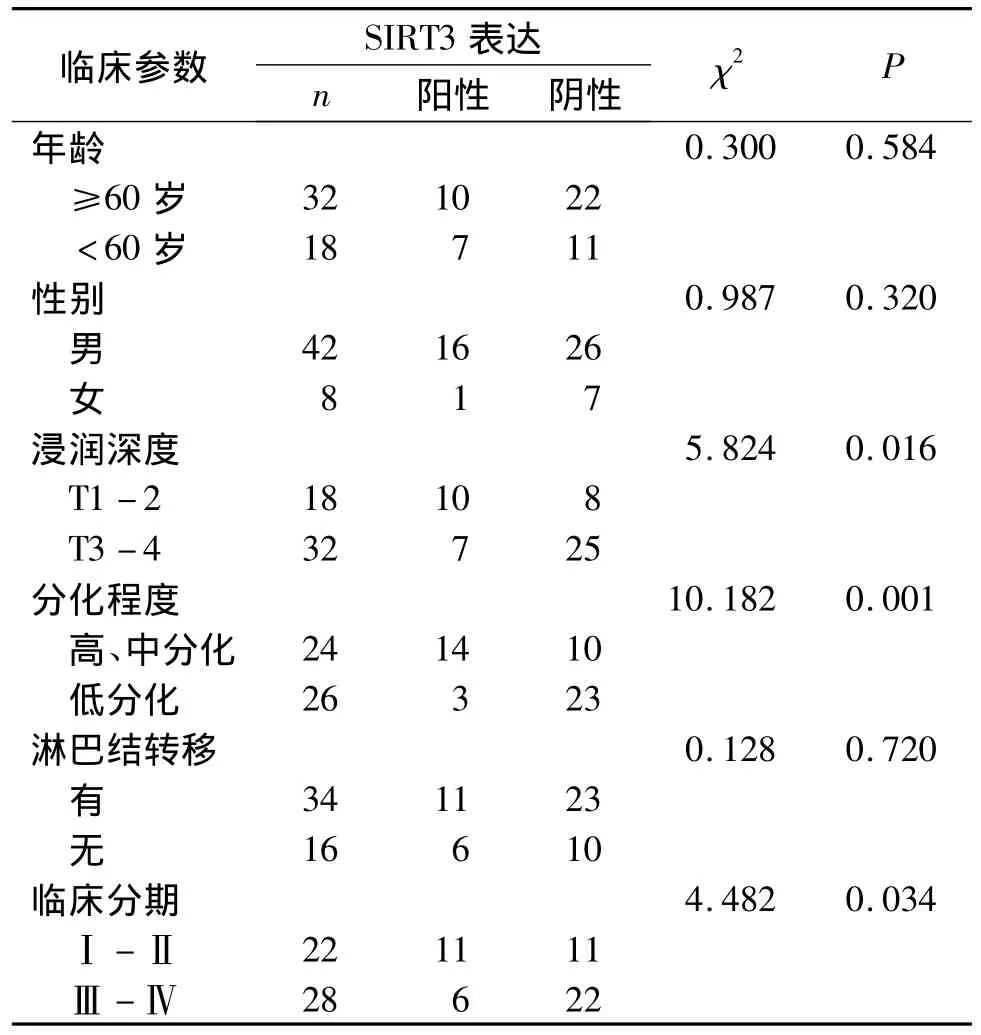
表2 胃癌SIRT3的表达与临床病理特征的关系 (例)Table 2 The relationship between clinical pathological features of gastric carcinoma and the expression of SIRT3 (cases)
我们的研究结果显示,胃癌组织中SIRT3表达的阳性率明显低于癌旁正常组织,SIRT3在胃癌组织中呈低水平表达。虽然SIRT3在胃癌组织中低表达的机制尚不清楚,但已有研究[8,10]发现,SIRT3 在多种恶性肿瘤,如乳腺癌、睾丸癌、胶质母细胞瘤、前列腺癌、头颈部鳞状细胞癌和肾透明细胞癌中表达也明显降低。最近Zhang等[11]也通过实验研究发现,SIRT3在原发性肝癌组织中低表达,并且SIRT3的过度表达能抑制肝癌细胞的生长,以上文献研究结果均与我们的研究结论一致。
同时Zhang等还发现SIRT3在肝癌细胞中的表达水平与患者的AFP值、肿瘤多发性、分化程度、临床分期以及有无复发呈显著相关性。为进一步探讨SIRT3在胃癌的发展进程中的作用,我们分析了SIRT3的表达与临床病理因素的关系,我们发现SIRT3的表达与胃癌的浸润深度、分化程度、临床分期有关,浸润胃组织越深,SIRT3的表达越低;分化程度高较分化程度低的胃癌组织中,SIRT3的表达水平较高;临床分期越晚,SIRT3的表达水平越低,其差异均有统计学意义(均P<0.05)。提示SIRT3的表达与胃癌细胞的侵袭能力、恶性程度有相关性,可能为临床上检测SIRT3的表达水平评估胃癌的恶性程度提供一定的理论基础。
综上所述,SIRT3与胃癌的发生、发展有密切关系,SIRT3在胃癌发生、发展方面可能发挥重要作用,SIRT3的表达与分化程度、浸润深度、临床分期有相关性,检测SIRT3蛋白的表达水平可能作为评估胃癌恶性程度的的一项重要指标。
[1] Cairns RA,Harris IS,Mak TW.Regulation of cancer cell metabolism[J].Nat Rev Cancer,2011,11(2):85-95.
[2] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[3] Hirschey MD,Shimazu T,Huang JY,et al.SIRT3 regulates mitochondrial protein acetylation and intermediary metabolism[J].Cold Spring Harb Symp Quant Biol,2011,76:267-277.
[4] Bayley JP,Devilee P.The Warburg effect in 2012[J].Curr Opin Oncol,2012,24(1):62-67.
[5] 张庆飞,杨兵.Ezrin和 c-Met在胃癌组织中的表达及意义[J].山西医科大学学报,2012,43(4):257-259.
[6] Verdin E,Hirschey MD,Finley LW,et al.Sirtuin regulation of mitochondria:Energy production,apoptosis,and signaling[J].Trends Biochem Sci,2010,35:669-675.
[7] Jin L,Wei W,Jiang Y,et al.Crystal structures of human SIRT3 displaying substrate induced conformational changes[J].Biol Chem,2009,284(36):24394-24405.
[8] Kim HS,Patel K,Muldoon-Jacobs K,et al.SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress[J].Cancer Cell,2010,17(1):41-52.
[9] Finley LW,Carracedo A,Lee J,et al.SIRT3 opposes reprogramming of cancer cell metabolism through HIF1α destabilization[J].Cancer Cell,2011,19(3):416-428.
[10] Schumacker PT.A tumor suppressor SIRTainty[J].Cancer Cell,2010,17(1):5-6.
[11] Zhang CZ,Liu L,Cai M,et al.Low SIRT3 expression correlates with poor differentiation and unfavorable prognosis in primary hepatocellular carcinoma[J].PLoS One,2012,7(12):e51703.

