心肌细胞凋亡对老年大鼠心脏功能的影响
王 瑾,王晓樑,白克华,燕 子,王 丽,刘慧荣,(山西医科大学生理学系,太原 0000;山西医科大学临床药学教研室;首都医科大学病理生理学系;通讯作者,E-mail:liuhr000@6.com)
衰老是生物体在生命过程中,机体各组织器官随年龄增长发生的一系列慢性、进行性、退化性改变。心脏是生命的重要器官,伴随增龄衰老,形态结构发生明显变化。大量研究表明,从17岁到90岁,单纯由于年龄因素,人体心肌细胞减少约1/3[1-4]。心肌细胞丢失后可能导致心脏功能下降进而促进心力衰竭的发生[5,6]。目前研究已知,组织器官中导致功能细胞丢失的主要原因有细胞死亡和肿瘤发生[7],而细胞死亡又包括了坏死(necrosis)、自体吞噬(autophagy)、细胞凋亡(apoptosis)和非凋亡性程序性细胞死亡(paraptosis)等方式[1,8,9]。Nitahara 等研究表明,在衰老小鼠心脏中,细胞坏死和凋亡均有出现,但随着年龄增加,左心室心肌细胞的凋亡率逐渐上升,而坏死的发生率并没有改变[10],提示在衰老过程中凋亡可能是促进心肌细胞丢失的主要方式之一。那么,衰老过程发生的心肌细胞凋亡对老年大鼠心功能有何影响?
1 材料和方法
1.1 动物及分组
健康、成年雄性SD大鼠,体重280-300 g,3月龄;健康、老年雄性SD大鼠,体重500-550 g,15月龄。购自四川省医学科学院实验动物研究所。实验动物的使用遵循中华人民共和国卫生部令(第55号)—医学实验动物管理实施细则,以及山西医科大学实验动物管理细则,并得到了山西医科大学动物保护协会的批准。
1.2 主要试剂
TUNEL检测试剂盒(Boehringer Mannheim,USA),caspase-3凋亡检测试剂盒(Biological Industries,Israel),Hochest33258,Sigma;cy3 标记的羊抗大鼠二抗,Sigma;抗肌原纤维α-actin抗体,武汉博士德;广谱caspase抑制剂Z-VAD-FMK,Sigma;其余试剂均为国产GR级,所用溶液均以超纯水配制。S/NE10023酶标仪,Molecular Devices公司;MS2000生物信号记录分析系统,成都泰盟公司。
1.3 方法
1.3.1 动物分组 分别从成年大鼠以及老年大鼠中随机选取大鼠进行分组:成年组(n=10)、老年组(n=10)以及广谱caspase抑制剂Z-VAD-FMK组(n=10,老年大鼠+Z-VAD-FMK)。Z-VAD-FMK组大鼠实验前经腹腔注射Z-VAD-FMK 6 mg/kg,其余各组分别腹腔注射等量的生理盐水。
1.3.2 大鼠在体心功能测定 各组大鼠腹腔注射20%氨基甲酸乙酯(1 g/kg)麻醉,仰卧固定于手术台上;于颈前皮肤处沿正中线作一约2.5 cm的切口,分离颈前肌群至气管,分离右侧颈总动脉并结扎远心端,近心端用小动脉夹夹闭;用眼科剪剪一“V”字形切口,将充满肝素生理盐水的导管插入切口,打开动脉夹,导管经右颈总动脉插入左心室并结扎固定。导管的另一端借三通管连接P-50压力换能器,压力信号输入MS2000生物信号记录分析系统。导管插入左心室后稳定15-20 min记录心功能各参数,包括左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张压(left ventricular diastolic pressure,LVDP)、左心室舒张末期压(left ventricular end-diastolic pressure,LVEDP)以及左心室内压上升和下降的最大速率(±dP/dtmax)。在本研究中,我们采用心室收缩指数(CI)反映心脏的收缩功能。CI=+dP/dtmax/LVSP,其结果不受舒张末压和大动脉血压的影响,较+dP/dtmax能更好地反映心脏收缩功能。用LVDP、LVEDP反映心脏的舒张功能。
1.3.3 心质量/体质量的测定 各组大鼠处死后开胸,迅速取出心脏,洗净心腔内积血,去除心脏周围组织及血管,用滤纸吸干水分后称量全心重,计算心脏质量与体质量的比值。
1.3.4 大鼠心肌细胞凋亡检测
1.3.4.1 TUNEL 染色 利用 In Situ Cell Death Detection试剂盒进行检测各组大鼠的凋亡。基本染色步骤如下:将组织切片常规脱蜡;梯度酒精中水化;蛋白酶K消化;配制含末端脱氧核苷酸转移酶(Ⅰ液)和荧光素标记的dUTP(Ⅱ液)混合反应液,加入后孵育;再滴加连接碱性磷酸酶的抗荧光素抗体孵育;坚固红呈色;苏木素轻衬染,甘油封片。应用BI2000医学图像分析系统进行拍照分析。每张切片随机选取10个高倍视野(×400),计数凋亡阳性细胞(荧光显微镜下为绿色;光镜下为棕色),以凋亡指数反映心肌细胞凋亡的情况。凋亡指数=(视野内凋亡细胞个数/视野内所有心肌细胞个数)×100%。
1.3.4.2 caspase-3活性测定 各组大鼠心肌组织caspase-3活性用caspase-3检测试剂盒测定。取心肌组织,按1 mg组织加入10 μl裂解液的比例进行稀释,置冰上剪碎,匀浆,离心。上清以考马斯亮兰试剂盒测定蛋白浓度。取上清、反应缓冲液,底物(DEVD-pNA)加至ELISA板中水浴后,用酶标仪测定光密度值。结果以实验孔的光密度值减去背景对照光密度值来表示。
1.4 统计学分析
使用SPSS15.0统计软件对数据进行统计分析。实验数据以±s表示,两组间均数比较采用t检验,相关性分析采用Spearman’s相关分析,P<0.05认为差异具有统计学意义。
2 结果
2.1 老年大鼠心脏的心质量/体质量比下降,收缩和舒张功能均下降
与成年大鼠相比,老年大鼠的心脏质量显著增加[(0.61 ±0.04)gvs(1.42 ±0.04)g,P<0.01],但与成年大鼠相比,老年大鼠的心质量/体质量却显著下降(0.31% ±0.01%vs0.26% ± 0.01%,P<0.01),提示老年大鼠的心脏相对质量明显降低。
血流动力学结果表明,与成年大鼠相比,老年大鼠心肌收缩功能的相应指标明显下降(46.82±3.176 s-1vs37.23 ±1.52 s-1,P<0.05,见图 1A);而反映心肌舒张功能的LVDP[(0.16±0.17)kPavs(-1.16 ±0.35)kPa]与 LVDEP[(1.25 ±0.35)kPavs(-0.70 ±0.43)kPa]均明显升高(P<0.01,见图1B,1C)。
2.2 老年大鼠心肌细胞凋亡增加

图1 成年大鼠和老年大鼠心脏功能的比较 (n=10)Figure 1 Comparison of cardiac functions between aged rats and adult rats (n=10)
TUNEL结果(图2)显示,成年大鼠心肌细胞凋亡指数为0.86% ±0.29%,老年大鼠达到2.86% ±0.43%,二者相比,老年大鼠心肌细胞凋亡明显增加(P<0.05,见图3A);与成年大鼠心肌组织的caspase-3比活性(1.00±0.028)相比,老年大鼠caspase-3的比活性(2.21±0.327)显著增高(P<0.01,见图3B)。

图2 老年大鼠心肌组织TUNEL典型图Figure 2 The typical features of cardiomyocytes in aged rats by TUNEL
2.3 老年大鼠心肌组织caspase-3活性与心脏功能的关系
caspase-3活性与心肌收缩功能指标CI呈负相关(r=-0.772,P<0.01),即随着 caspase-3 活性的增高,CI降低。也就是说,caspase-3活性越高,大鼠心肌收缩功能越差,提示,老年大鼠心肌收缩功能下降可能与其凋亡水平增加有关(见图4A)。caspase-3活性与心肌舒张功能指标LVDP呈正相关(r=0.718,P<0.01),即随着 caspase-3 活性增高,LVDP相应增加,即caspase-3活性越高,心肌舒张功能越差,提示老年大鼠心肌舒张功能下降可能与其凋亡水平增加有关(见图4B)。
2.4 给予广谱的Caspase抑制剂Z-VAD-FMK阻断大鼠心肌细胞凋亡,大鼠心脏功能改善
给予广谱的caspase抑制剂Z-VAD-FMK后,测定大鼠心脏功能,结果表明:老年大鼠CI明显升高[(39.23 ± 1.62)s-1vs(43.52 ± 2.42)s-1,P<0.05];LVDP[(0.16 ± 0.17)kPavs(- 0.82 ±0.26)kPa,P< 0.05]和 LVEDP[(1.25 ±0.35)kPavs(0.32 ±0.18)kPa]均明显降低(见图 5)。提示经过抗凋亡干预后,老年大鼠的心脏功能明显改善。
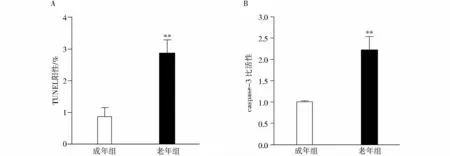
图3 老年大鼠心肌组织中凋亡情况的变化 (n=10)Figure 3 The apoptosis of cardiomyocytes in aged rats (n=10)

图4 老年大鼠心肌组织caspase-3活性与其心功能的相关性分析 (n=10)Figure 4 The relationship between caspase-3 activity and cardiac function in aged rats (n=10)
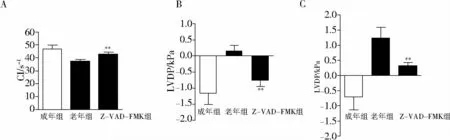
图5 广谱Caspase抑制剂Z-VAD-FMK抑制凋亡后对老年大鼠心功能的影响 (n=10)Figure 5 The effects of Z-VAD-FMK on cardiac function in aged rats (n=10)
3 讨论
心脏是生命的重要器官,伴随增龄衰老,形态结构发生明显变化。本研究进一步证实:老年大鼠心肌细胞丢失,心功能下降。我们的研究发现与成年大鼠心质量相比,老年大鼠的心质量显著增加,但与成年大鼠的心质量/体质量相比,老年大鼠的心质量/体质量却显著下降,提示老年大鼠的心脏相对质量明显降低。而且,老年大鼠的心肌收缩及舒张功能均明显低于成年大鼠。那么,这些现象的出现是否与细胞丢失,尤其是心肌细胞凋亡密切相关呢?本研究进一步检测了老年大鼠心肌细胞的凋亡情况。
TUNEL染色是检测细胞凋亡的一种较灵敏的方法,通过该方法分别对成年大鼠及老年大鼠心肌组织进行检测,并计数凋亡指数,本实验的细胞凋亡学检测结果显示:老年组大鼠阳性染色的凋亡核明显增加,凋亡指数较正常成年大鼠显著增多(P<0.01)。caspase-3是细胞凋亡最后通路的关键蛋白,其活性可以定量反映细胞凋亡发生情况。为了更准确地反映老年大鼠心肌组织的凋亡程度,本实验配合检测了老年大鼠心肌组织的caspase-3活性来共同说明心肌细胞的凋亡情况,结果表明,与成年大鼠相比,老年大鼠caspase-3的比活性显著增高,较全面地反映了老年大鼠心肌细胞凋亡增加。
那么,老年大鼠心肌组织细胞凋亡是否是其心功能下降的重要因素?本研究进一步观察了心肌细胞凋亡程度与心功能的关系。研究结果发现:caspase-3活性与CI呈负相关,与LVDP呈正相关。也即随着caspase-3活性增高,老年大鼠心肌收缩功能和舒张功能降低。这一结果提示老年大鼠心肌收缩和舒张功能的下降可能与其凋亡水平增加有关。
无论是内源性还是外源性损伤信号均通过细胞表面受体激活从而引起细胞凋亡,这一途径的关键步骤是caspase的激活,最终导致细胞凋亡的发生。因此,抑制caspase的活性是调节细胞凋亡的重要途径。Z-VAD-FMK是一种广谱的不可逆caspase抑制剂,可以在蛋白水平抑制caspase的酶活性。在本研究中为了进一步证实心肌细胞凋亡在老年大鼠心功能下降中的作用,我们采用了广谱的caspase抑制剂Z-VAD-FMK,抑制心肌细胞凋亡后发现,老年大鼠心脏的收缩和舒张功能均明显改善,提示:心肌细胞凋亡在老年大鼠心功能下降中发挥着重要作用。
总之,心脏是人体的重要生命器官,其功能降低将对人体构成严重影响。本实验结果表明衰老可以引起心肌细胞凋亡进而导致心肌收缩和舒张功能降低,提示临床可以通过抗凋亡措施来减少心肌细胞丢失进而延缓心功能的下降。
[1] Goldspink DF,Burniston JG,Tan LB.Cardiomyocyte death and the ageing and failing heart[J].Exp Physiol,2003,88(3):447-458.
[2] Olivetti G,Giordano G,Corradi D,et al.Gender differences and aging:effects on the human heart[J].J Am Coll Cardiol,1995,26(4):1068-1079.
[3] Olivetti G,Melissari M,Capasso JM,et al.Cardiomyopathy of the aging human heart.Myocyte loss and reactive cellular hypertrophy[J].Circ Res,1991,68(6):1560-1568.
[4] Mallat Z,Fornes P,Costagliola R,et al.Age and gender effects on cardiomyocyte apoptosis in the normal human heart[J].J Gerontol A Biol Sci Med Sci,2001,56(11):M719-723.
[5] Lakatta EG.Cardiovascular regulatory mechanisms in advanced age[J].Physiol Rev,1993,73(2):413-467.
[6] Spina RJ.Cardiovascular adaptations to endurance exercise training in older men and women[J].Exerc Sport Sci Rev,1999,27:317-332.
[7] Hein S,Arnon E,Kostin S,et al.Progression from compensated hypertrophy to failure in the pressure-overloaded human heart:structural deterioration and compensatory mechanisms[J].Circulation,2003,107(7):984-991.
[8] Kunapuli S,Rosanio S,Schwarz ER.“How do cardiomyocytes die?”apoptosis and autophagic cell death in cardiac myocytes[J].J Card Fail,2006,12(5):381-391.
[9] Broker LE,Kruyt FA,Giaccone G.Cell death independent of caspases:a review[J].Clin Cancer Res,2005,11(9):3155-3162.
[10] Nitahara JA,Cheng W,Liu Y,et al.Intracellular calcium,DNase activity and myocyte apoptosis in aging Fischer 344 rats[J].J Mol Cell Cardiol,1998,30(3):519-535.

