慢性丙型肝炎患者外周血中Th17细胞的变化及其意义
王 萍,胥 冰,张丽君(陕西中医学院免疫教研室,咸阳 712046;通讯作者,E-mai:smilewangwangping@163.com)
丙型肝炎是一种由丙型肝炎病毒(hepatitis C virus,HCV)感染机体后所引起的肝脏急慢性炎症,目前全世界大约有2亿HCV感染者,且80%为慢性丙型肝炎患者,易进展为肝硬化和肝癌,严重危害人民身体健康。慢性丙型肝炎的发病机制十分复杂,确切机制尚未完全清楚。Th17细胞是新近发现的具有特异细胞膜表面分子和核转录因子的CD4+T细胞亚群,在肿瘤、自身免疫性疾病、过敏性疾病及感染性疾病中发挥重要作用[1]。最近有研究显示Th17细胞及效应因子IL-17可能在HCV感染过程中发挥一定的作用[2-5]。为了进一步研究Th17细胞在慢性丙型肝炎中的作用,本研究检测慢性丙型肝炎患者外周血中Th17细胞、核转录因子视黄醇类孤核受体 γt(retinoid-related orphan receptor gamma-t,RORγt)mRNA 及白细胞介素 17(interleukin 17,IL-17)的水平,并初步探讨其临床意义。
1 对象和方法
1.1 研究对象
连续选择2012-06~2013-03在陕西中医学院附属医院感染科治疗的慢性丙型肝炎患者60例,其中男性36例,女性24例,年龄20-63岁,平均年龄(37.19±14.07)岁。所有病例诊断符合2000年中华医学会传染病与寄生虫学分会、肝病学分会联合修订的《病毒性肝炎防治方案》[6],均排除其他病毒性疾病、自身免疫性、肿瘤和药物及酒精性肝炎等,采集样本前均未进行抗病毒治疗和免疫调节治疗。选择健康体检者40例作为对照组,其中男性22例,女性18例,年龄20-62岁,平均年龄(35.67±12.39)岁,均排除病毒性疾病、自身免疫性疾病、肿瘤和药物及酒精性肝炎。两组研究对象性别、年龄的比较差异均无统计学意义(性别:χ2=0.246,P=0.619;年龄:t=0.554,P=0.580)。本研究征得了陕西中医学院伦理委员会及所有受试者的同意。
1.2 方法
1.2.1 主要试剂 佛波酯、离子霉素、莫能霉素、固定液、破膜液、FITC-CD4抗体及 Alexa Fluor® 647-IL-17抗体购自美国eBioscience公司,TRIzol液购自美国Invitrogen公司,cDNA 第一链合成剂盒购自立陶宛Fermentas公司,引物由上海生工生物工程技术服务有限公司合成,SYBR®Premix Ex TaqTMⅡ反应体系购自大连宝生物工程有限公司,ELISA试剂盒购自美国R&D公司。
1.2.2 Th17细胞检测 患者于清晨空腹抽取静脉血5 ml,分离外周血单个核细胞,取3 ml单细胞悬液(1 ×106个/ml)加入佛波酯(50 ng/ml)3 μl、离子霉素(500 ng/ml)1.5 μl,混匀后 37 ℃、5%CO2孵育1 h后加入莫能霉素(蛋白转运抑制剂)2 μl,37℃、5%CO2孵育4 h,离心洗涤细胞后加入20 μl FITC-CD4抗体,混匀后避光孵育20 min;洗涤离心后分别加入4℃ 1×固定液、37℃ 1×破膜液后洗涤重悬细胞后,加入 20 μl Alexa Fluor®647-IL-17 抗体、同型对照抗体,孵育30 min后洗涤重悬细胞。利用FACS Calibur型流式细胞仪进行检测,通过Cellquest软件进行收集分析数据。
1.2.3 RORγt mRNA 表达水平检测 500 μl单细胞悬液加入500 μl TRIzol液提取细胞总RNA,利用Fermentas试剂盒进行cDNA第一链合成。根据Genbank RORγt、GAPDH 序列利用 Primer Premier 5.0软件设计引物,具体序列如下:RORγt上游引物5’-GAGCCAAGGCTCAGTCATGAGAA-3’,下游引物5’-GTCCCTCTGCTTCTTGGACAT-3’,产物大小 289 bp;GAPDH 上游引物5’-GAGAAGGCTGGGGCTCATTT-3’,下游引物5’-AGTGATGGCATGGACTGTGG-3’,产物大小231 bp。利用20 μl体系进行荧光定量PCR 扩增:SYBR® Premix Ex TaqTMⅡ(2×)10 μl、PCR 上下游引物(2 μmol/L)各2 μl、cDNA 6 μl。采用两步法进行PCR扩增,95℃ 10 s预变性,然后进行如下循环:95℃ 5 s,61℃ 15 s,72℃ 30 s,共45个循环。扩增结束后采用Bio-Rad iQ520 Standard E-dition Optical System Software V2.0进行数据分析。
1.2.4 血浆中 IL-17水平检测 利用 ELISA试剂盒检测血浆IL-17水平,每个样本做3个复孔,IL-17的最低检测值小于4 pg/ml,实验操作严格按照试剂盒说明书进行。
1.3 统计学分析
采用SPSS16.0软件进行统计分析,计数资料比较采用χ2检验;计量资料采用±s表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组研究对象外周血Th17细胞百分率的比较
流式细胞分析(以CD4+细胞为门)结果显示,与正常对照组[(0.87±0.16)%]相比,慢性丙型肝炎患者外周血Th17细胞百分率[(1.15±0.21)%]明显升高,差异有统计学意义(t=7.157,P=0.000,见图1)。
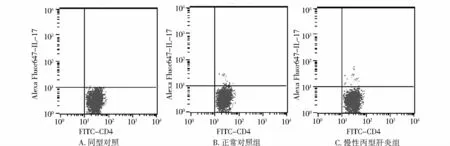
图1 两组研究对象外周血Th17细胞百分率的比较Figure 1 Comparison of the percentage of Th17 cells in the peripheral blood between patients with chronic hepatitis C and healthy controls
2.2 两组研究对象外周血RORγt mRNA表达水平的比较
荧光定量PCR结果显示:慢性丙型肝炎患者外周血RORγt mRNA 表达水平(0.43 ±0.11)明显高于正常对照组(0.32±0.09),差异有统计学意义(t=5.257,P=0.000)。
2.3 两组研究对象血浆中IL-17水平的比较
慢性丙型肝炎患者血浆IL-17水平明显升高于正常对照组,差异有统计学意义[(39.43±12.61)pg/mlvs(24.07 ±8.62)pg/ml,t=6.722,P=0.000]。
3 讨论
慢性丙型肝炎发病机制尚未完全清楚,有研究提示,Th细胞亚群及其相关细胞因子网络失衡参与了慢性 HCV 感染的发生、发展[7,8]。研究表明,慢性丙型肝炎患者体内调节性T细胞增多,抑制活性增强,HCV特异性CD8+T细胞反应减低,导致HCV持续感染 。Th17细胞是新近发现的一类CD4 T细胞亚群,与调节性T细胞来源于同一前体细胞,且二者在一定条件下可以互相转化,研究证实Th17细胞在自身免疫性疾病、肿瘤及感染性疾病中发挥重要作用[1]。近期研究发现Th17细胞在乙型肝炎感染中发挥一定作用,并与乙型肝炎慢性化及肝功能损伤有关[11-13]。
迄今为止Th17细胞在HCV发病中作用的研究甚少,且研究结果并不一致[3-5,14],为了进一步研究Th17细胞在慢性丙型肝炎发病中的具体作用,本实验检测了慢性丙型肝炎外周血中Th17细胞及其主要效应分子IL-17的变化,结果发现慢性丙型肝炎患者外周血中Th17细胞百分率及血浆中IL-17水平均明显高于正常对照组(P<0.05),这与国内外大多数研究结果一致[2-5]。但 Foster 等[14]研究发现慢性丙型肝炎患者肝组织内IL-17水平明显升高,但外周血中IL-17水平与正常对照组比较差异无统计学意义,这可能与研究病例的选择、采样时间、Th17细胞检测手段不同等因素有关。RORγt是视黄醇家族成员之一,研究表明RORγt是Th17细胞分化过程中关键的转录激活因子[15,16],本实验还发现慢性丙型肝炎患者RORγt mRNA表达水平明显高于正常对照组(P<0.05),这与Th17细胞变化一致。有关HCV感染后Th17细胞增多的机制尚未清楚,国外研究发现HCV核心蛋白及NS3蛋白可以促进Th17细胞分化[17],而转化生长因子可以抑制HCV特异Th17细胞分化[18]。
综上所述,慢性丙型肝炎患者体内Th17细胞百分率增加,分泌IL-17能力增强,可能参与了慢性丙型肝炎的发病过程,但本研究仅对外周Th17细胞进行了研究,如能同时对肝内Th17细胞进行研究将有助于全面了解Th17细胞在慢性丙型肝炎发病机制中的作用,可能为阐明丙型肝炎的慢性化机制及指导其治疗提供理论及实验基础。
[1] Wilke CM,Bishop K,Fox D,et al.Deciphering the role of Th17 cells in human disease [J].Trends Immunol,2011,32(12):603-611.
[2] Bǎlǎnescu P,Lǎdaru A,Voiosu T,et al.Th17 and IL-17 immunity in chronic hepatitis C infection[J].Rom J Intern Med,2012,50(1):13-18.
[3] 于建武,孙丽杰,刘伟,等.Th17细胞和自然杀伤性T细胞在胰岛素抵抗的慢性丙型肝炎患者外周血中的变化[J].肝脏,2012,17(5):319-321.
[4] 廖凤,张晓红,蔡庆贤,等.慢性丙肝外周血Thl7/Thl水平与干扰素联合利巴韦林标准治疗快速应答的关系[J].中华实验和临床病毒学杂志,2012,26(3):225-228.
[5] Chang Q,Wang YK,Zhao Q,et al.Th17 cells are increased with severity of liver inflammation in patients with chronic hepatitis C[J].J Gastroenterol Hepatol,2012,27(2):273-278.
[6] 中华医学会传染病与寄生虫学会、肝病学分会.病毒性肝炎防治方案[J].中华内科杂志,2001,41(4):62-68.
[7] Sofian M,Aghakhani A,Farazi AA,et al.Serum profile of T helper 1 and T helper 2 cytokines in hepatitis C virus infected patients[J].Hepat Mon,2012,12(12):e6156
[8] Gigi E,Raptopoulou-Gigi M,Kalogeridis A,et al.Cytokine mRNA expression in hepatitis C virus infection:TH1 predominance in patients with chronic hepatitis C and TH1-TH2 cytokine profile in subjects with self-limited disease[J].J Viral Hepat,2008,15(2):145-154.
[9] Hashempoor T,Bamdad T,Merat S,et al.Expansion of CD4+CD25+FoxP3+regulatory T cells in chronic Hepatitis C virus infection[J].Iran J Immunol,2010,7(3):177-185.
[10] Alatrakchi N,Koziel M.Regulatory T cells and viral liver disease[J].J Viral Hepat,2009,16(4):223-229.
[11] Huang Z,van Velkinburgh JC,Ni B,et al.Pivotal roles of the interleukin-23/T helper 17 cell axis in hepatitis B[J].Liver Int,2012,32(6):894-901.
[12] Zhang JY,Zhang Z,Lin F,et al.Interleukin-17-producing CD4(+)T cells increase with severity of liver damage in patients with chronic hepatitis B[J].Hepatology,2010,51(1):81-91.
[13] Yang B,Wang Y,Zhao C,et al.Increased Th17 cells and interleukin-17 contribute to immune activation and disease aggravation in patients with chronic hepatitis B virus infection [J].Immunol Lett,2013,149(1/2):41-49.
[14] Foster RG,Golden-Mason L,Rutebemberwa A,et al.Interleukin(IL)-17/IL-22-producing T cells enriched within the liver of patients with chronic hepatitis C viral(HCV)infection [J].Dig Dis Sci,2012,57(2):381-389.
[15] Ivanov II,McKenzie BS,Zhou L,et al.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006,126(6):1121-1133.
[16] Manel N,Unutmaz D,Littman DR.The differentiation of human T(H)-17 cells requires transforming growth factor-beta and induction of the nuclear receptor RORgammat[J].Nat Immunol,2008,9(6):641-649.
[17] Tu Z,Hamalainen-Laanaya HK,Nishitani C,et al.HCV core and NS3 proteins manipulate human blood-derived dendritic cell development and promote Th 17 differentiation [J].Int Immunol,2012,24(2):97-106.
[18] Rowan AG,Fletcher JM,Ryan EJ,et al.Hepatitis C virus-specific Th17 cells are suppressed by virus-induced TGF-beta[J].J Immunol,2008,181(7):4485-4494.

