C75对肝癌细胞侵袭转移的影响及其机制
王益东,陈昆仑,朱海涛,刘仲伟,刘 妮,徐 心(西安交通大学医学院第二附属医院普通外科,西安70004;西安交通大学医学院;通讯作者,E-mail:xuxin77@6.com)
肝癌在亚洲和非洲发病率较高,同时由于缺乏针对肝癌侵袭转移的有效治疗手段,病死率居高不下[1,2]。肿瘤的侵袭转移是一个多基因、多因素共同调控的复杂过程,其中基质金属蛋白酶及其抑制剂等多种因素在其中发挥重要作用[3],但具体机制尚未完全明了,有待进一步深入研究。
脂肪酸合成酶(FAS)是脂肪酸合成过程中的关键酶,在多种肿瘤中均存在FAS异常高表达和内生性脂肪酸的活跃代谢,包括乳腺癌、前列腺癌、结肠癌和肝癌等[4-9]。FAS与肿瘤的发生发展密切相关,许多研究便以其为靶点研发抗肿瘤药物,C75便是多种FAS抑制剂中的一种。C75是一种化学合成的稳定的FAS抑制剂,研究发现该药能够抑制多种肿瘤细胞的增殖[10-17]。但关于其抑制肿瘤细胞侵袭转移的作用鲜有报道。基质金属蛋白酶2(MMP-2)和基质金属蛋白酶9(MMP-9)在肿瘤细胞的侵袭转移过程中发挥重要作用,其能够降解细胞外基质,以利于肿瘤细胞的迁徙和侵袭[3]。而基质金属蛋白酶抑制剂(TIMP)能够与抑制MMP的活性,从而对肿瘤细胞的侵袭转移发挥抑制作用[3]。本研究中,我们对C75对肝癌MHCC97H细胞侵袭转移的作用做了研究,拟初步阐明C75在肝癌细胞侵袭转移过程中的作用。
1 材料和方法
1.1 主要试剂
MMP-2,MMP-9,TIMP-1 和 TIMP-2 蛋白抗体(Cell Signal,美国),β-actin 单抗(santa cruz,美国),ECL化学发光试剂盒(Pierce,美国),DMEM培养基,胎牛血清(Hyclone,美国),C75(SIGMA,美国),其他试剂均为国产分析纯。
1.2实验方法
1.2.1 细胞培养及C75对MHCC97H细胞增殖能力的检测 MHCC97H细胞(西安交通大学医学院杨成成博士馈赠)用含10%胎牛血清的DMEM培养液,于5%CO2培养箱中,37℃常规培养。融合率达到70%-80%进行传代培养。MTT法检测不同浓度 C75(0,2.5,5,10,20 μg/ml)对 MHCC97H 细胞增殖能力的影响。
1.2.2 划痕实验检测C75对细胞迁徙能力的影响接种MHCC97H细胞于6孔板中,当细胞融合率达到70%-80%时,采用1 μl白枪头在六孔板中平行划痕,PBS冲洗脱落细胞,镜下观察划痕是否良好,细胞分为空白对照组(DMSO)、2.5 μg/ml和 5 μg/ml组。分别于 0,6,12,24 h 时对划痕进行照相,并对划痕图片进行分析,检测C75对细胞迁徙能力的影响。
1.2.3 Transwell小室法检测细胞的侵袭能力 将基质胶均匀涂于 Transwell小室(BD,美国)底部。取对数生长期MHCC97H细胞,用无血清的培养基制备单细胞悬液,上室中加入1×105个细胞(体积200 μl),下室中加入 500 μl血清浓度为 10% 的完全培养基。分组情况同1.2.2,24 h后取出小室,并进行清洗(PBS),固定(4%多聚甲醛),染色(结晶紫溶液)和计数。计数前用棉签轻轻擦掉上室中未穿过细胞。
1.2.4 Western blot检测 MMP-2,MMP-9,TIMP-1 和TIMP-2的蛋白表达 取对数生长期MHCC97H细胞,蛋白裂解液冰上裂解30 min,14 000 r/min离心15 min,取上清,采用BCA法测蛋白浓度后煮沸变性(5 min)。SDS-PAGE电泳法电泳,湿法转膜后将膜置于5%脱脂奶粉封闭2 h,一抗(MMP-2 1∶1 000、MMP-9 1∶1 000、TIMP-1 1∶1 000、TIMP-2 1∶1 000、βactin 1∶1 000)4℃孵育过夜,TBST充分洗膜,相应二抗室温孵育1 h,凝胶成像分析仪采集图像。
1.2.5 明胶酶谱法检测蛋白酶活性 利用细胞计数结果调整上样量,利用0.1% 明胶(gelatin)-8%SDS-PAGE进行电泳。电泳结束后利用2.5%Triton X-100室温下对胶进行洗涤两次,每次30 min。然后在反应液中(10 mmol/L CaCl2,40 mmol/L Tris-HCl,0.01%NaN3,pH8.0)37 ℃孵育12 h。然后利用考马斯亮蓝对胶进行染色并照相,最后对结果利用Image J进行分析。
1.3 统计学分析
2 结果
2.1 C75对肝癌细胞增殖的影响
本研究发现C75能够抑制肝癌细胞MHCC97H的增殖,在浓度低于10 μg/ml时,C75对MHCC97H细胞的抑制作用并不明显。为了排除C75抑制MHCC97H细胞增殖作用对侵袭实验结果的影响,我们选择低于10 μg/ml的浓度进行后续实验。从图1可以看出在C75浓度低于10 μg/ml时,C75对MHCC97H细胞的抑制作用并不明显;在浓度高于10 μg/ml时,能够明显抑制MHCC97H细胞的增殖,差异具有统计学意义。

图1 C75对MHCC97H细胞增殖的影响Figure 1 The anti-proliferative effect of C75 on MHCC97H cells
2.2 C75对MHCC97H细胞迁徙能力的影响
C75能够明显抑制MHCC97H细胞的迁徙能力,从图2中可以看出,MHCC97H细胞的迁徙能力较强,24 h后划痕基本愈合。但2.5和5 μg/ml C75能够明显抑制MHCC97H细胞的迁徙能力。对结果进行统计分析后发现,C75能够明显抑制MHCC97H细胞的侵袭转移,这种作用具有明显的量效关系(图3)。

图2 划痕实验检测不同浓度C75 作用下MHCC97H 细胞迁徙能力的变化Figure 2 The changes of MHCC97H cell after treatment with C75 for different time by wound healing assa
2.3 C75对MHCC97H细胞侵袭能力的影响
从图4中可以看出,随着C75浓度的增加,MHCC97H细胞的侵袭能力明显减弱,穿过小室基底膜的细胞数目明显减少。对结果进行统计分析后发现,C75能够明显抑制MHCC97H细胞的侵袭转移,差异具有统计学意义(见图5)。
2.4 C75 对 MHCC97H 细胞中 MMP-2,MMP-9,TIMP-1和TIMP-2表达及酶活性的影响
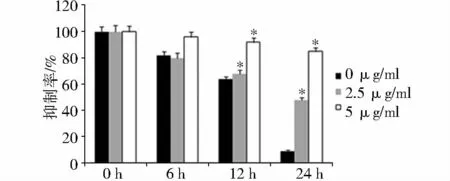
图3 不同浓度C75对MHCC97H细胞迁徙能力的影响Figure 3 Effect of C75 on MHCC97H cell migration

图4 Transwell小室法检测不同浓度C75作用下MHCC97H细胞侵袭的能力Figure 4 Changes of the invasion of MHCC97H cells after treated by different concentrations of C75 by Transwell
本研究发现随着 C75浓度的增加,细胞中MMP-2和MMP-9的表达水平明显升高。同时随着C75浓度的增加,培养基中MMP-2和MMP-9的酶活性也明显升高,其分解明胶的能力增强。同时MHCC97H细胞中TIMP-1和TIMP-2的表达水平随着C75浓度的增加,表达量逐渐升高(见图 6,7)。经统计学分析发现这些作用具有明显的量效关系(见图6,7)。
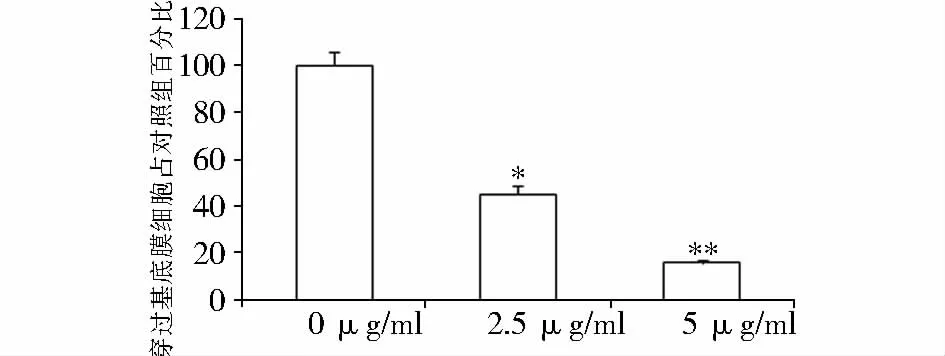
图5 不同浓度C75对MHCC97H细胞侵袭能力的影响Figure 5 Effect of C75 on the invasion of MHCC97H cells
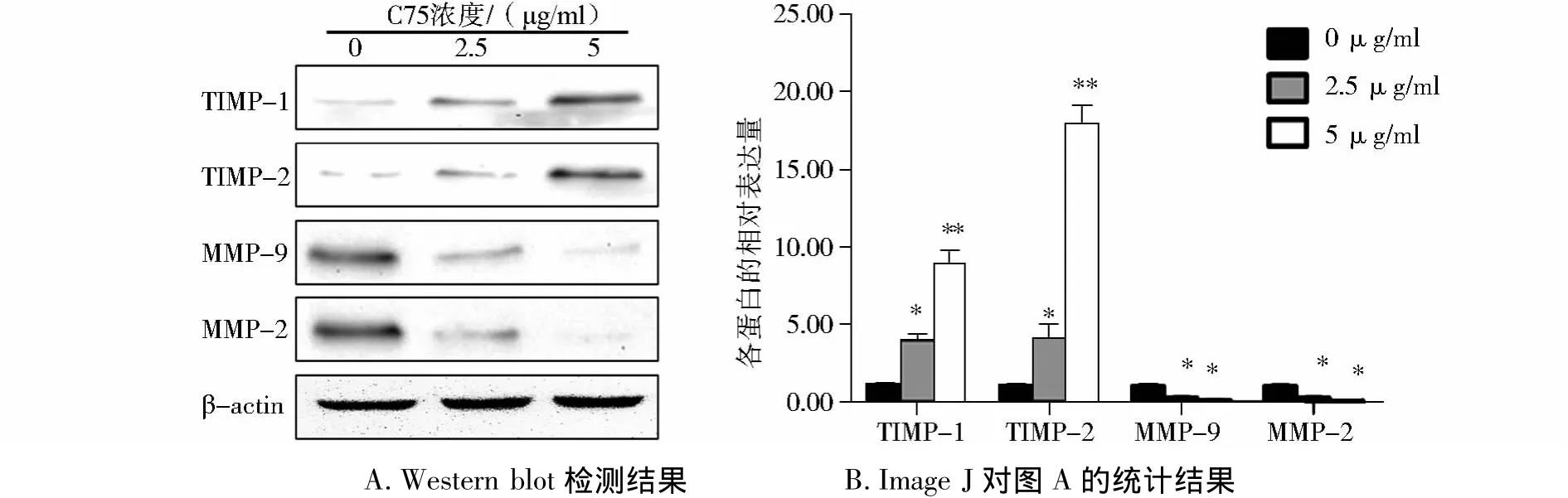
图6 不同浓度C75对MHCC97H细胞中MMPs及TIMPs蛋白表达的影响Figure 6 Effect of C75 on the expression of MMPs and TIMPs in MHCC97H cells
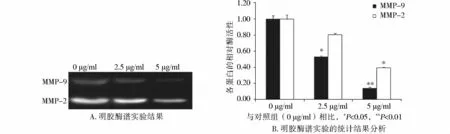
图7 不同浓度C75对MHCC97H细胞中MMPs酶活性的影响Figure 7 Effect of C75 on the proteinase activities of MMPs in MHCC97H cells
3 讨论
研究发现,FAS抑制剂C75对多种恶性肿瘤细胞具有明确的抑制作用,并认为FAS极有可能会成为新的抗肿瘤治疗靶标[10-17]。本研究发现,在浓度大于10 μg/ml时,C75能够抑制肝癌细胞 MHCC97H的增殖,这与先前研究结果相似[8]。由于对药物抗侵袭能力的研究多在其无明显抗增殖作用的剂量下进行,所以后续实验均在低于此浓度的范围内进行。
肝癌易发生转移,一旦发生转移又缺乏有效的治疗手段,所以肝癌的发病率和死亡率均较高 。目前,治疗肝癌细胞侵袭转移的药物成为研究的热点。本实验的目的就是探讨C75对肝癌细胞的侵袭转移的抑制作用。细胞选用了具有高侵袭转移能力的MHCC97H细胞[7]。对肿瘤细胞侵袭转移能力的体外检测实验多采取划痕实验和Transwell小室。本研究也采用了这两种检测方式,结果发现在无C75干预的情况下,MHCC97H细胞的迁徙和侵袭能力均较强。在划痕实验中,24 h后的划痕基本愈合,Transwell小室中细胞穿过的数目也较多。但经C75干预后,MHCC97H细胞的迁徙能力和侵袭能力均明显下降(图2,3)。说明C75能够抑制肝癌细胞的侵袭转移。
MMP及其抑制剂TIMP在肝癌的侵袭转移过程中发挥重要的作用。MMP能够降解细胞外间质,以利于肿瘤细胞的迁徙和侵袭[3]。肿瘤细胞通过增加MMP的表达及其活性,并降低TIMP的活性,使得肿瘤细胞获得较强的侵袭能力[18]。研究发现,肿瘤患者血清中MMP浓度升高,且TIMP的浓度降低,这也预示着MMP/TIMP平衡与肝癌的发生发展有着密切的关联[19]。为了探讨C75抑制肝癌细胞侵袭转移的机制,我们检测了C75对肝癌细胞中MMP的表达和活性,以及TIMP表达的影响。结果显示,C75能够抑制MHCC97H中MMP的表达和活性,同时促进TIMP的表达。
综上,本研究发现C75能够抑制肝癌细胞的侵袭转移,这种作用与其对MMP/TIMP平衡的调节相关。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics 2002[J].Cancer J Clin,2005,55(2):74-108.
[2] Lovet JM,Di Bisceglie AM,Bruix J,et al.Design and endpoints of clinical trials in hepatocellular carcinoma[J].J Natl Cancer Inst,2008,100(10):698-711.
[3] Gialeli C,Theocharis AD,Karamanos NK.Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting[J].FEBS J,2011,278(1):16-27.
[4] Evert M,Schneider-Stock R,Dombrowski F.Overexpression of fatty acid synthase in chemically and hormonally induced hepatocarcinogenesis of the rat[J].Lab Invest,2005,85(1):99-108.
[5] Semenkovich CF,Coleman T,Goforth R.Physiologic concentrations of glucose regulate fatty acid synthase activity in HepG2 cells by mediating fatty acid synthase mRNA stability[J].J Biol Chem,1993,268(10):6961-6970.
[6] Baron A,Migita T,Tang D,et al.Fatty acid synthase:A metabolic oncogene in prostate cancer[J]?J Cell Biochem,2004,91(1):47-53.
[7] ,Tang ZY,Ye SL,et al.New human hepatocellular carcinoma(HCC)cell line with highly metastatic potential(MHCC97)and its expressions of the factors associated with metastasis[J].Br J Cancer,1999,81(5):814 – 821.
[8] Jin Q,Yuan LX,Boulbes D,et al.Fatty acid synthase phosphorylation:a novel therapeutic target in HER2-overexpressing breast cancer cells[J].Breast Cancer Res,2010,12(6):R96.
[9] Kuhajda FP.Fatty-acid synthase and human cancer:New perspectives on its role in tumor biology[J].Nutrition,2000,16(3):202-208.
[10] Visca P,Alo PL,Del Nonno F,et al.Immunohistochemical expression of fatty acid synthase,apoptotic-regulating genes,proliferating factors,and ras protein product in colorectal adenomas,carcinomas,and adjacent nonneoplastic mucosa[J].Clin Cancer Res,1999,5(12):4111-4118.
[11] Gao Y,Lin LP,Zhu CH,et al.Growth Arrest Induced by C75,A fatty acid synthase inhibitor,was partially modulated by p38 MAPK but not by p53 in human hepatocellular c arcinoma[J].Cancer Biol Ther,2006,5(8):978-985.
[12] De Schrijver E,Brusselmans K,Heyns W,et al.RNA interference-mediated silencing of the fatty acid synthase gene attenuates growth and induces morphological changes and apoptosis of LNCaP prostate cancer cells[J].Cancer Res,2003,63(13):3799-3804.
[13] Menendez JA,Vellon L,Mehmi I,et al.Inhibition of fatty acid synthase(FAS)suppresses HER2/neu(erbB-2)oncogene overexpression in cancer cells[J].Proc Natl Acad Sci USA,2004,101(29):10715-10720.
[14] Li JN,Gorospe M,Chrest FJ,et al.Pharmacological inhibition of fatty acid synthase activity produces both cytostatic and cytotoxic effects modulated by p53[J].Cancer Res,2001,61(4):1493-1499.
[15] Knowles LM,Axelrod F,Browne CD,et al.A fatty acid synthase blockade induces tumor cell-cycle arrest by down-regulating Skp2[J].J Biol Chem,2004,279(29):30540-30545.
[16] Alli PM,Pinn ML,Jaffee EM,et al.Fatty acid synthase inhibitors are chemopreventive for mammary cancer in neu-N transgenic mice[J].Oncogene,2004,24(1):39-46.
[17] Lu S,Archer MC.Fatty acid synthase is a potential molecular target for the chemoprevention of breast cancer[J].Carcinogenesis,2005,26(1):153-7.
[18] Kim J,Yu W,Kovalski K,et al.Requirement for specific proteases in cancer cell intravasation as revealed by a novel semiquantitative PCR-based assay[J].Cell,1998,94(3):353-362.
[19] Giannelli G,Bergamini C,Marinosci F,et al.Clinical role of MMP-2/TIMP-2 imbalance in hepatocellular carcinoma[J].Int J Cancer,2002,97(4):425-431.

