盐酸吡咯列酮对动脉粥样硬化兔主动脉基质金属蛋白酶-9表达的影响
姚晓伟,潘军强,周 鑫,韩稳琦,李国良(陕西省人民医院心脏内二科,西安 70068;西安交通大学第一附属医院心血管内科;通讯作者,E-mail:xiaowei_yao@cn.com)
动脉粥样硬化(atherosclerosis,AS)相关疾病是目前人群死亡的首位原因,在我国发病率、致残率和死亡率呈逐年上升趋势,目前公认为AS是一种大、中型动脉血管的慢性非特异性炎症病变[1]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一类依赖于锌、钙离子的内肽酶[2],至少已发现有23个成员[3],MMP-9是其家族成员之一。相关研究报道,MMP-9可能通过炎症反应促进动脉粥样硬化斑块破裂[4],在动脉粥样硬化的发生、发展过程中起重要作用[5]。吡格列酮属于噻唑烷二酮类药物,是近年来备受推崇的一类治疗糖尿病的新药,相关研究表明其可通过激动过氧化物酶体增殖物激活受体-γ (peroxisome proliferator-activated receptor-γ,PPAR-γ)而抑制许多炎症因子的转录,表现出抗AS作用[6-9]。本研究以 AS易感动物,遗传性高脂血症(Watanabe heritable hyperlipidemic,WHHL)兔为研究对象,给予高胆固醇饮食同时建立动脉粥样硬化模型后观察新型噻唑烷二酮类药物盐酸吡格列酮对兔动脉粥样硬化斑块内MMP-9表达的影响,探讨噻唑烷二酮类药物抗动脉粥样硬化的作用机制,为此类药物用于人类动脉粥样硬化的预防和治疗提供研究基础。
1 材料与方法
1.1 实验动物及药品
本组选择新西兰兔36只,雄性,1月龄,体重1.3-1.6 kg,购自西安交通大学实验动物中心。将兔实验室适应性喂养普通饲料1周后,称重,随机分为3组:正常对照组12只,饲喂正常饲料120 g/d;高胆固醇饮食组12只,饲喂高胆固醇饲料120 g/d;高胆固醇饮食加吡咯列酮组12只,高胆固醇饲料120 g/d+吡格列酮8 mg/(kg·d)灌胃,喂养8周后处死各组动物。高胆固醇饲料按照西方饮食饲料配方:胆固醇2%,蛋黄粉5%,猪油8%,基础饲料85%。盐酸吡格列酮片(瑞彤),江苏恒瑞医药股份有限公司生产,批准文号:国药准字H20040631,15 mg/片。生产批号:08042151。
1.2 试剂及仪器
基质金属蛋白酶-9抗体(anti-MMP-9),产品规格:浓缩液(1 mg/ml)亲和纯化抗体,产品编号:bs-0397R,北京博奥森生物技术有限公司。PV-6000通用型二步法免疫酶标组织化学染色检测试剂盒,北京中杉金桥生物技术有限公司。0.01 mol/L PBS缓冲液,北京中杉金桥生物技术有限公司。0.01 mol/L枸橼酸盐缓冲液,北京中杉金桥生物技术有限公司。光学显微镜(BX-51型)OLYMPUS,Japan。病理图文分析系统PIPS2000,重庆天海医疗设备有限公司。
1.3 标本取材及留取
以上各组实验动物分别在预定实验终点给予耳缘静脉注射3%戊巴比妥钠30 mg/kg全身麻醉后左心室取血5 ml并注入空气20 ml空气栓塞处死动物。血液注入不含抗凝剂普通试管,静置后离心分离血清。立即开胸并剪开右心房,自左心室灌注福尔马林固定主动脉;分离主动脉,取出从近主动脉弓部到髂动脉分叉处全部主动脉,清除血管外组织,生理盐水冲洗,置于中性甲醛缓冲液中固定。
1.4 HE染色及Masson染色镜下观察
对各组兔的主动脉进行HE染色,镜下观察病理切片形态,泡沫细胞数量及形态,纤维帽形成,胶原纤维增殖及融合,病灶深部可见坏死崩溃物等情况,从HE染色片上随机选取5个视野,利用朗珈PAS9000病理分析系统对主动脉内膜、中膜厚度及内膜/中膜(IMT)进行测量。通过Masson染色观察动脉硬化分级:0级,正常血管;1级,少于50%的外膜受累,内膜增生占管腔不超过20%;2级,50%-100%的外膜受累轻度纤维化,内膜增生不超过管腔的20%;3级,100%外膜受累,中度纤维化,内膜增生占管腔的20%-50%;4级,100%外膜受累,重度纤维化,内膜增生达管腔的50%-80%;5级,全部管腔闭锁。
1.5 MMP-9免疫组化特异性染色镜下观察
免疫组织化学染色法观察主动脉血管内皮MMP-9表达。结果判定:MMP-9阳性表达为细胞质内或细胞膜棕黄色颗粒,随机选取4个视野,200倍镜下观察,图像分析采用病理组织实时摄像显微镜系统摄像,并使用图像分析软件分析阳性面积百分比。
1.6 统计学分析
2 结果
2.1 三组间动脉壁及AS斑块HE染色的比较
正常对照组动脉内膜结构完整,内皮下无脂质沉积或斑块形成。高胆固醇饮食组,主动脉内皮细胞明显减少,内膜显著增厚,内膜下的脂质沉积明显,脂质斑块及纤维帽形成,纤维帽下可见大量坏死崩解物质,斑块底部少量肉芽组织,少量淋巴细胞及泡沫细胞,血管平滑肌排列紊乱,中膜因斑块压迫、SMC萎缩,弹力纤维破坏变薄。高胆固醇饮食加吡咯列酮组主动脉板块表面大量SMC和细胞外基质构成的纤维帽,其下可见数量不等的泡沫细胞及炎细胞,内皮细胞轻度减少;内膜增厚,内膜下有脂质沉积,可见血管平滑肌细胞增生,排列较规整,核略肿胀,弹力纤维、胶原纤维轻度增生(图1)。
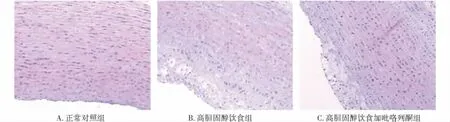
图1 不同组别动脉壁及动脉粥样硬化斑块HE染色 (×100)Figure 1 Hematoxylin staining of arterial wall and aortic AS plaque in three groups (HE,×100)
2.2 三组间动脉壁及AS斑块Masson染色比较
正常对照组动物主动脉硬化为0级,高胆固醇饮食组动物主动脉硬化4级以上,高胆固醇饮食加吡咯列酮组主动脉硬化3-4级(图2)。
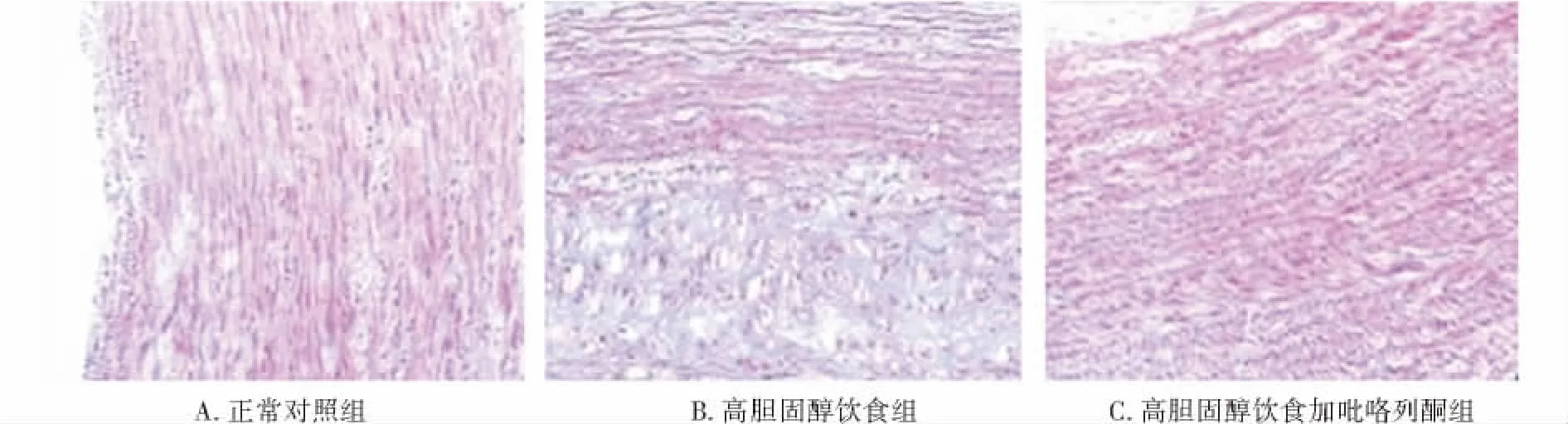
图2 动脉壁及动脉粥样硬化斑块Masson染色 (×100)Figure 2 Masson staining of arterial wall and aortic AS plaque in three groups (Masson staining,×100)
2.3 三组间MMP-9特异性染色表达阳性面积比比较
高胆固醇饮食加吡咯列酮组、高胆固醇饮食组MMP-9阳性面积比(阳性染色面积/斑块总面积)明显高于正常对照组,差异有统计学意义(P<0.01);高胆固醇饮食加吡咯列酮组MMP-9阳性面积比明显低于高胆固醇饮食组,差异有统计学意义(P<0.05,见表1,图3)。
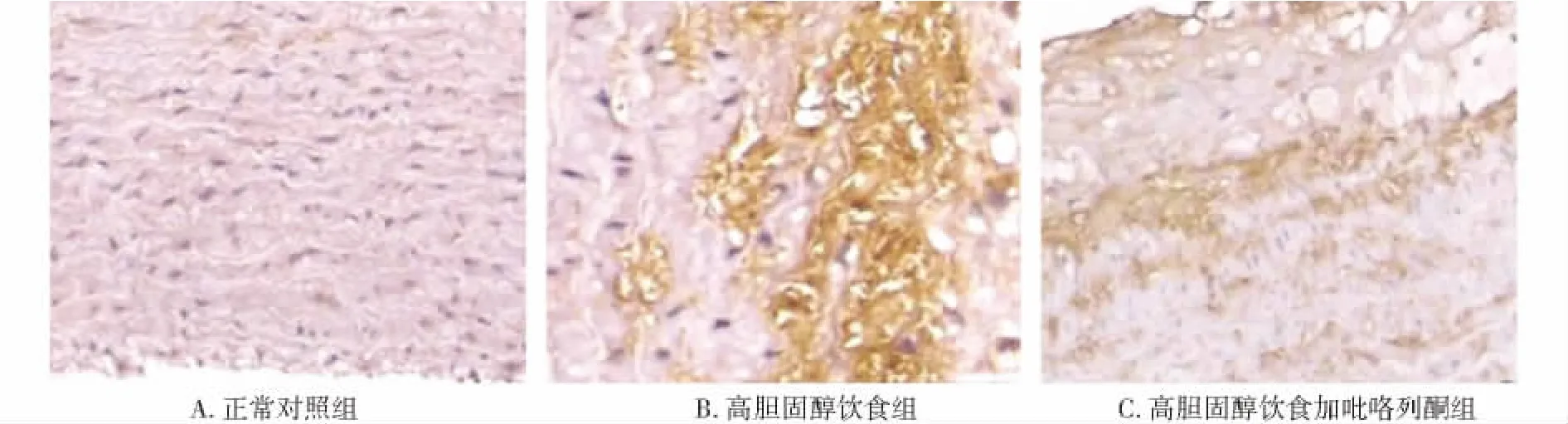
图3 动脉壁及动脉粥样硬化斑块MMP-9表达 (×200)Figure 3 Expression of MMP-9 in aortic AS plaque area in three groups (immunohistochemical staining,×200)
表1三组间动脉粥样斑块内MMP-9表达阳性面积比(±s,%)Table 1MMP-9 positive area ratio in aortic AS plaque area(±s,%)
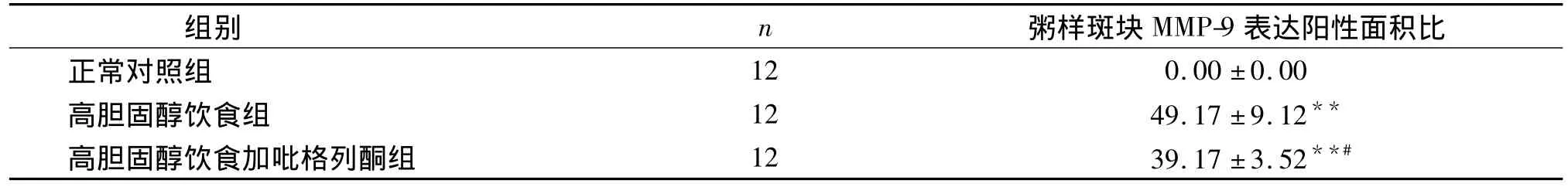
表1三组间动脉粥样斑块内MMP-9表达阳性面积比(±s,%)Table 1MMP-9 positive area ratio in aortic AS plaque area(±s,%)
与正常对照组比较,**P<0.01;与高胆固醇饮食组比较,#P<0.05
组别 n 粥样斑块MMP-9表达阳性面积比正常对照组12 0.00 ±0.00高胆固醇饮食组 12 49.17 ±9.12**高胆固醇饮食加吡格列酮组 12 39.17 ±3.52**#
3 讨论
研究表明,MMP-9在不稳定斑块中特别是易发生破裂的斑块肩部区域含量较高,酶活性明显增高,是造成不稳定斑块破裂的主要因素[10,11]。MMP-9是很多生理过程的关键调节剂,病理情况下MMP-9被激活,其表达上调,在动脉粥样硬化斑块的形成、发展及破裂中发挥重要作用,这主要通过血管中膜平滑肌细胞迁移、增殖、凋亡及细胞外基质的重塑实现的。
大量的实验表明,PPAR-γ及其配体在巨噬细胞、血管内皮细胞、平滑肌细胞中均有表达,具有直接的血管效应,激活后可直接在血管壁水平拮抗上述病理作用。吡格列酮是人工合成特异性PPAR-γ激动剂,也是临床上用于治疗2型糖尿病的口服降糖药,近年来的研究表明,吡格列酮抗动脉粥样硬化的直接效应包括增加一氧化氮的生物利用度,减少白细胞和内皮细胞的相互作用,减少血管平滑肌细胞的迁移和增殖及巨噬细胞中胆固醇的外流[12]。此外,PPAR-γ激活后也可通过脂肪组织间接调控基因表达发挥抗炎作用。
相关研究证实,吡格列酮可剂量依赖性抑制单核细胞源的巨噬细胞MMP-9的mRNA及其蛋白的表达和活性[13];罗格列酮对糖尿病合并冠心病患者的血浆MMP-9水平有明显降低作用[14]。本实验结果显示,正常新西兰兔进食高胆固醇饲料后,主动脉粥样斑块内MMP-9表达阳性面积比明显升高,高胆固醇饮食加吡咯列酮组粥样斑块内MMP-9表达阳性面积少于高胆固醇饮食组。即预防性服用吡格列酮可在一定程度上使主动脉粥样斑块内MMP-9表达阳性面积水平下调。这与目前的相关报道一致,随着对AS发病机制分子水平研究的不断深入,有关吡格列酮对MMP-9的影响及在抗AS中的作用将成为新的研究热点。
[1] Ross R.Atherosclerosis:an inflammatory disease[J].N Eng J Med,1999,340:115-126.
[2] Argmann CA,Sawyez CG,Mcneil CJ,et al.Activation of peroxisome proliferator-activated receptor gamma and retinoid X receptor results in net depletion of cellular cholestery l esters in macrophages exposed to oxidized lipoproteins[J].Arterioscler Thromb Vasc Biol,2003,23:475-482.
[3] Baror A,Nuttall RK,Duddy M,et al.Analyses of all matrix metalloproteinase members in leukocytes emphasize monocytes as major inflammatory mediators in multiple sclerosis[J].Brain,2003,126(12):2738-2749.
[4] Romero JR,Vasan RS,Beiser AS,et al.Association of carotid artery atherosclerosis with circulating biomarkers of extracellular matrix remodeling:the Framingham Offspring Study[J].J Stroke Cerebrovasc Dis,2008,17(6):412-417.
[5] Brunner S,Kim JO,Methe H.Relation of matrix metallo-proteinase-9/tissue inhibitor of metalloproteinase-1 ratio in peripheral circulating CD14+monocytes to progression of coronary artery disease[J].Am J Cardiol,2010,105(4):429-434.
[6] Minamikawa J,Tanaka S,Yamauchi M,et al.Potent inhibitory effect of troglitazone on carotid arterial wall thickness in type 2 diabetes[J].J Clin Endocrinol Metab,1998,83:1818-1820.
[7] ,Wu H,Willerson JT,et al.Modulation of vascular inflammation in vitro and in vivo by peroxisome peroliferator-activated receptor-γ activators[J].Circulation,2000,101:235-238.
[8] Ricote M,Li AC,Willson TM,et al.The peroxisome proliferatorsactivated receptor γ is a negative regulator of macrophage activation[J].Nature,1998,391:79-82.
[9] Murao K,Imachi H,Momoi A,et al.Thiazolidinedione inhibits the production of monocyte chemoattractant protein-1 in cytokine treated human vascular endothelial cells[J].FEBS Lett,1999,454:27-30.
[10] Lin RT,Chen CH,Tsai PC,et al.Sex-specific effect of matrix metalloproteinase-9 functional promoter polymorphism on carotid artery stiffness[J].Atherosclerosis,2012,223(2):416-420.
[11] Loftus IM,Naylor AR,Goodall S,et al.Increased matrix metalloproteinase-9 activity in unstable carotid plague.A potential role on acute plaque disruption[J].Stroke,2003,31(1):40-47.
[12] Wijk JP,Rabelink TJ.Impact of thiazolidinedione therapy on atherogenesis[J].Curr Atheroscler Rep,2005,7(5):369-374.
[13] Shiomi M,Ito T,Tsukada T,et al.Fibromuscuiar cap composition is important for the stability of established atherosclerotic plaques in mature WHHL rabbits treated with statins[J].Atherosclerosis,1999,142(2):345-353.
[14] Nikolaus M,Johannes F,Laila S,et al.Anti-diabetic PPARγ-activator rosiglitazone reduces MMP-9 serum levels in type-2 diabetic patients with coronary artery disease[J].Arterioscler Thromb Vasc Biol,2003,23:283-287.

