TRPC6对大鼠肺动脉平滑肌细胞增殖、侵袭和凋亡能力的影响
王小闯,李满祥,党晓燕,李 萍,彭 卓,高彦霞,古长维,姚 洋(西安交通大学医学院第二附属
肺动脉高压(pulmonary artery hypertension,PAH),特别是继发于慢性呼吸系统疾病的继发性肺动脉高压,是常见的临床综合征[1]。未经治疗的肺动脉高压多数死于肺源性心脏病右心衰竭[2]。由于导致继发性肺动脉高压的原发性呼吸系统疾病具有反复发作或者难以根治的特点,因此预防及治疗肺动脉高压有着十分重要的临床意义。不论是原发性或继发性肺动脉高压,其发生、发展有着共同的分子机制,即肺血管的紧张性增高和肺动脉壁的结构性重塑。现普遍认为肺血管平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)的增殖、侵袭和凋亡在PAH发生中起着关键性的作用[3,4]。
钙离子是细胞内的第二信使,它调节细胞的多种生物学行为,如细胞增殖和细胞周期。作为钙离子进入细胞内的主要门户,钙离子通道在调节细胞增殖和细胞周期方面的作用逐渐被人们认识。瞬时受体电势通道是一类离子通道,可通透钙离子,起初在果蝇中被发现;突变体果蝇的视觉受体对持续性光刺激仅表现出瞬时的受体电势,所以钙通道由此而得名[5]。经典型瞬时受体电位6(transient receptor potential canonical 6,TRPC6)即为其中之一,它广泛表达于多种组织[6-8]。研究表明,在原发性及继发性肺动脉高压患者或动物模型中,肺血管平滑肌细胞膜TRPC6的表达明显升高[9]。但目前尚未有文献报道TRPC6对RPASMCs的生物学功能的影响。因此,本研究以RPASMCs为对象,构建TRPC6的siRNA以及过表达载体,转入细胞后采用MTT、Transwell小室实验和流式细胞仪等方法研究TRPC6对RPASMCs增殖、迁移和凋亡的影响,拟探讨TRPC6在PAH病变中的作用,为肺动脉高压的治疗提供新的思路。
1 材料与方法
1.1 主要试剂和材料
CO2细胞培养箱(Binder,德国);酶联免疫检测仪(Sheldon,美国);流式细胞仪(Olympus,日本);RNAiso plus kit、PrimeScript®RT reagent kit、SYBR®Premix Ex TaqTMⅡ kit,限制性内切酶EcoRⅠ、XhoⅠ,T4 连接酶;载体 pMD19-T、pcDNA3(Takara,中国),LipofectamineTMRNAiMAX(Invitrogen,美国);Bio-Rad iQ5实时定量PCR仪、激光共聚焦显微镜(Bio-Rad,美国);BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒、抗β-肌动蛋白抗体、抗TRPC6抗体、辣根过氧化物酶标记羊抗兔 IgG(Abcam,美国);M254 培养基、MTT、DMSO、TBST 缓冲液、胎牛血清(FCS)、碘化吡啶(GIBCO BRL,美国)。
1.2 大鼠PASMCs的分离与培养
雄性SD大鼠经戊巴比妥麻醉后剖胸,右心室注入500 U肝素,整体取出心、肺置于平皿中,以无钙Hanks液清洗3遍。显微镜下自肺动脉主干逐级追入肺实质,取3级以下分支,无钙Hanks液清洗3遍。于37℃ CO2培养箱中消化90 min。经消化的细胞加入含10%FBS的DMEM培养液配成1×105/ml的细胞悬液,倒置于CO2孵箱中3 h,待组织块贴壁牢固后,翻正培养瓶使组织块完全浸泡在培养液中,放入CO2孵箱继续培养4 d后,于倒置显微镜下观察细胞生长情况。待原代细胞生长至汇合状态、铺满瓶壁的80%以上时,进行传代。实验用4-7代平滑肌细胞。
1.3 真核表达载体的构建及转染
以实验室保存的TRPC6序列为模板,以TRPC6引物扩增TRPC6目的片段,其上游引物序列5’-AAGACACTGTTCTATATT-3’,下游引物序列5’-TGCACCAGATTGAAGGGA ACAGG-3’。将目的片段与pMD19-T载体在16℃条件下进行连接反应,并将连接产物转化于感受态大肠杆菌DH5α,培养后进行筛选,挑选阳性菌落摇菌并提取质粒,电泳鉴定后获得重组质粒pMD19T-TRPC6。以重组质粒为模板,扩增TRPC6编码区序列,扩增产物以EcoRⅠ、XhoⅠ双酶切,并用T4DNA连接酶将其与经相同酶切的真核表达载体pcDNA3连接,筛选获得重组表达载体pcDNA3-TRPC6。
TRPC6-siRNA由上海生工合成,其上游引物序列5’-GACCUAGCAGAACUUAUUA-3’,下游引物序列 5’-UAAUAAGUUCUGCUAGGUC-3’;对照为 TRPC6非特异 siRNA,上游引物序列5’-UUCCCCGAACGU GUCACG U-3’,下游引物序列5’-ACGUGACACGUUCGGAGAA-3’。实验组加入TRPC6-siRNA混合物或重组表达载体pcDNA3-TRPC6,同时设置空白对照组(control)和脂质体对照组(mock)。按5×104/孔密度接种RPASMCs至24孔培养板中,待其长至60%融合时,采用LipofetamineTM2000将TRPC6-siRNA或重组表达载体pcDNA3-TRPC6转染细胞。24 h后采用 Western blot检测各组的转染效率。
1.4 Western blot检测
收集各组稳定转染的细胞,用组织蛋白裂解液提取各组细胞的总蛋白,采用BCA试剂盒测定蛋白浓度。取40 μg总蛋白进行常规SDS-PAGE电泳。经电泳后转移至PVDF膜,10%脱脂奶粉4℃封闭PVDF膜过夜,加10%脱脂奶粉稀释的一抗加于膜上,室温反应60 min;用 TBST缓冲液(0.05 mol/L Tris,0.15 mol/L NaCl,0.05%Tween 20)洗膜10 min ×3次;加二抗37℃孵育45 min,TBST缓冲液洗膜10 min×3次,滴加ECL试剂,将PVDF膜放入X线片暗盒,在暗室中压片,显影。以β-actin作为内参。
1.5 RNA的提取与实时定量RT-PCR
采用RNAiso plus kit试剂盒提取细胞中的总RNA,按照试剂盒要求操作。TRPC6上游引物5’-CACCGGCGGCAGACAGTTCTTCG-3’,下游引物序列5’-CTTGCTGGAGTTCAGACTGGCTGG G-3’。β-actin上游引物序列5’-GGTGTGATGGTGGGTATGGGT-3’,下游引物序列 5’-CTGGGTCATCTTTTCACGGT-3’。按照试剂盒的说明书进行RT-PCR。扩增条件为:预变性94℃ 5 min,进入循环,变性94℃ 1 min,退火60℃ 1 min,延伸72℃3 min,30 个循环后,72 ℃延伸5 min。依据2-ΔΔCt法计算control组、mock组、TRPC6-overexpression组及TRPC6-siRNA组细胞TRPC6 mRNA的相对表达量。
1.6 MTT法测定RPASMCs增殖
分别取对数生长期RPASMCs接种于96孔培养板,每孔1 ×104,共 100 μl,每组 3 孔,置于 37 ℃、5%CO2孵箱中培养48 h。0.25%胰酶消化control组、mock组、TRPC6-overexpression组及 TRPC6-siRNA组细胞,吸去胰酶,加入正常培养液继续培养60 min。每孔加入 MTT溶液(5 mg/ml)20 μl,继续孵育4 h,弃上清,每孔加入150 μl DMSO,振荡10 min后进行比色测定,酶联免疫检测仪在490 nm波长读取OD值。
1.7 Transwell法检测细胞侵袭能力
将培养的RPASMCs消化成单细胞悬液,无血清培养基洗3次,将细胞悬液密度调整成2×105/ml备用。预先将Matrigel用无血清培养基DMEM稀释成1∶3浓度,均匀地铺满Transwell小室上室的聚碳酸酯膜,室温放置1 h,使Matrigel凝固形成基质膜。Transwell下腔小室加入500 μl含10%胎牛血清的DMEM培养基,小室内接种200 μl无血清细胞悬液,培养20 h后取出Transwell膜,预冷的PBS洗涤2次,4%多聚甲醛固定15 min,0.1%结晶紫染色10 min,显微镜下拍照,统计穿过Transwell膜的细胞数。
1.8 流式细胞仪检测细胞凋亡
用预冷的PBS洗涤PASMCs 3次,加入1 ml 1×AnnexinⅤ结合缓冲液,离心去上清,再加入200 μl结合缓冲液重悬细胞,分别加入10 μl AnnexinⅤ-FITC 和 5 μl PI(5 μg/ml),轻轻混匀,室温避光孵育20 min,进行流式细胞仪检测。
1.9 统计分析
2 结果
2.1 转染效率的测定
提取转染后各组细胞总RNA和蛋白,采用RTPCR和Western blot检测TRPC6 mRNA和蛋白的表达。RT-PCR结果显示,脂质体对照组(mock组)RPASMCs中TRPC6 mRNA表达水平较对照组无明显变化(见图1),而TRPC6过表达组RPASMCs中TRPC6 mRNA 表达水平为1.48 ±0.12,TRPC6-siRNA组RPASMCs中 TRPC6 mRNA表达水平为0.65±0.04,与对照组相比均具有统计学差异(P<0.05)。Western blot结果显示,与对照组相比,moc组RPASMCs中TRPC6蛋白表达水平几乎无变化(见图2),而TRPC6过表达组TRPC6蛋白表达水平明显上调,TRPC6-siRNA组TRPC6蛋白表达水平明显降低。
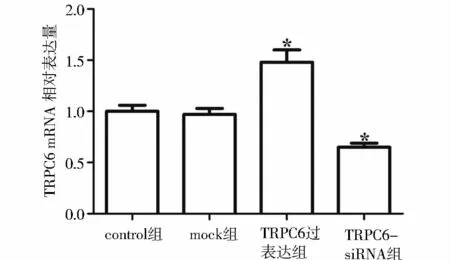
图1 各组TRPC6 mRNA表达的RT-PCR结果Figure 1 The TRPC6 mRNA expression in four goups by RT-PCR
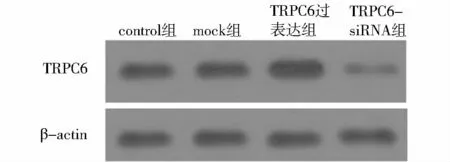
图2 各组TRPC6蛋白表达的Western blot结果Figure 2 Western blot results of TRPC6 protein expression in four groups
2.2 TRPC6促进RPASMCs的增殖
通过MTT法测定各组反应细胞数的OD值,结果显示,与对照组相比,mock组无显著变化;而TRPC6过表达组可以促进RPASMCs的增殖,其OD值为1.13 ±0.09,TRPC6-siRNA 组则可抑制 RPASMCs的增殖,其OD值为0.42±0.03,两组比较具有统计学差异(P<0.05,见图3)。
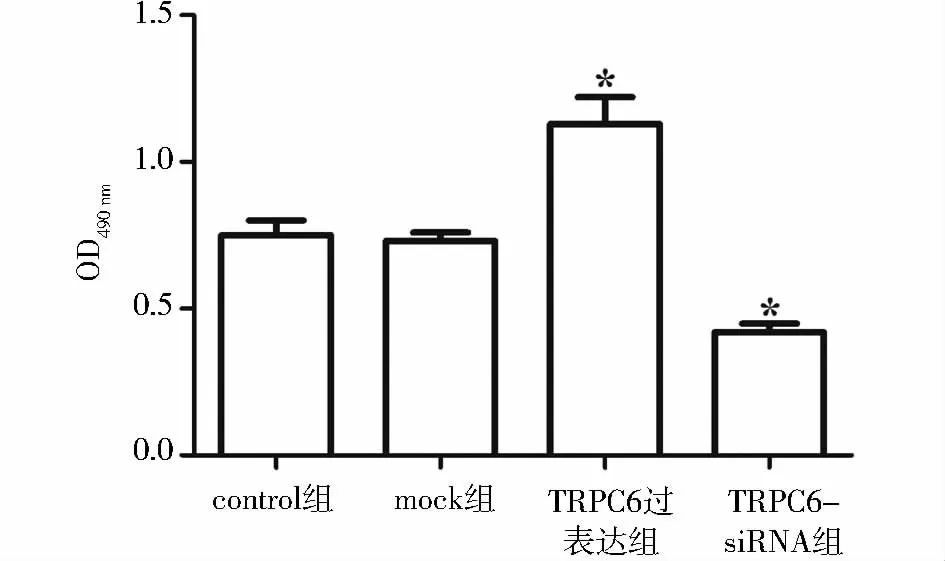
图3 TRPC6对RPASMCs增殖的影响Figure 3 The effect of TRPC6 on RPASMCs proliferation
2.3 TRPC6促进RPASMCs的侵袭
与对照组相比,mock组无显著变化;而TRPC6过表达组可以促进RPASMCs的侵袭,穿膜细胞数相应地增加,其值为108 ±7(P<0.05,见图4),TRPC6-siRNA组则可抑制RPASMCs的侵袭,穿膜细胞数相应地减少,其值为38±3,两组比较具有统计学差异(P<0.05)。
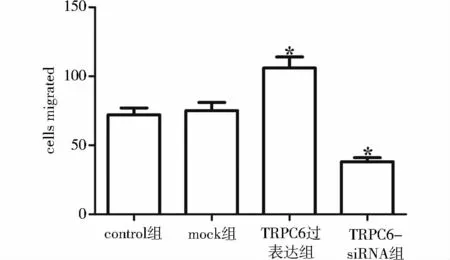
图4 TRPC6对RPASMCs侵袭的影响Figure 4 Effect of TRPC6 on RPASMCs invasion
2.4 TRPC6对RPASMCs凋亡的影响
采用流式细胞仪检测AnnexinⅤ/PI荧光强度,细胞凋亡图的左下象限为活细胞,左上象限为坏死细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞,将右下象限和右上象限之和记为细胞总凋亡率。与对照组相比,各实验组的总细胞凋亡率均无明显统计学差异(P>0.05,见图5)。
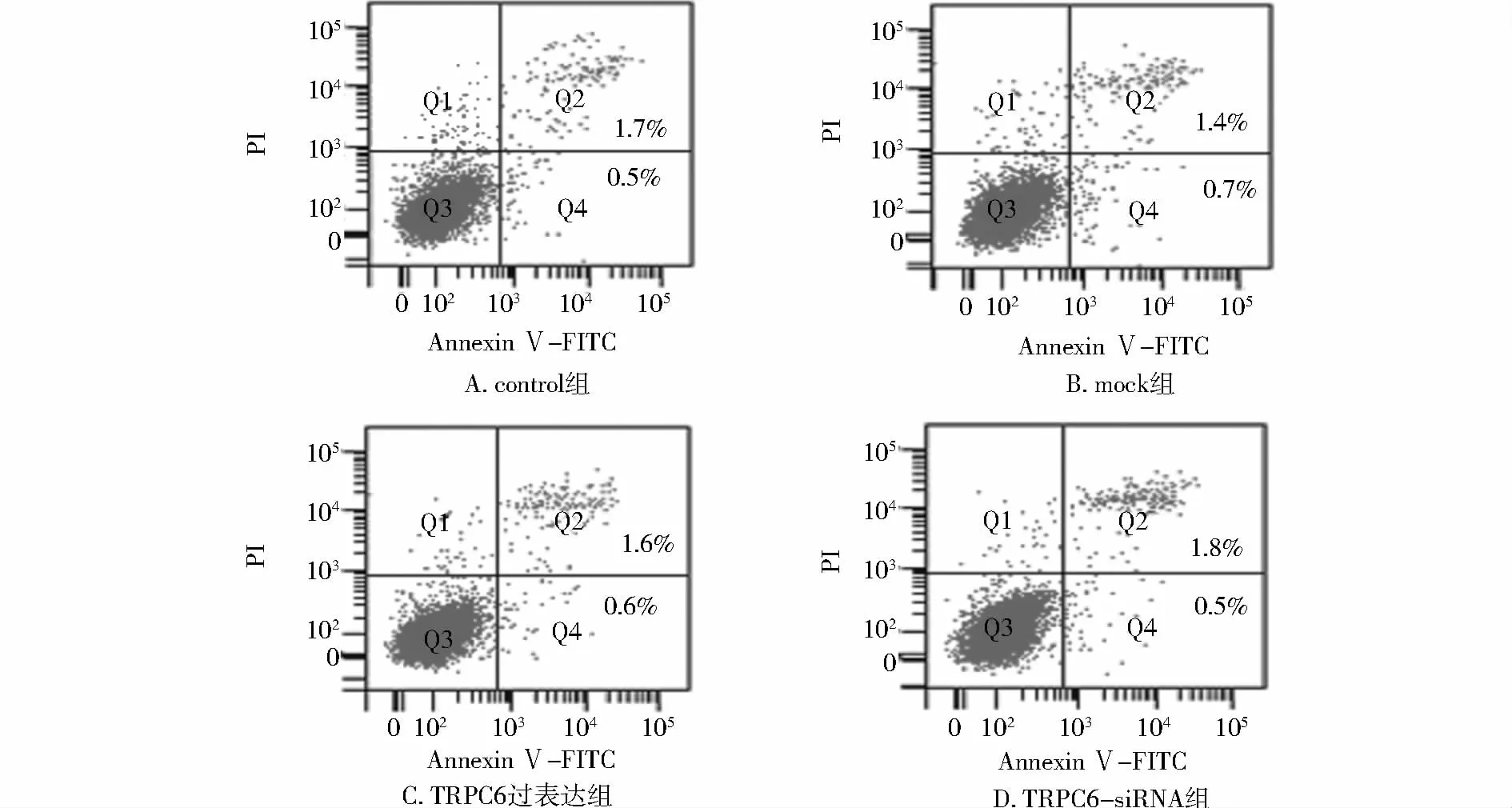
图5 TRPC6对RPASMCs凋亡的影响Figure 5 Effect of TRPC6 on RPASMCs apoptosis
3 讨论
PAH是一种严重威胁人类健康的临床症状,其病理过程主要有:肺小动脉闭塞及有效循环血管床数量的锐减,肺血管内皮细胞损伤引起血管收缩反应增强和PASMCs增生、侵袭,外周小血管肌化以及细胞外基质的增多,导致肺血管重塑[10]。其中,PASMCs的增殖和侵袭是肺血管重塑形成的主要因素。
通过本实验的研究,我们发现TRPC6过表达载体转染RPAMSCs后,RPAMSCs中TRPC6 mRNA及蛋白表达水平均上升,同时可促进RPAMSCs的增殖和侵袭;而 TRPC6-siRNA转染 RPAMSCs后,RPAMSCs中TRPC6 mRNA及蛋白表达水平均下降,同时可抑制RPAMSCs的增殖和侵袭。此外,流式细胞仪结果表明TRPC6对细胞凋亡并没有显著影响。综上所述,TRPC6可促进RPASMCs的增殖和侵袭,在PAH的发生中起着重要作用。
PASMCs增殖和凋亡失衡是肺动脉高压形成的主要原因。正常情况下,凋亡与增殖这两个对立面相互制约,共同维持着组织器官结构的相对稳定,一旦这种平衡在各种内因、外因的影响下被打破,将导致组织脏器萎缩、增生或构型重建等病理状态。本研究发现TRPC6可促进RPASMCs的增殖,而对细胞的凋亡基本无影响。这表明TRPC6影响PAH的发生主要通过调控RPASMCs的增殖和侵袭来实现。
文献报道,用血管紧张素Ⅱ刺激血管平滑肌细胞(VSMC)建立大鼠的VSMC增殖模型,采用MTT法检测不同浓度的TRPC6通道阻断剂和激动剂对VSMC的影响,研究发现,不同剂量阻断剂阻断TRPC6通道后,经过72 h的作用均可抑制介导血管紧张素Ⅱ诱导的VSMC的增殖,且呈剂量依赖性;用不同剂量TRPC6激动剂激活TRPC6通道,经过24 h的作用均可促进介导血管紧张素Ⅱ诱导的VSMC的增殖,并且呈剂量依赖性[11]。本研究结果也表明了TRPC6可促进 RPASMCs的增殖,提示 TRPC6在PAH的发生和发展中可能发挥着重要作用。此外,由于TRPC6还能够促进RPASMCs的侵袭,有望成为PAH治疗的潜在靶分子。虽然本研究证实了TRPC6在PAH中发挥着重要作用,但确切的信号途径尚不清楚,有待于进一步研究。
[1] Montani D,Günther S,Dorfmüller P,et al.Pulmonary arterial hypertension[J].Orphanet J Rare Dis,2013,8(1):97-148.
[2] Davies RJ,Morrell NW.Molecular mechanisms of pulmonary arterial hypertension:Role of mutations in the bone morphogenetic protein type II receptor[J].Chest,2008,134(6):1271-1277.
[3] Long L,Crosby A,Yang X,et al.Altered bone morphogenetic protein and transforming growth factor-β signaling in rat models of pulmonary hypertension [J].Circulation,2009,119(4):566-576.
[4] Liu Y,Tian H,Yan X,et al.Serotonin inhibits apoptosis of pulmonary artery smooth muscle cells through 5-HT2A receptors involved in the pulmonary artery remodeling of pulmonary artery hypertension[J].Exp Lung Res,2013,39(2):70-79.
[5] Kuwahara K,Wang Y,McAnally J,et al.TRPC6 fulfills a calcineurin signaling circuit during pathologic cardiac remodeling[J].J Clin Invest,2006,116(12):3114-3126.
[6] Yu Y,Sweeney M,Zhang S,et al.PDGF stimulates pulmonary vascular smooth muscle cell proliferation by upregulating TRPC6 expression [J].Am J Physiology-Cell Physiol,2003,284(2):C316-C330.
[7] Shi J,Mori E,Mori Y,et al.Multiple regulation by calcium of murine homologues of transient receptor potential proteins TRPC6 and TRPC7 expressed in HEK293 cells[J].J Physiol,2004,561(2):415-432.
[8] Abed E,Labelle D,Martineau C,et al.Expression of transient receptor potential(TRP)channels in human and murine osteoblast-like cells[J].Mol Membr Biol,2008,26(3):146-158.
[9] Zhang M,Liu X,Yang N,et al.TRPC6 mediates the enhancements of pulmonary arterial tone and intracellular Ca2+concentration of pulmonary arterial smooth muscle cells in pulmonary hypertension rats[J].J Physiol,2010,62(1):55-62.
[10] 王毅,解卫平.肺动脉高压发病机制的研究进展[J].临床肺科杂志,2010,15(11):1621-1623.
[11] 徐俊芳,赵乐章,柯道平,等.TRPC6介导血管紧张素Ⅱ诱导血管平滑肌细胞的增殖[J].安徽医科大学学报,2010,45(2):139-142.

