富血小板血浆对骨髓间充质干细胞向成骨细胞定向分化的影响
杜 刚,黄 克,李 林,梁红锁,唐 俊,李红波(广西医科大学第三附属医院骨一科,530031;通讯作者,E-mail:huangke_gx@126.com)
利用骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)联合骨组织工程学方法进行修复是当前骨缺损研究的热点[1]。BMSCs具有易体外获得、体外扩增速度快、较弱的免疫原性以及较强的组织修复能力等特点,可作为具有重要应用价值的种子细胞[2]。
富血小板血浆(platelet-rich plasma,PRP)是通过离心自体全血所得到的血小板浓缩物,血小板被激活后可释放出多种生长因子促进骨再生,具有促进细胞增殖、分化、趋化以及促进血管生成等多种生物活性[3]。利用PRP促进骨再生、修复骨缺损是骨修复研究的热点。本实验探索PRP对体外分离的兔BMSCs诱导为成骨细胞的作用机制,并评估其促进骨组织再生的效果。
1 材料及方法
1.1 材料
1.1.1 主要试剂与仪器 L-DMEM培养基(Gibico公司)、F12-DMEM培养基及胎牛血清(Hyclone公司)、Ficoll淋巴细胞分离液(TBD,比重1.077 g/L)、CD34-PE和 CD45-PE抗体(Santa Cruz公司)、CD105-FITC抗体(BD公司)、Trizol(Invitrogen公司)、M-MLV反转录试剂盒(Promega公司)、流式细胞仪(Calibur,BD公司)及细胞培养箱(Thermo公司),兔OCN ELISA检测试剂盒(westang公司),兔CTGF ELISA检测试剂盒(Bio Ripid公司)。
1.1.2 实验动物 普通级健康新西兰大耳白兔10只,雌性,兔龄约为3个月,体重1.5-2 kg,购自山东省农科院提供,许可证号:SCXK[鲁]20040013。
1.2 方法
1.2.1 兔来源骨髓间充质干细胞的获取 3%戊巴比妥钠(30 mg/kg)对兔耳缘静脉麻醉,穿刺股骨髁突,在无菌条件下采集兔红骨髓3 ml,加入1.077 g/L Ficoll分离液3 ml至华氏管中,4℃,3 000 r/min,离心30 min,弃上清,吸中间乳白色样单核细胞,培养基重悬后1 000 r/min,离心5 min,弃上清,重悬于含10%FBS的F12-DMEM培养液中,按1×105/ml接种六孔板3 ml,37℃,5%CO2饱和湿度培养箱孵育48 h后全量换液,此后每周两次全量换液,待细胞生长至培养板的80%-90%时进行消化传代、冻存。
1.2.2 流式细胞术检测骨髓间充质干细胞表型用胰蛋白酶分别消化BMSCs,分别加入下列鼠抗兔单克隆抗体:CD34-PE,CD45-PE,CD105-FITC,使用直接法标记 CD34和 CD45,使用间接法标记CD105,4℃孵育30 min,PBS洗2遍,流式细胞仪检测BMSCs细胞表面抗原。
1.2.3 获取兔血小板血浆并浓缩成指定体积分数3%戊巴比妥钠(30 mg/kg)对兔耳缘静脉麻醉,抽取静脉10 ml血液,摇匀后置于离心管中,以1 000 r/min的速度离心15 min,吸取全部上清液及交界面下1-2 mm的红细胞至另一个离心管,再以3 000 r/min的速度离心8 min。弃上清液上3/4,轻轻振荡,获取血小板血浆。将血小板血浆与激活剂(牛凝血酶及10%的氯化钙混合物)以9∶1的比例混合、振荡,4℃冰箱过夜。待血凝块充分收缩后,重离心10 min,吸取富含复合生长因子的血小板血浆上清液,加入含100 U/ml青霉素、100 mg/L链霉素的无血清L-DMEM培养基,分别稀释成5%和10%两个体积梯度备用。
1.2.4 骨髓间充质干细胞诱导分化成骨细胞 将BMSCs细胞以1×106/孔接种于6孔板中,阴性对照组中加入200 μl的L-DMEM培养液,阳性对照组加入 200 μl的 L-DMEM 培养液(含终浓度0.1 μmol/L地塞米松,终浓度0.05 mmol/L抗坏血酸磷酸盐,终浓度10 mmol/L甘油磷酸钠,实验组中分别加入200 μl含5%和10%PRP的L-DMEM培养液,建立起BMSCs与PRP的共培养体系,置37℃ 5%CO2孵箱中培养,每3 d按照上述步骤更换培养液。
1.2.5 矿化结节染色 在共培养21 d后,吸除培养基,将细胞PBS漂洗2次,95%乙醇,4℃固定10 min,三蒸水漂洗3次,加入0.1% 茜素红,37℃染色30 min,三蒸水漂洗,倒置相差显微镜观察,以Image-Pro Plus 5.0图像分析软件测取每个视野下的钙结节面积并以总像素数作为量化指标。
1.2.6 碱性磷酸酶活性试验 在共培养21 d后,吸除培养基,将细胞PBS漂洗2次,裂解,加入含0.1%TritonX-100、2 mmol/L MgSO4、含 6 mmol/L PNPP 的0.1 mol/L NaHCO3– Na2CO3缓冲液(pH 10.0),37℃孵育30 min后加入1 mol/L的NaOH终止反应,以OD405nm/OD550nm计算各组细胞ALP活性。
1.2.7 ELISA法检测结缔组织生长因子(CTGF)以及骨钙素(OCN)的含量 在共培养21 d后,直接吸取细胞培养液进行细胞的CTGF以及OCN含量测定,具体操作步骤按试剂盒说明书进行,采用双抗夹心ELISA法,于490 nm波长检测各孔OD值,以OD值为纵坐标,以标准品浓度为横坐标,绘制标准曲线,根据样品OD值计算其浓度,将含5%和10%PRP的L-DMEM培养液作为对照,排除PRP中CTGF和OCN对结果的干扰。
1.2.8 RT-PCR 法检测成骨相关基因 CTGF、ALP、Cbf-α1、Col-Ⅰ和OCN mRNA表达 在共培养21 d后,取细胞按Trizol说明书提取总RNA,取2 μg总RNA进行逆转录,引物序列见表1。PCR反应条件:95 ℃ 5 min,94 ℃ 30 s,60 ℃30 s,72 ℃ 40 s,35个循环,72℃ 延伸10 min。实验在荧光定量PCR仪ABI7500上进行,GAPDH 作为内参照,2-△△Ct法分析基因相对表达量。

表1 成骨相关基因引物序列Table 1 Primer sequences of osteoblast-related genes
1.3 统计学分析
2 结果
2.1 骨髓间充质干细胞的鉴定
分离培养的BMSCs均一性达到95%以上(见图1),膜抗原CD34及CD45呈阴性表达,CD105呈阳性表达(见图2)。
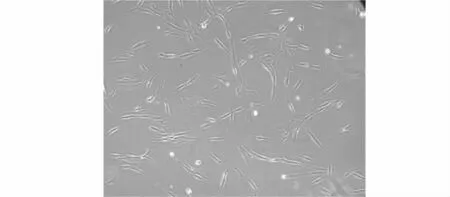
图1 骨髓间充质干细胞的形态学 (×100)Figure 1 Morphology of cultured BMSCs (×100)
2.2 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中矿化情况的影响
通过Image-Pro Plus 5.0图像分析软件测取每个视野下的钙结节面积并以总像素数作为量化指标,矿化结节染色结果显示,终浓度0.1 μmol/L地塞米松可诱导骨髓间充质干细胞在分化为成骨细胞过程中产生矿化结节,5%PRP组茜素红染色阳性率为28.6%,10%PRP组茜素红染色阳性率为52.8%,显著高于阴性对照组,证明PRP与BMSCs共培养可促进骨髓间充质干细胞诱导分化为成骨细胞,10%PRP组茜素红染色阳性率显著高于5%PRP 组(P<0.05,图3)。
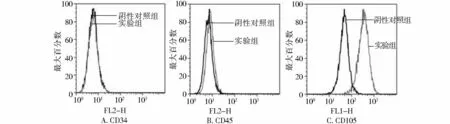
图2 骨髓间充质干细胞的鉴定Figure 2 Identification of BMSCs by flow cytometry
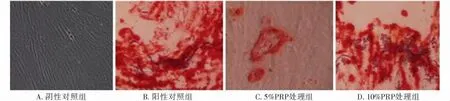
图3 富血小板血浆对骨髓间充质干细胞定向分化为成骨细胞矿化结节染色的影响Figure 3 The effect of PRP on mineralized nodules staining of BMSCs differentiation into osteoblasts
2.3 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中碱性磷酸酶活性的影响
碱性磷酸酶活性试验结果显示,终浓度0.1 μmol/L地塞米松可诱导骨髓间充质干细胞在分化为成骨细胞过程中碱性磷酸酶活性升高,与阴性对照组相比,5%和10%PRP组碱性磷酸酶活性显著升高(P<0.05),证明PRP与BMSCs共培养可上调碱性磷酸酶活性,促进骨髓间充质干细胞诱导分化为成骨细胞。10%PRP组碱性磷酸酶活性显著高于5%PRP组(P<0.05,见图4)。
2.4 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中CTGF以及OCN含量的影响
ELISA试验结果显示,终浓度0.1 μmol/L地塞米松可诱导骨髓间充质干细胞在分化为成骨细胞过程中CTGF以及OCN含量升高,与阴性对照组相比,5%和10%PRP组CTGF以及OCN含量显著升高(P<0.05),证明PRP与BMSCs共培养可上调CTGF以及OCN含量,促进骨髓间充质干细胞诱导分化为成骨细胞,10%PRP组CTGF以及OCN含量显著高于5%PRP组(P<0.05,见图5)。
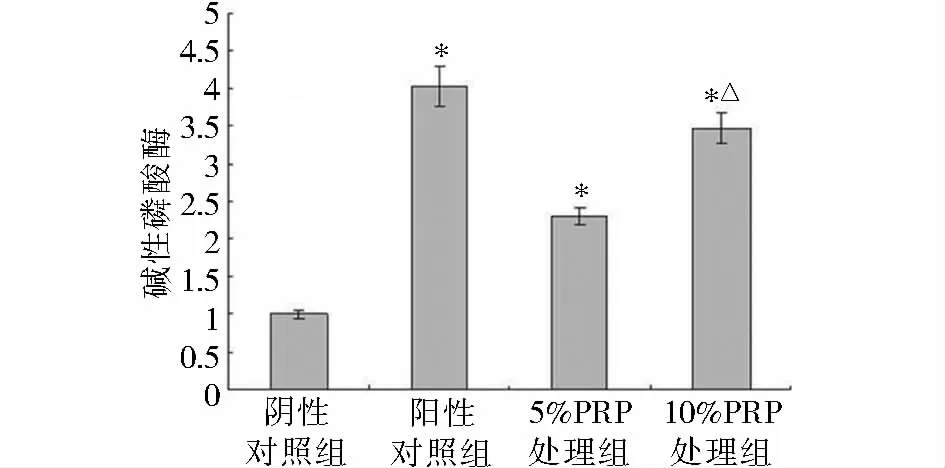
图4 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中碱性磷酸酶活性的影响Figure 4 The effect of PRP on ALP activity in BMSCs differentiation into osteoblasts
2.5 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中成骨相关基因mRNA表达的影响
Real time-PCR试验结果显示,终浓度 0.1 μmol/L地塞米松可诱导骨髓间充质干细胞在分化为成骨细胞过程中 CTGF、ALP、Cbf-α1、Col-Ⅰ和OCN mRNA表达升高,与阴性对照组相比,5%和10%PRP 组成骨相关基因 CTGF、ALP、Cbf-α1、Col-Ⅰ和OCNmRNA表达显著升高(P<0.05),证明PRP与BMSCs共培养可上调成骨相关基因表达,促进骨髓间充质干细胞诱导分化为成骨细胞,10%PRP组上述基因mRNA表达显著高于5%PRP组(P<0.05,见图6)
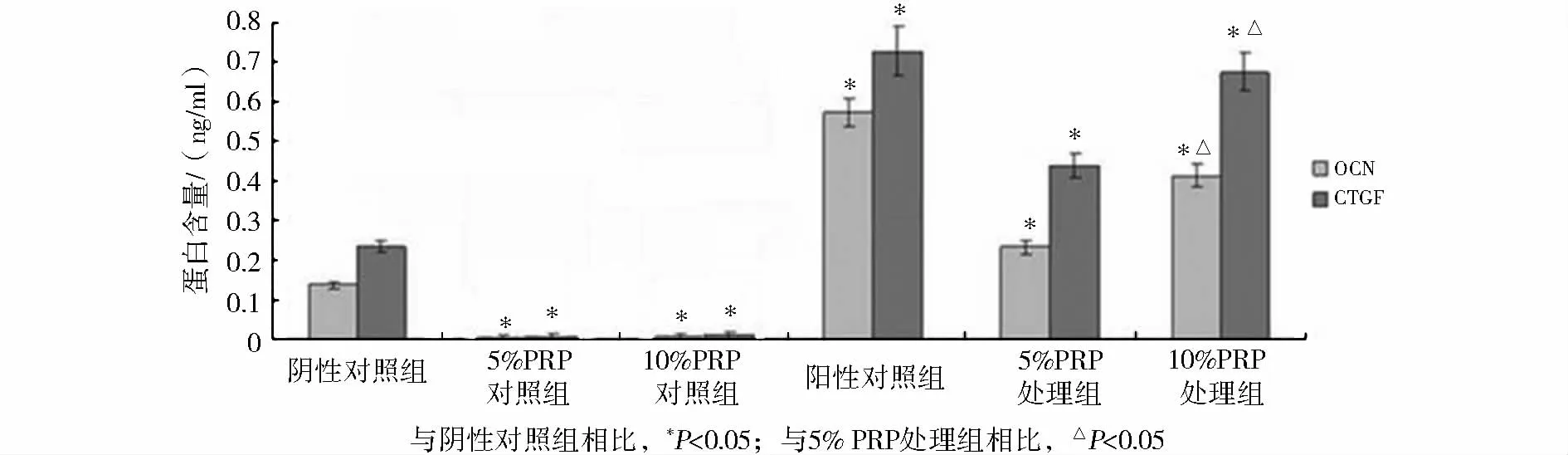
图5 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中CTGF以及OCN含量的影响Figure 5 The effect of PRP on CTGF and OCN content in BMSCs differentiation into osteoblasts
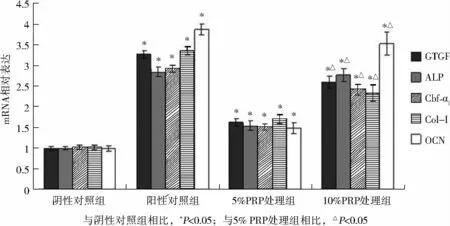
图6 富血小板血浆对骨髓间充质干细胞诱导分化为成骨细胞过程中CTGF、ALP、Cbf-α1、Col-Ⅰ和 OCN mRNA 表达的影响Figure 6 The effect of PRP on mRNA expression of CTGF,ALP,Cbf-α1,Col-Ⅰ and OCN in BMSCs differentiation into osteoblasts.
3 讨论
BMSCs由于来源广泛、易于获取、扩增稳定、具有多向分化潜能、在不同诱导条件下能发生表型转化等特点,已经成为组织工程中备受瞩目的种子细胞,也是近年来的研究热点[4]。已有研究表明,富血小板血浆(PRP)可促进BMSCs成骨分化,本文对其机制进行深入探讨。
BMSCs成骨分化有以下几个阶段:分化增殖期,以DNA复制、组蛋白合成为特征;基质形成、成熟期,以ALP活性升高、Col-Ⅰ分泌为特征;基质钙化期,以OCN分泌、钙离子沉积为特征,同时ALP活性持续升高。
核心结合因子α1(core-binding factor alpha 1,Cbf-α1)是成骨细胞分化的关键调节因子,可激活骨钙素表达,调节成骨细胞的成骨速率,并调控ALP、Col-Ⅰ和OCN等下游分子启动子活性,是骨骼发育的决定性基因[5]。碱性磷酸酶(alkaliphosphatase,ALP)由成骨细胞基质小泡释放,其活性可反映成骨诱导效果,并促进细胞基质钙化[6];Col-Ⅰ主要功能是可作为组织支持物,诱导矿物质沉积,促进成骨细胞吸附、矿物质沉积,促进矿化过程 ;OCN也称骨γ-羧基谷氨酸蛋白,是由成骨细胞特异合成与分泌的一种非胶原蛋白,具有募集、趋化和激活骨吸收细胞,调节骨吸收的作用[8];CTGF是一种分泌蛋白,可以促进成骨细胞增殖、增加Col-Ⅰ表达,升高碱性磷酸酶活性以及促进钙盐沉积[9]。因此,Cbf-α1、ALP、Col-Ⅰ、OCN 以及矿化结节的形成既是成骨细胞的表型特征,也是代表成骨细胞分化的经典标志物,表达越高,说明成骨细胞分化越明显[10]。
目前研究多应用地塞米松及成骨性添加剂在体外诱导BMSCs向成骨细胞分化,表现出较高的诱导分化能力,已被尝试应用于鼠、兔、羊和狗等动物的骨缺损修复,但是由于其大量应用可能会对机体造成潜在危害[11],因此我们期望寻找一种来源于机体自身的生物材料诱导BMSCs成骨分化。富血小板血浆含有丰富的细胞因子,可加速骨沉积速度并提高骨生成质量,可用于治疗种植体周围骨缺损。因此我们认为,富血小板血浆含有多种生长因子,可以在共培养过程中模拟成骨微环境,促进BMSCs成骨分化[12]。本研究通过茜素红矿化结节染色试验,发现PRP可有效诱导BMSCs定向分化为成骨细胞,促进ALP、Cbf-α1、Col-Ⅰ、OCN 以及 CTGF 表达增加及矿化结节的形成,且10%PRP诱导效果优于5%PRP。因此我们认为,PRP可刺激 BMSCs分泌CTGF,上调 ALP、Cbf-α1、Col-Ⅰ、OCN 表达,从而诱导 BMSCs 向成骨方向分化,并且其成骨分化能力与PRP浓度有密切关系。因此,富血小板血浆可有效地诱导兔源骨髓间充质干细胞的定向分化为成骨细胞,以上结果可为骨损伤修复的研究进一步提供理论依据。但是,BMSCs成骨的基础研究与临床应用还有一段距离,需要解决许多难题,BMSCs分化及其定向诱导分化的机制有待进一步阐明,潜在的危险性有待进一步评价等,需要在今后的研究中逐步解决。
[1] 周游,曾勇李,李新志.干细胞在骨科中应用的研究进展[J].中国矫形外科杂志,2011,19(14):1185-1187.
[2] Yazdani SO,Pedram M,Hafizi M,et al.A comparison between neurally induced bone marrow derived mesenchymal stem cells and olfactory ensheathing glial cells to repair spinal cord injuries in rat[J].Tissue Cell,2012,44(4):205-213.
[3] Pieri F,Lucarelli E,Corinaldesi G,et al.Effect of mesenchymal stem cells and platelet-rich plasma on the healing of standardized bone defects in the alveolar ridge:a comparative histomorphometric study in minipigs[J].J Oral Maxillofac Surg,2009,67(2):265-272.
[4] 徐佳元,杨卫良.干细胞在软骨组织工程中的研究现状及进展[J].中国矫形外科杂志,2011,19(21):1803-1806.
[5] Huang J,Deng F,Wang L,et al.Hypoxia induces osteogenesis-related activities and expression of core binding factor α1 in mesenchymal stem cells[J].Tohoku J Exp Med,2011,224(1):7-12
[6] Liu J,Chen W,Zhao Z,et al.Reprogramming of mesenchymal stem cells derived from iPSCs seeded on biofunctionalized calcium phosphate scaffold for bone engineering[J].Biomaterials,2013,34(32):7862-72.
[7] Yan X,Yan X,Morrison A,et al.Fluoride induces apoptosis and alters collagen I expression in rat osteoblasts[J].Toxicol Lett,2011,200(3):133-138.
[8] Fei L,Wang C,Xue Y,et al.Osteogenic differentiation of osteoblasts induced by calcium silicate and calcium silicate/β-tricalcium phosphate composite bioceramics[J].J Biomed Mater Res B Appl Biomater,2012,100(5):1237-1244.
[9] Smerdel-Ramoya A,Zanotti S,Canalis E.Connective tissue growth factor(CTGF)transactivates nuclear factor of activated T-cells(NFAT)in cells of the osteoblastic lineage[J].J Cell Biochem,2010,110(2):477-483.
[10] Kalinina NI,Sysoeva VY,Rubina KA,et al.Mesenchymal stem cells in tissue growth and repair[J].Acta Naturae,2011,3(4):30-37.
[11] Steiner D,Lampert F,Stark GB,et al.Effects of endothelial cells on proliferation and survival of human mesenchymal stem cells and primary osteoblasts[J].J Orthop Res,2012,30(10):1682-1689.
[12] Shen Y,Nilsson SK.Bone,microenvironment and hematopoiesis[J].Curr Opin Hematol,2012,19(4):250-255.

