响应面法优化畜禽用凝结芽孢杆菌发酵培养基*
高书锋,张德元,陈海荣,孙翔宇,周映华,胡新旭,周小玲,刘惠知
(湖南省微生物研究所,湖南 长沙 410009)
近年来抗生素作为饲料添加剂导致畜禽产品质量及环境药物残留等问题十分突出[1-2]。微生态制剂已成为一种新型抗生素替代品[3],国家政策大力支持其在畜禽养殖领域的推广应用。凝结芽孢杆菌(Bacilluscoagulans)是近年来益生菌领域研究热点,除具乳酸菌和双歧杆菌等保健功效外[4],还具抗逆性强、耐高温和易贮存等芽孢杆菌所具有的独特性[5],在国外已广泛应用于保健、医疗、食品和畜牧等领域[6]。凝结芽孢杆菌在畜禽添加剂方面的应用报道日益增多,但有关其产业化方面的报道相对较少。本文通过Plackett-Burman试验对影响因子进行考察和评价,然后对关键影响因素进行最陡爬路径试验,进一步采用响应面法研究和探讨及其交互作用,获得最佳发酵培养基组成,为其产业化生产奠定基础。
1 材料与方法
1.1 菌 种
凝结芽孢杆菌菌种由本实验室分离保存。
1.2 主要设备
DGX-9143B-1电热恒温干燥箱、BH-2型OLYMPUS显微镜、PHS-3C型数显酸度计、WJ-250B生化培养箱、ZHWY-200B恒温培养振荡器等。
1.3 培养基
1.3.1 斜面培养基 蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,琼脂18 g/L,pH=7.0-7.2。
1.3.2 种子培养基 蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L, pH=7.0-7.2。
1.3.3 基础培养基 葡萄糖10 g/L、蛋白胨10 g/L、一水硫酸锰 0.169 g/L、硝酸钠 0.34 g/L和七水硫酸镁 0.74 g/L,pH=7.0-7.2。
1.4 培养方法
将凝结芽孢杆菌保藏菌种转接到斜面培养基,35℃培养24 h,备用。取3环活化菌种,接入装有75 mL种子培养基的500 mL三角瓶中,37 ℃、200 r/min培养20 h。
1.5 菌体数及芽孢数检测
发酵液取样,用无菌水进行梯度稀释,倾注法检测含菌量,重复3次,检测菌体数。取10 mL发酵液,置90 mL无菌水中,80 ℃水浴热处理15 min,用无菌水进行梯度稀释,倾注法检测芽孢的形成量,重复3次,检测芽孢数。芽孢率为芽孢数与菌体数的比值。检测培养基:葡萄糖20 g,胰蛋白胨20 g,酵母膏10 g,琼脂18 g,盐溶液10 mL(1 mL盐溶液含:七水硫酸镁5 mg,一水硫酸锰1 mg,碳酸钙2 mg,氯化钠5 mg)。
1.6 不同培养基对凝结孢杆菌发酵水平的影响
1.6.1 碳源对发酵水平的影响 以基础发酵培养基中葡萄糖的碳含量计算碳浓度,将基础发酵培养基中碳源分别用蔗糖、淀粉、葡萄糖、麦麸和糖蜜替换,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
1.6.2 氮源对芽孢发酵水平的影响 以基础发酵培养基中蛋白胨含量计算氮浓度,将基础发酵培养基中氮源分别用蛋白胨、酵母膏、大豆粉、鱼粉、大豆粉+鱼粉(质量比为1:1)、硝酸钾和硫酸铵替换,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
1.6.3 碳氮比对发酵水平的影响 将优化得到的最佳碳源和复合氮源分别按4∶1、3∶1、2∶1、1∶1、1∶2、1∶3和1∶4的替换基础培养基中的碳氮源,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
1.6.4 复合氮源(大豆粉和鱼粉)对发酵水平的影响 经上述优化,得到最佳氮源为大豆粉和鱼粉、质量比为1∶1,改变大豆粉和鱼粉质量比例,研究不同质量比例的大豆粉和鱼粉对凝结芽孢杆菌发酵水平的影响,选取5种不同质量比例的大豆粉和鱼粉进行发酵试验, 5种不同质量比例(大豆粉:鱼粉)分别为3∶1、2∶1、1∶1、1∶2和1∶3。接种量为5%,装液量为15%,置35℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
1.6.5 无机盐对芽孢形成率的影响 去掉基础发酵培养基中的无机盐,分别添加0.002 mol/L硫酸锰、硫酸镁、氯化钠、三氯化铁、磷酸氢二钾、磷酸二氢钠、碳酸钙和硝酸钠,以不加任何无机盐的发酵培养基作对照,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
1.7 影响凝结芽孢杆菌发酵水平的重要因素筛选
根据碳氮源单因素筛选试验及无机盐单因素试验结果,采用Plackett-Burman(P-B)两水平法,选用试验次数N=12试验设计,对碳源、氮源和无机盐6种因素进行考察,每个因素各取两个水平,对凝结芽孢杆菌发酵液菌体数进行响应,筛选影响凝结芽孢杆菌活菌体数的重要因素,以期确定最佳配方,设计因素及水平见表1。根据P-B试验设计方案配制培养基,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。

表1 P-B试验设计因素及水平Table 1 Levels and factors of the Plackett-Burman design
1.8 最陡爬坡路径逼近响应区试验
根据P-B试验结果,用Minitab软件对P-B试验数据进行回归拟合分析,确定主要影响因子,在其它因素保持原始水平不变下,对淀粉、大豆粉+鱼粉和磷酸氢二钾进行最陡爬坡试验,根据所得一次回归方程安排最陡爬坡试验,一次回归方程系数正负和大小确定爬坡方向和步长,系数为负,则该因素水平为递减,反之递增,系数越大变化越小,尽而快速的接近最大响应区域[7]。最陡爬坡试验设计见表8,分别按表8配制培养基,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
1.9 响应面分析法确定最大响应值
根据最陡爬坡试验得到的中心点,对淀粉、鱼粉和磷酸氢二钾进行中心试验组合设计,运用Minitab软件采用Box-Behnken法,创建响应面设计,进行响应面分析,中心点3次重复。响应面分析因素及水平见表2,根据响应面试验设计方案配制培养基,接种量为5%,装液量为15%,置35 ℃、200 r/min摇床发酵,发酵42 h,分别检测发酵液菌体数。
2 结果与分析
2.1 培养基组分对凝结孢杆菌发酵水平的影响
2.1.1 不同碳源对发酵水平的影响 不同碳源对凝结芽孢杆菌发酵水平的影响结果见表3。由表3知,碳源为葡萄糖时菌体数最高,为25.8×108CFU/mL,碳源为淀粉时菌体数次之,为23.2×108CFU/mL,考虑到碳源为淀粉时,菌体数和葡萄糖差异不大,且芽孢率和芽孢数均最高,分别为55.17%和12.8×108CFU/mL,因此选择淀粉为发酵最佳碳源。
2.1.2 不同氮源对发酵水平的影响 由表4可知,大豆粉+鱼粉、鱼粉和大豆粉为氮源时,凝结芽孢杆菌菌体数和芽孢率均较高,菌体数分别为39.5×108CFU/mL、37.8×108CFU/mL和33.4×108CFU/mL;芽孢率分别为63.29%、62.43%和64.97%;硝酸钾和硫酸铵为氮源时,菌体数和芽孢率都比较低,可见有机氮源和无机氮源对凝结芽孢杆菌菌体数和芽孢率的影响差异很大,因此选用有机复合氮源大豆粉+鱼粉(1:1)为凝结芽孢杆菌发酵最佳氮源。
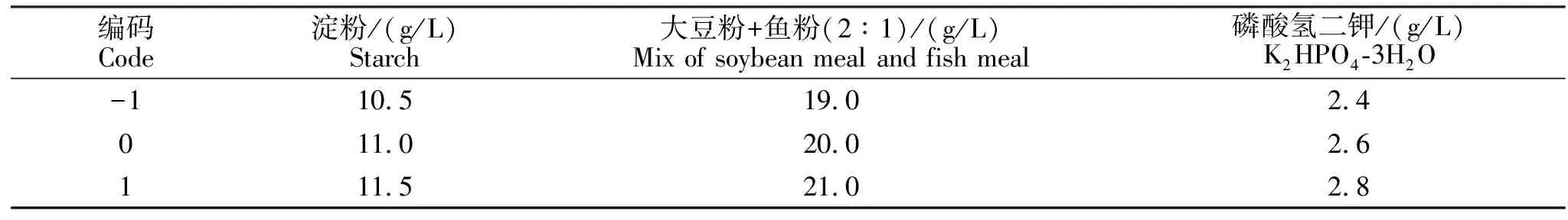
表2 响应面分析因素水平表Table 2 Levels and factors of the response surface analysis
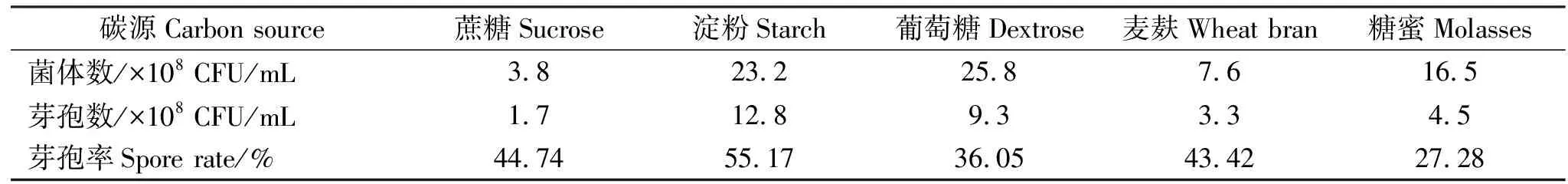
表3 不同碳源对凝结芽孢杆菌发酵水平的影响Table 3 The influence of different carbon sources on fermentation level of Bacillus coagulans
2.1.3 不同碳氮比对发酵水平的影响 由表5可知,碳氮比为1∶2、1∶1和1∶3时,凝结芽孢杆菌菌体数较高,分别为40.6×108CFU/mL、38.3×108CFU/mL和37.2×108CFU/mL,且各不同碳氮比处理芽孢率基本相同,因此,选择1∶2为凝结芽孢杆菌发酵最佳碳氮比。
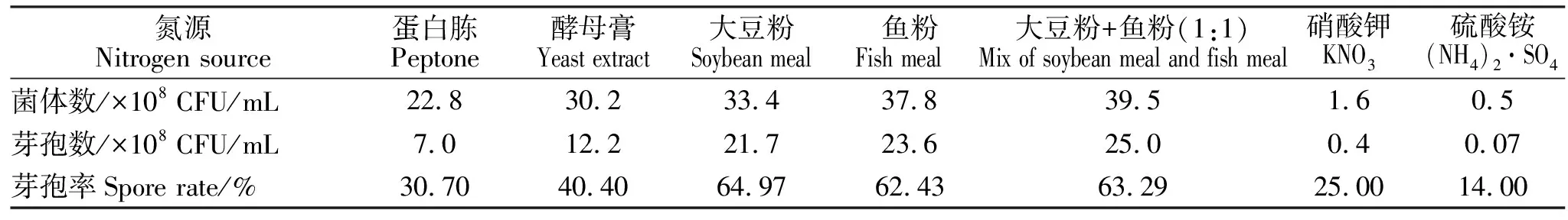
表4 不同氮源对凝结芽孢杆菌发酵水平的影响Table 4 The influence of different nitrogen sources on fermentation level of Bacillus coagulans
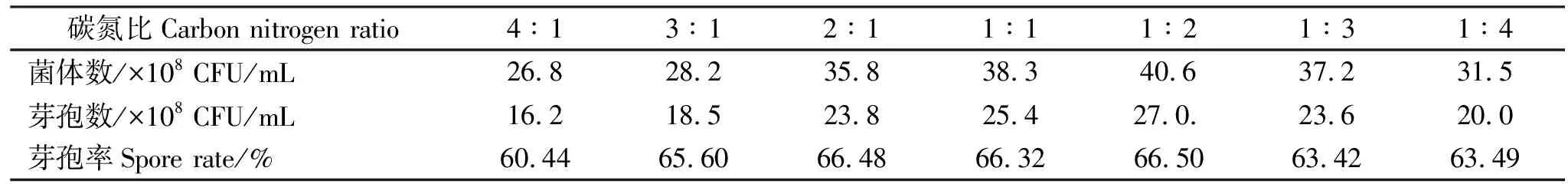
表5 不同碳氮比对凝结芽孢杆菌发酵水平的影响Table 5 The influence of different carbon nitrogen ratio on fermentation level of Bacillus coagulans
2.1.4 不同比例复合氮源对发酵水平的影响 由表6知,复合氮源大豆粉和鱼粉质量比为2∶1和1∶1时,菌体数和芽孢数较高,菌体数分别为37.5×108CFU/mL和35.4×108CFU/mL,芽孢数分别为24.0×108CFU/mL和22.7×108CFU/mL,由各处理芽孢率差异不大,故选择2∶1为凝结芽孢杆菌液体发酵复合氮源大豆粉和鱼粉的最佳质量比。
2.1.5 无机盐对发酵水平的影响 由表7可知,添加磷酸氢二钾、硫酸镁、磷酸二氢钠和硝酸钠时,菌体数分别为21.5×108、15.6×108、15.2×108、14.1×108CFU/mL,均高于对照菌体数10.6×108CFU/mL;从芽孢数看,添加磷酸二氢钠、磷酸氢二钾、碳酸钙、硫酸镁和硫酸锰时,与对照相比,芽孢数均有不同程度提高。
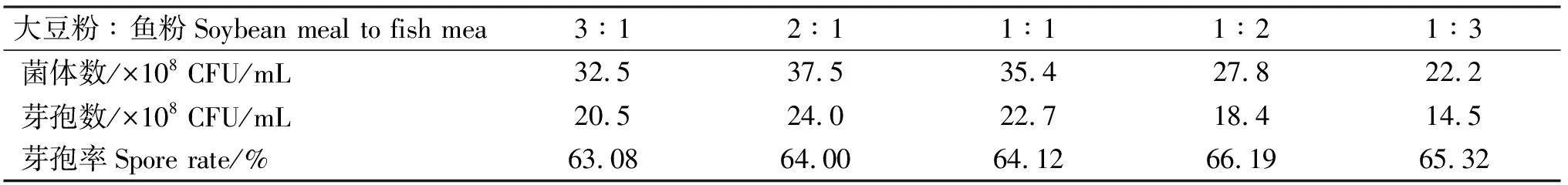
表6 不同比例复合氮源对凝结芽孢杆菌发酵水平的影响Table 6 The influence of composite carbon sources of different proportions on fermentation level of Bacillus coagulans
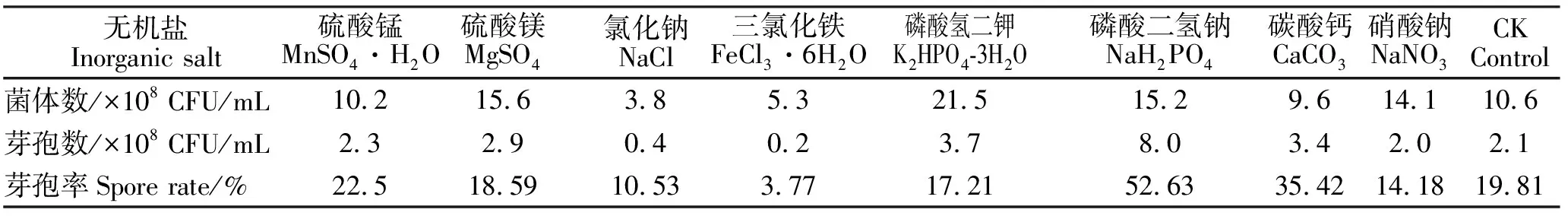
表7 不同无机盐对凝结芽孢杆菌芽孢形成率的影响结果Table 7 The influence of different inorganic salts on fermentation level of Bacillus coagulans
2.2 影响凝结芽孢杆菌发酵水平的重要因素筛选
P-B试验设计及结果见表8。运行Minitab软件对试验结果进行各因素效应计算及重要性评价,结果见表9。淀粉、鱼粉+大豆粉(质量比=2∶1)和磷酸氢二钾三个因素效应值的绝对值较大,绝对值越大,该因素对菌体数影响越大。从P值看,淀粉、鱼粉+大豆粉(质量比=2∶1)和磷酸氢二钾三个因素置信度均高于95%,其P值分别为0.025、0.037和0.047,其它因素在α=0.05水平上对菌体数影响不显著,因此,将淀粉、鱼粉+大豆粉和磷酸氢二钾三因素作为重要因素,进一步采用响应面进行发酵条件优化。

表8 Plackett-Burman 试验设计及结果Table 8 The design matrix and experimental results of Plackett-Burman design and test
注:“-1,0和1”分别表示培养基显著因素“低、中和高”浓度水平。下同。
Note:“-1,0 and 1”indicates respectively“low,medium and high”concentration level of each significant factor of culture medium.The same below.
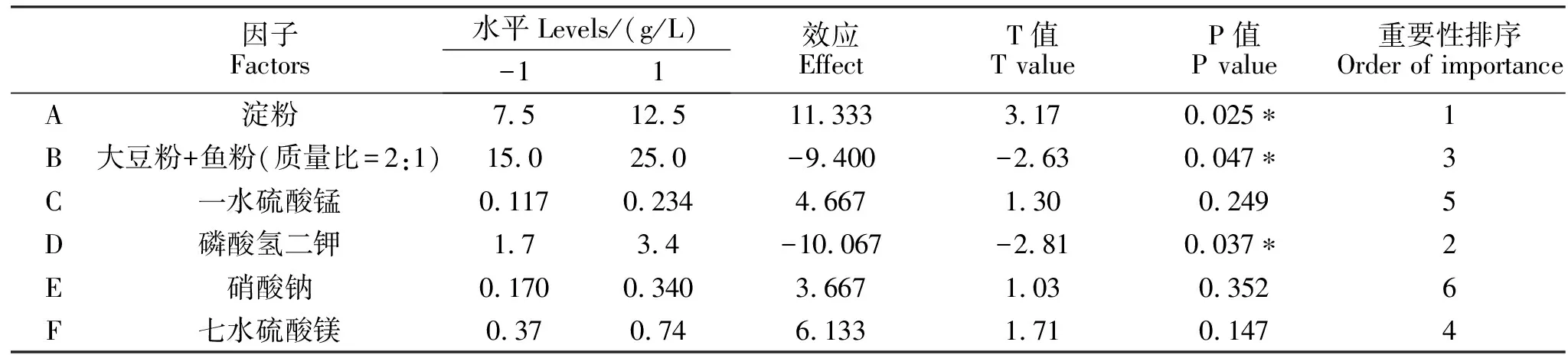
表9 Plackett-Burman试验因素水平的选择及重要性评价Table 9 The selection of factor and level and importance evaluation of Plackett-Burman test
注:同列肩标“*”表示显著(P<0.05),“**”表示极显著(P<0.01)。
Note:Values with superscript“*”in the same column indicate significant difference(P<0.05),those with“**”indicate extreme difference(P<0.01).
2.3 最陡爬坡路径逼近响应区试验
将P-B试验选取的三个重要因素淀粉、鱼粉+大豆粉(质量比=2∶1)和磷酸氢二钾进行最陡爬坡试验。用Minitab软件对P-B试验数据进行回归分析,得到一次回归方程:菌体数=24.9+5.67A-4.70B+2.33C-5.03D+1.83E+3.07F,根据P-B试验得出的上述一次拟合方程安排最陡爬坡试验。一次拟合方程中各变量的系数决定爬坡方向和变化步长,如果系数为负,则该因素水平应为递减,反之递增,系数越大变化越小。
显著因素的变化方向、步长和试验结果见表10。从表10可知,第4组试验淀粉11.0 g/L、大豆粉+鱼粉20.0 g/L和磷酸氢二钾2.6.0 g/L时凝结芽孢杆菌液体发酵菌体数最高,为54×108CFU/mL。故采用淀粉11.0 g/L、大豆粉+鱼粉(质量比=2∶1)20.0 g/L和磷酸氢二钾 2.6 g/L为后续响应面试验的中心点。
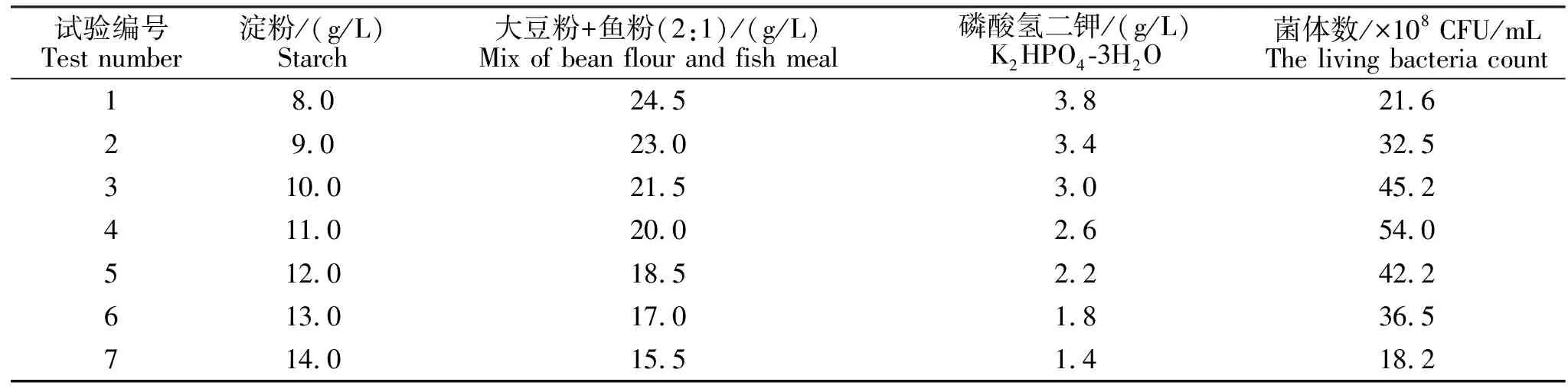
表10 最陡爬坡试验设计及结果Table 10 The design and results of steepest climbing test
2.4 响应面分析法确定最大响应值
响应面试验设计及结果见表11,对响应面试验结果运用Minitab分析软件对试验结果进行统计回归分析,结果见表12。经拟合得到二次回归数学模型,R=57.4667+2.300A+1.675B+1.8C-5.74583A2-3.94583B2-2.54583C2+1.175AB-1.675AC-0.875BC回归模型失拟项P=0.251,失拟不显著。模型相关系数R =0.981,调整后R =09468,说明模型拟合较好。从响应面分析三维图可以看出淀粉、大豆粉+鱼粉(质量比=2∶1)和磷酸氢二钾3个因素对菌体数的影响,如图1~3。
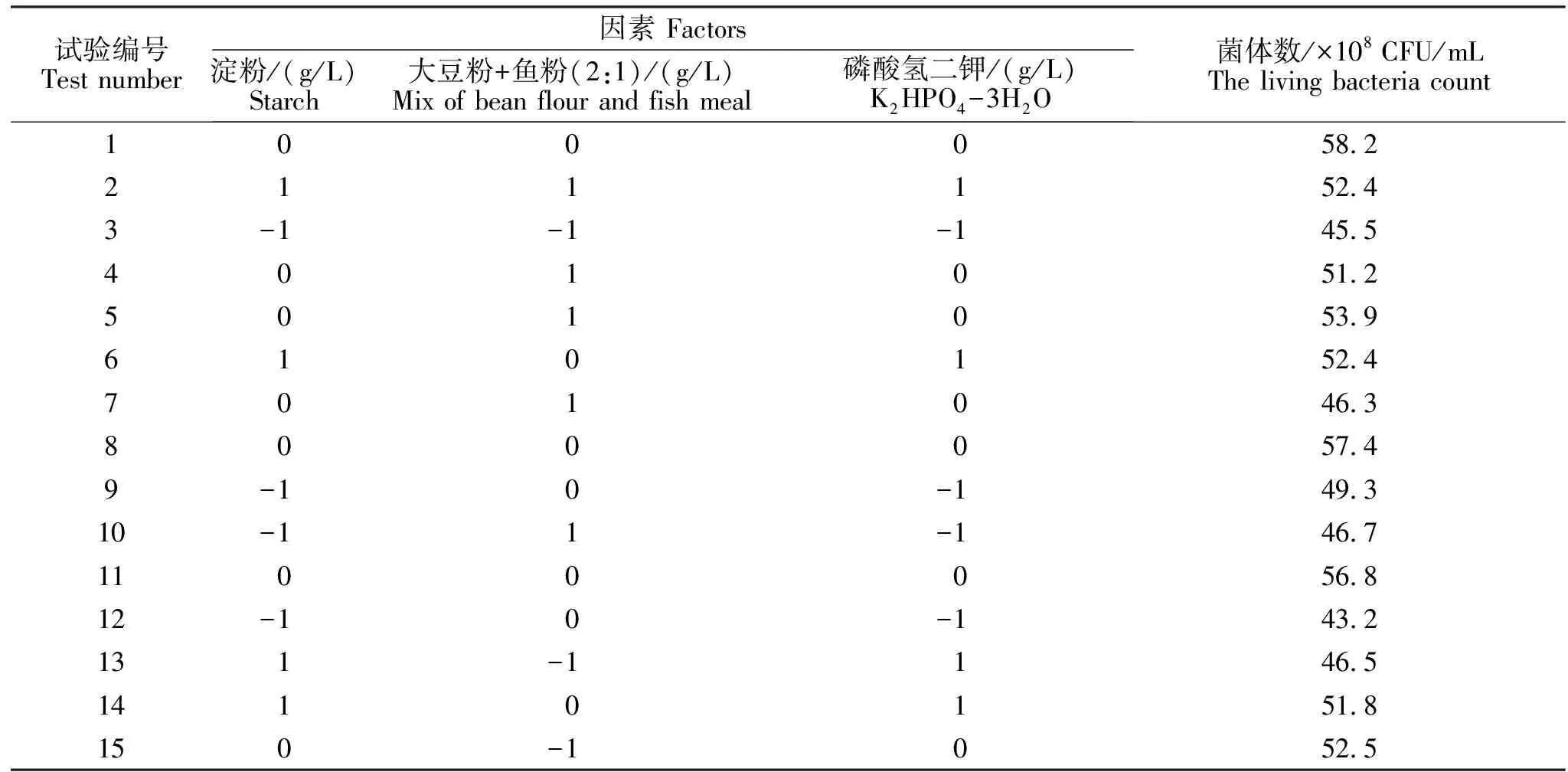
表11 响应面试验设计及结果Table 11 The design and results of response surface test
对回归方程各自变量(A、B、C)分别求一阶偏导数,并均令其为0,即可得到三元一次线性方程组,求解即得极值点:A=0.2057,B=0.2309,C=0.3038,对应淀粉为10.6 g/L、大豆粉为13.5 g/L、鱼粉为6.7 g/L、磷酸氢二钾为2.72 g/L,预测响应最大值为63.2357。
试验结果表明,最佳培养基组成为淀粉 10.6 g/L、大豆粉+鱼粉(质量比=2∶1)20.2 g/L、磷酸氢二钾 2.72 g/L、其它无机盐(磷酸二氢钠0.312 g/L、碳酸钙0.2 g/L、一水硫酸锰 0.234 g/L、硝酸钠 0.34 g/L和七水硫酸镁 0.74 g/L)。在此最佳发酵培养基组成和发酵条件下进行发酵,发酵液活菌数可达67×108CFU/mL。
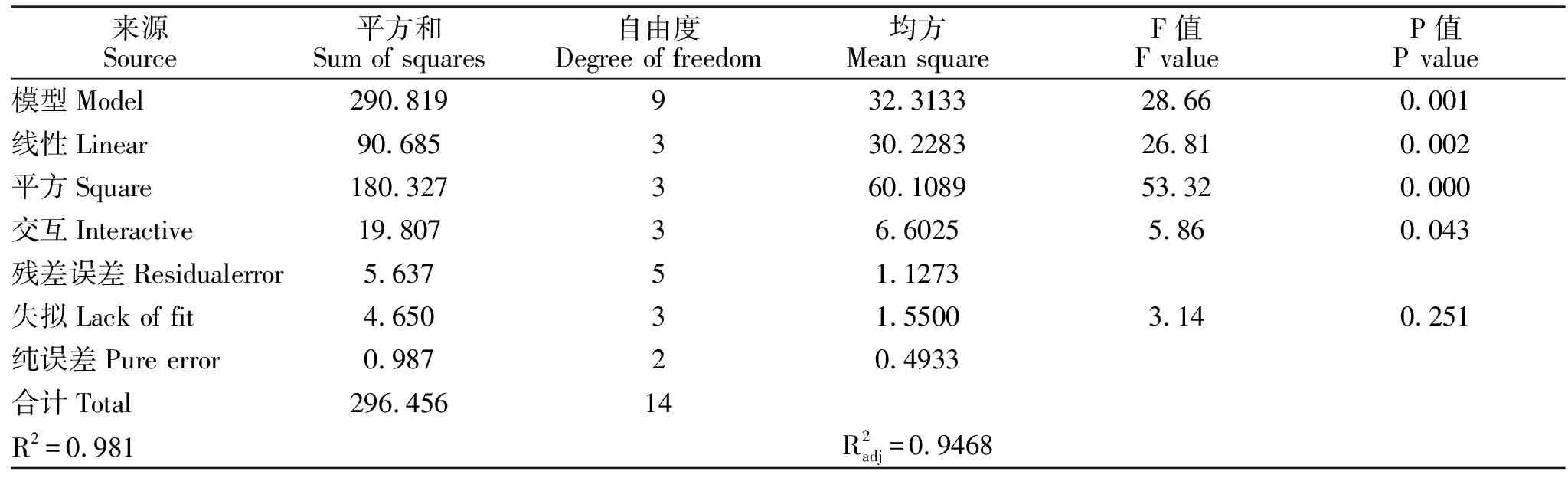
表12 回归模型及方差分析结果Table 12 The result of regression model and analysis of variance
3 讨 论
凝结芽孢杆菌在畜禽添加剂方面的应用报道日益增多,但有关其产业化方面的报道相对较少,分析其原因,主要是凝结芽孢杆菌在产业化过程中存在两个关键限制因素,低菌体量和低芽孢率,解决办法主要集中在菌体量发酵优化[8-13],而结合提升芽孢率的菌体量发酵优化亟待解决。鉴于此,本研究通过单因素试验,兼顾菌体数和芽孢率,对碳氮源、碳氮比和无机盐进行筛选,一方面为解决产业化过程的瓶颈,另一方面为进一步的响应面试验奠定基础。
在P-B试验结果分析表明,淀粉、鱼粉+大豆粉(质量比=2∶1)和磷酸氢二钾三因素效应值分别为11.333、-9.400和-10.067,置信度均高于95%,P值分别为0.025、0.037和0.047,是显著影响凝结芽孢杆菌发酵水平的重要因素。淀粉成为显著影响发酵因素,分析其原因可能与碳源淀粉酶降解转化成葡萄糖,为细菌生命活动提供能量和合成细胞骨架物质等有关,这与该凝结芽孢杆菌菌株产淀粉酶活力强一致。鱼粉和大豆粉成为显著性因素,主要原因可能是氮源被分解为各种氨基酸,能够重新用来合成细胞蛋白质和核酸等重要生命物质。刘馨磊等[11]和陈秋红等[12]对凝结芽孢杆菌发酵优化的研究表明,磷酸氢二钾在发酵培养中有重要作用。而本研究中,无机盐磷酸氢二钾成为显著影响发酵因素,可能是其间接参与了细胞相关代谢。
单从P-B试验淀粉因素看,高水平各处理平均菌体数为30.53×108CFU/mL,而低水平各处理平均菌体数为19.20×108CFU/mL,因此,应选择高水平浓度12.5 g/L;单从P-B试验鱼粉+大豆粉(质量比=2∶1)因素看,高水平各处理平均菌体数为20.17×108CFU/mL,而低水平各处理平均菌体数为29.57×108CFU/mL,因此,应选择低水平浓度15.0 g/L;单从P-B试验磷酸氢二钾因素看,高水平各处理平均菌体数为19.83×108CFU/mL,而低水平各处理平均菌体数为29.90×108CFU/mL,因此,应选择低水平浓度1.7 g/L。最陡爬坡试验结果中心点为淀粉11.0 g/L、大豆粉+鱼粉(质量比=2∶1)20.0 g/L和磷酸氢二钾2.6 g/L。各因素水平并不完全一致,说明各因素间有一定的交互影响作用,而最陡爬坡试验则消除了该种交互影响作用,并为进一步响应面试验优化奠定基础。
响应面试验结果经统计回归分析拟合,得到二次回归数学模型,经求解得到极值点,对应最佳培养基组成:淀粉为10.6 g/L、大豆粉为13.5 g/L、鱼粉为6.7 g/L、磷酸氢二钾为2.72 g/L,液体发酵活菌数达67×108CFU/mL,发酵水平较优化前提高50×108CFU/mL。目前,国内多家单位采用正交试验对凝结芽孢杆菌发酵优化进行研究,秦艳等[6]报道凝结芽孢杆菌发酵水平为7.0×108CFU/mL;刘馨磊[11]等通过流加补料,菌体数达4.5×109CFU/mL,芽孢数达1.2×109CFU/mL;陈秋红等[12]报道凝结芽孢杆菌发酵水平达6.0×109CFU/mL;崔东良等[13]通过对凝结芽孢杆菌工业化发酵培养基优化研究,菌体数达9.3×109CFU/mL。然而通过正交试验获得的优选值不会超越所取水平范围,也不能给进一步试验提供明确指向性,而通过P-B试验可快速筛选出重要响应因素,为最陡爬坡试验指明方向及变化步长,并逼近最大响应区域,通过中心组合试验和响应面分析得到拟合模型方程,进而获得最佳发酵培养基组分浓度,因此,响应面法优化更加具有科学性和准确性。
4 结 论
通过响应面法获得凝结芽孢杆菌最佳发酵培养基为:淀粉 10.6 g/L、大豆粉 13.5 g/L、鱼粉 6.7 g/L、磷酸氢二钾 2.72 g/L、磷酸二氢钠0.312 g/L、碳酸钙0.2 g/L、一水硫酸锰 0.234 g/L、硝酸钠 0.34 g/L和七水硫酸镁 0.74 g/L。在此最佳发酵培养基下进行发酵,发酵液菌体数达67×108CFU/mL。参考以上国内研究的发酵水平数据,该试验菌株的发酵水平还有一定提升空间,另一方面也为其进一步发酵罐放大和中试转化提供了理论依据。
参考文献:
[1] 王怀蓬,乌日娜,孙填平,等.绿色功能性饲料添加剂-异麦芽低聚糖[J].饲料工业,2008, 29(4):1-3.
[2] 李旋亮,吴长德,李建涛.微生态制剂的研究进展及应用[J].饲料研究,2009(7):23-26.
[3] 相 菲,徐春厚.芽孢乳酸菌类微生态制剂在畜牧业中的应用[J].畜牧兽医杂志,2009,28(1)42-44.
[4] 董惠钧,姜俊云,郑立军,等.新型微生态益生菌凝结芽孢杆菌研究进展[J].食品科学,2010,31(1):292-294.
[5] 戴 青,赵述淼,谢树贵,等.一株凝结芽孢杆菌的分离筛选及生物学特性研究[J].饲料工业,2008,29(12):36-38.
[6] 秦 艳,李卫芬,雷 剑,等.凝结芽孢杆菌发酵条件的优化[J].浙江农业学报,2008, 20(6):471-474.
[7] 常亚飞,陈守文,喻子牛.苏云金素发酵培养基的优化设计[J].中国生物防治,2006,22(3)190-194.
[8] 王进华,戚 薇,陈 莹, 等.凝结芽孢杆菌芽孢形成液体培养基的研究[J].杭州食品科技,2003(4):5-10.
[9] 杨立华, 赵述淼, 冷一非, 等.一株凝结芽孢杆菌产芽孢条件的研究[J].中国酿造,2010(5):96-98.
[10] 路 程,周长海, 于红梅, 等.凝结芽孢杆菌T50产芽孢条件优化的研究[J].中国酿造,2009(7):93-95.
[11] 刘馨磊,肖春明,许延涛,等.补料分批法高密度培养凝结芽孢杆菌[J].生物技术,2001,11(6)21-23.
[12] 陈秋红,孙 梅,匡 群,等.培养条件对凝结芽孢杆菌芽孢形成的影响[J].生物技术,2009, 19 (1):77-81.
[13] 崔东良,佟建明,王云山,等.凝结芽孢杆菌工业化发酵培养基初步研究[J].食品与发酵工业,2007,33(12):73-75.

