蜂王浆对四氯化碳引起小鼠急性肝损伤保护作用的研究
王金胜 龚 雁 罗亚娟 缪晓青 方文富
(福建农林大学蜂学学院,福州 350002)
四氯化碳(CCl4)是一种工业溶剂,广泛用于诱导化学性肝损伤。CCl4主要是通过肝微粒体细胞色素P450作用形成三氯甲基自由基,它能与巯基(谷胱甘肽和蛋白质硫醇)和抗氧化酶如过氧化氢酶和超氧化物歧化酶结合。三氯甲基自由基产生过量就会引起膜脂质过氧化反应,最终导致了各种肝疾病病理过程,如脂肪肝,纤维化和肝硬化[1]。因此,寻找天然有效、无毒副作用的药物来治疗肝损伤及其并发症至关重要。
蜂王浆是由工蜂头部的上颚腺分泌的粘稠的浆状物,它是蜂王唯一的食物,也是工蜂和雄蜂3日龄以内小幼虫的食物,在蜜蜂的生长发育上起着重要的影响作用。它对肝脏疾病具有很好的疗效[2],它可以增强免疫功能、抗菌抗病毒、促进肝组织再生、抑制贮脂细胞活化、氨基酸等成分的作用、均衡营养和调节代谢作用等,它可以标本兼治,而且无毒副作用[3]。本研究的目的就是来探讨蜂王浆对CCl4引起小鼠急性肝损伤保护作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:
健康的雄性小鼠(mus musculus),体重18~22 g,由上海斯莱特林实验动物中心提供。
1.1.2 实验材料:
新鲜的蜂王浆,2012年福建省莆田市江口龙眼花期生产,由福州市蜜蜂协会意蜂实验场提供。
1.1.3 实验试剂:
联苯双酯滴丸,由浙江万邦药业有限责任公司生产;四氯化碳为分析纯,由开封化学试剂厂生产;AST、ALT酶联免疫试剂盒、MDA、GSH-Px试剂盒,由南京建成生物研究所提供;
1.1.4 主要仪器:酶标仪;分光光度计;恒温箱
1.2 实验方法
1.2.1 肝损伤模型的建立和分组
健康的雄性小鼠,体重18~22 g,在实验室适应一周,自由进食进水。小鼠随机分成6组:正常对照组、模型组、阳性对照组、蜂王浆高、中、低剂量组。按照国内常用的方法[4]进行造模:腹腔注射0.1%(v/v)CCl4玉米油溶液10 ml/kg,禁食,不禁水。
1.2.2 给药及动物处理
造模18 h后开始灌胃给药,每天灌胃一次,连续28 d。正常对照组和模型组给予生理盐水,阳性对照组给予联苯双酯(150 mg/kg),蜂王浆高、中、低剂量组浓度分别为:0.8 g/kg、1.6 g/kg、3.2 g/kg。均自由进食。
于末次给药后2 h,除空白对照组外分别进行腹腔注射CCl4玉米油溶液,空白对照组腹腔注射同剂量的玉米油,禁食不禁水,18 h后经摘取眼球取血,并脱颈椎处死。
1.2.3 血清中AST、ALT测定
收集的血样以4000 rpm离心10 min,取血清,采用双抗体夹心法按照试剂盒的说明来测定血清中AST、ALT含量。
1.2.4 肝脏中MDA和GSH-Px的测定
剪取0.5 g肝脏置于碾磨器中,加入5 ml生理盐水进行充分碾磨,4500 rpm离心10 min,取上清液,制成10%的匀浆。按照试剂盒的说明测定肝组织中MDA的含量和GSH含量。组织中蛋白含量的测定采用考马斯亮蓝法测定。
1.3 数据统计与分析
组间比较用one-way ANOVA。方差齐性时,采用LSD方法进行组间多重比较;方差不齐时,采用DunnettT 3方法进行组间多重比较。用统计软件SPSS17.0进行分析,数据以(±s)表示,P<0.05定为差异有统计学意义。
2 结果与分析
2.1 蜂王浆对CCl4引起的急性肝损伤小鼠血清中AST和ALT含量的影响
蜂王浆对CCl4引起的急性肝损伤小鼠血清中AST和ALT影响的实验和统计结果显示:模型组的AST和ALT含量分别极显著高于正常对照组的(P<0.01),表明本实验小鼠急性肝损伤造模成功;饲喂高、中、低三个剂量蜂王浆组、正常对照组和阳性对照组血清中的AST、ALT含量之间无显著性差异(P>0.05),但它们都极显著低于模型组的(P<0.01),说明说明饲喂一定剂量的蜂王浆对小鼠抗肝细胞受损和抗肝细胞坏死具有极显著作用(表1和表2)。

表1 蜂王浆对CCl4肝损伤小鼠血清中AST含量影响的实验和统计结果(x± s )
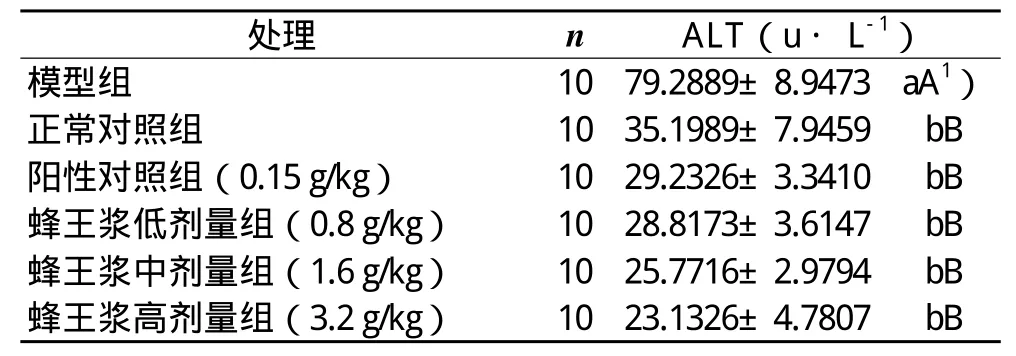
表2 蜂王浆对CCl4肝损伤小鼠血清中ALT含量影响的实验和统计结果(x± s )
2.2 蜂王浆对CCl4引起急性肝损伤小鼠肝匀浆中脂质过氧化产物MDA含量的影响
蜂王浆对CCl4引起急性肝损伤小鼠肝匀浆中MDA含量影响的实验和统计结果:模型组MDA的含量极显著高于正常对照组、阳性对照组的(P<0.01),说明模型组小鼠肝脏脂质过氧化程度严重;正常对照组、阳性对照组、蜂王浆低剂量组、蜂王浆中剂量组和蜂王浆高剂量组的MDA含量之间无显著差异(P>0.05),但它们都极显著低于模型组的(P<0.01),说明饲喂一定剂量的蜂王浆对小鼠抗肝脏脂质过氧化具有极显著作用(表3)。
表3 蜂王浆对CCl4肝损伤小鼠肝脏中MDA含量影响的实验和统计结果(±s )
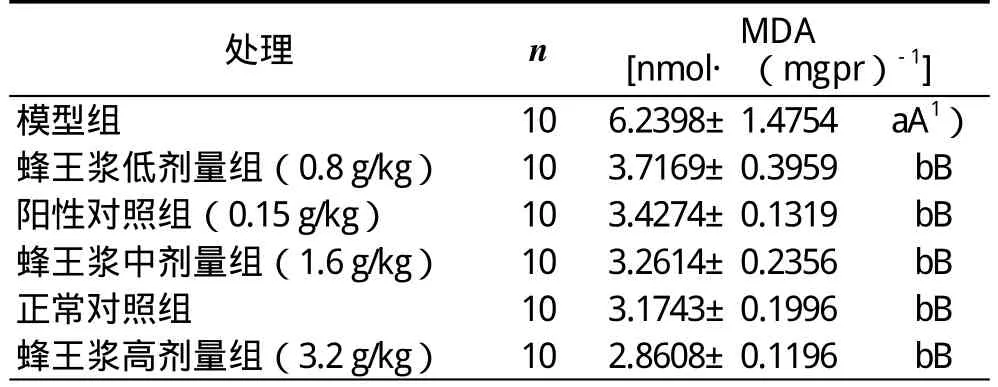
表3 蜂王浆对CCl4肝损伤小鼠肝脏中MDA含量影响的实验和统计结果(±s )
注:1)小写字母表示差异达显著水平(P<0.05)。大写字母表示差异达极显著水平(P<0.01)
处理 n MDA[nmol·(mgpr)-1 ]模型组 10 6.2398±1.4754 aA1 )蜂王浆低剂量组(0.8 g/kg) 10 3.7169±0.3959 bB阳性对照组(0.15 g/kg) 10 3.4274±0.1319 bB蜂王浆中剂量组(1.6 g/kg) 10 3.2614±0.2356 bB正常对照组 10 3.1743±0.1996 bB蜂王浆高剂量组(3.2 g/kg) 10 2.8608±0.1196 bB
2.3 蜂王浆对CCl4引起急性肝损伤小鼠肝匀浆中GSH-Px含量的影响
蜂王浆对CCl4引起急性肝损伤小鼠肝匀浆中GSH-Px含量影响的实验和统计结果:正常对照组、蜂王浆低剂量组、蜂王浆中剂量组和蜂王浆高剂量组的GSH-Px含量之间无显著差异(P>0.05),但它们极显著高于模型组的(P<0.01),且极显著低于阳性对照组的(P<0.01),说明饲喂一定剂量的蜂王浆对小鼠肝脏细胞膜结构与功能完整性能起到极显著的保护作用,但其保护作用极显著不如采用联苯双酯的(表4)。
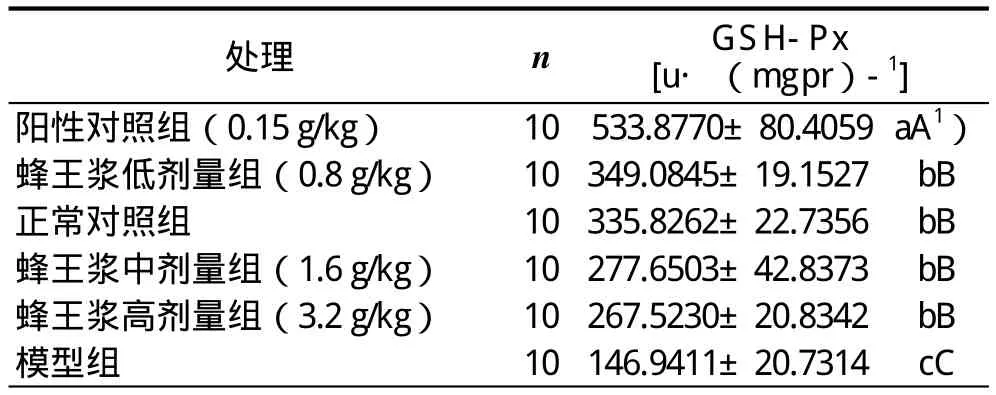
表4 蜂王浆对CCl4肝损伤小鼠肝脏中GSH-Px含量影响的实验和统计结果(x± s )
3 讨论
(1)CCl4引起的肝损伤是筛选保肝药物而广泛使用的实验模型。本研究结果显示:模型组的AST和ALT含量分别极显著高于正常对照组的(P<0.01),表明本实验小鼠急性肝损伤造模成功;饲喂高、中、低三个剂量蜂王浆组和正常对照组血清中的AST和ALT含量之间无显著性差异(P>0.05),但它们都极显著低于模型组的(P<0.01)。
模型组中AST和ALT含量高于正常对照组的,主要是由于CCl4作用于肝脏细胞,破坏细胞膜,细胞中的AST和ALT释放出来造成的。
正常对照组、蜂王浆三个剂量组的AST和ALT含量之间无显著性差异,这主要是由于饲喂一定剂量的蜂王浆对小鼠的肝细胞具有保护作用,但具有保护作用的适当剂量尚需进一步研究确定。
蜂王浆三个剂量组的AST和ALT含量极显著低于模型组的,这可能是由于蜂王浆中一些抗氧化成分例如蛋白质[5]、抗氧化酶等减轻了CCl4对肝脏的作用。
上述结果表明蜂王浆对CCl4引起的急性肝损伤起到了一定的修复作用。
(2)有报道四氯化碳是毒性代谢物,经过细胞色素P450的作用,生成具有高活性的三氯甲基自由基(·CCl3),会严重的损害肝细胞[6]。·CCl3通过肝细胞内质网膜的NADH-依赖细胞色素P450进行转换,能够攻击多元不饱和脂肪酸,引起脂质过氧化。脂质过氧化反应是产生细胞损伤的一个重要生物氧化过程。MDA是脂质过氧化形成的最终产物,MDA水平的测定也是评价脂质过氧化最常用的方法。
本研究结果显示:模型组MDA的含量极显著高于正常对照组(P<0.01),这主要是由于模型组小鼠肝脏脂质过氧化程度严重造成的;正常对照组、阳性对照组、蜂王浆各剂量组的MDA含量之间无显著差异(P>0.05),但它们都极显著低于模型组的(P<0.01),这可能是由于蜂王浆中含有丰富的抗氧化成分,减轻了自由基对肝脏中不饱和脂肪酸的损害所致。
(3)GSH-Px是一种重要的催化过氧化氢(H2O2)分解的酶,它特异性催化GSH对过氧化氢的还原反应,从而对细胞膜结构与功能完整性起到保护作用。GSH-Px也能催化氧化型谷胱甘肽(GSSH)转变为还原型谷胱甘肽(GSH),加速体内毒性自由基的清除,从而减轻自由基对生物膜中不饱和脂肪酸的攻击,有效地减少肝脏脂质过氧化损伤,增强肝细胞对自由基的抵抗力[7]。
本研究结果显示:模型组GSH-Px的含量极显著低于正常对照组(P<0.01);正常对照组、蜂王浆各剂量组的GSH-Px含量之间无显著差异(P>0.05),但极显著高于模型组的(P<0.01),这可能是由于蜂王浆中丰富抗氧化物质例如Cu/Zn-SOD[8]的作用,同时增强了机体清除自由基的能力,从而减轻自由基对膜上不饱和脂肪酸的损害所致。
蜂王浆各剂量组的GSH-Px含量极显著低于阳性对照组的(P<0.01),这主要是由于蜂王浆毕竟不是药物其对肝细胞膜结构与功能完整性的保护作用远不及采用联苯双酯的缘故。
综上所述,蜂王浆可以显著改善转氨酶的水平,减轻肝脏脂质过氧化程度,对肝损伤具有显著的保护作用。
[1]方士英,姚宏伟,李俊,等.虫草多糖对小鼠化学性肝损伤的保护作用[J].安徽医科大学学报,2004,39(3):201-204.
[2]郭芳彬.蜂王浆与肝脏病[J].养蜂科技,2002,27(5):27-31.
[3]苏晔等.蜂王浆化学成分、生理活性及应用[J].蜜蜂杂志,2000(9):23-24
[4]唐云安,刘玉清,王国钦.肝损伤动物模型研究进展[J].卫生毒理学杂志,2002,16(4):236-238.
[5]Takeshi Nagai,Reiji inoue.preparation and the functional properties of water extract and alkaline extract of royal jelly[J].Food chemistry,2004(84):181-186.
[6]Tomas,A.,Albano,E.,Banni,S.,Botti,B.,Corongiu,F.,Dessi,M.A.,Iannone,A.,Vannini,V.,Dianzani M.U.,1987.Free-radical metabolism of carbon tetrachloride in rat liver mitochondria.A study of the mechanism of activation.Biochem.J.246,313-317.
[7]Galle PR,Hofmann WJ,Walczak H,et al.Involvement of the CD95(APO21/Fas)receptor and ligand in liver damage.J Exp Med,1995;182:1223-1230.
[8]闵丽娥,李佳等,等.意蜂蜂王浆超氧化物歧化酶的分离纯化及部分性质[J].昆虫学报,2004,47(2):171-177.

