神蜂精对佐剂性关节炎大鼠的治疗作用
龚 雁 王金胜 程林兵 缪晓青
(福建农林大学蜂学学院,福州 350002)
类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,其主要病症是慢性炎症、免疫失调和滑膜增生,最终导致关节损伤[1]。迄今为止,RA的病理机制不清。西医治疗本病常用消炎镇痛类药物和糖皮质激素,但这些药物大多毒副作用和不良反应较大[2]。中医中药总体疗效不好,且部分中药毒副作用较大,如雷公藤等[2]。因此使用安全有效的中药制剂治疗RA具有积极意义。
神蜂精是由福建蜂疗医院院长缪晓青教授发明的中药外用制剂,主要有效成分为蜂毒、蜂胶及乳香、九里香、穿山龙等中药,具有消炎镇痛、调节免疫、祛风除湿、通经散寒、行气活血、促进损伤组织修复等作用[3,4]。福建蜂疗医院临床实践证明神蜂精治疗类风湿性关节炎疗效显著,且无毒副作用,但在实验研究方面缺乏相应的客观实验依据。
本实验以佐剂性关节炎(adjuvant arthritis,AA)大鼠为模型,观察神蜂精对其足爪肿胀程度,免疫器官,血清中细胞因子TNF-α、IL-1β、IL-4及IL-10的影响,以探讨神蜂精治疗RA的可能机制,评价神蜂精对AA大鼠的治疗作用,为神蜂精临床治疗RA提供新的理论依据。
1 材料与仪器
1.1 实验动物
SPF级雄性SD大鼠,体质量150±20 g,由上海斯莱特实验动物中心提供。实验室环境:动物分别饲养在笼中,室温为23±1℃,湿度为55±5%,白天与黑夜交替各12 h。动物自由进食和进水。
1.2 药物与试剂
复方醋酸地塞米松乳膏(20 g/支,含地塞米松15 mg):华润三九医药股份有限公司;卡介苗(50 mg/支):上海市生物制品研究所;不完全弗氏佐剂(10 ml/瓶):美国sigma公司;神蜂精(10 ml/瓶):福建神蜂科技有限公司。TNF-α、IL-1β、IL-4及IL-10酶联免疫吸附试剂盒:南京建成生物研究所提供。
1.3 主要仪器
JA-2003型电子天平;0~125mm游标卡尺;电热恒温水浴箱;漩涡混合仪;离心机;酶标仪等。
2 实验方法
2.1 完全弗氏佐剂的配制[5]
取卡介苗50 mg,80℃水浴灭活1 h后,加入不完全弗氏佐剂10 ml,混匀,充分乳化,直至将其滴在水面上不散开为止,即为完全弗氏佐剂(Complement Freund's Adjuvant,CFA),浓度为10 mg/ml。
2.2 动物分组
60只SD雄性大鼠,随机分为6组,即正常组、模型组、阳性组(复方醋酸地塞米松给药组)、低剂量神蜂精组、中低剂量神蜂精组、高剂量神蜂精组,每组10只。
2.3 AA大鼠模型的建立[6] 和给药
取用体积分数为75%的乙醇,对大鼠的右后足进行消毒。除正常组之外,其余组的大鼠每只右后足跖皮下注射0.1 ml CFA。正常组的大鼠则注射等量的生理盐水。设定注射当天为第1 d。
造模14 d后,正常组大鼠不做任何处理,而对其余各组大鼠注射足进行外部涂抹给药。其中模型组每只大鼠涂抹0.5 ml/kg/d生理盐水;神蜂精高、中、低剂量组每只大鼠分别涂抹1.0 ml/kg/d、0.5 ml/kg/d和0.25 ml/kg/d神蜂精;阳性组每只大鼠涂抹1.0 g/kg/d复方醋酸地塞米松乳膏。各组均连续给药28 d。
2.4 大鼠足爪肿胀度的测定[7]
各组大鼠分别于致炎前、致炎后d15,21,27,33,39用游标卡尺测量注射足足趾中部厚度,求出足爪肿胀度(公式如下),以观察神蜂精对AA大鼠炎症的影响。

2.5 大鼠外周血的采集和处理
所有大鼠于末日给药24 h后,称重,腹腔注射戊巴比妥钠30 mg/kg麻醉,眼眶取血约3 ml,静置30 min后,3000 rpm离心15 min,分离血清,-20℃保存。
2.6 胸腺指数、脾脏指数的计算[8]
处死大鼠,无菌环境下取出脾脏和胸腺,冰生理盐水洗净,滤纸吸干,称量,并计算胸腺指数、脾脏指数(公式如下)。

2.7 大鼠血清中TNF-α,IL-1β,IL-4及IL-10含量的测定
大鼠血清中TNF-α,IL-1β,IL-4及IL-10含量均采用酶联免疫吸附法检测。具体步骤严格按相应酶联免疫试剂盒说明书操作。
2.8 数据分析
采用SPSS 17.0统计软件处理。实验数据用平均值±标准差(±s)表示,组间差异用单因素方差分析。P<0.05定为差异有统计学意义。
3 结果
3.1 一般情况观察
正常组大鼠饮食、饮水正常,体重增加正常,毛色光泽,活动自如。模型组大鼠精神状态差,进食少,体重增长缓慢,行动迟缓、不灵活等症状。给予神蜂精及阳性药物治疗后,上述症状明显改善。
3.2 神蜂精对AA大鼠足爪肿胀度的影响
神蜂精对AA大鼠足爪肿胀度的影响实验和统计结果显示:给药前(d15),与模型组相比,各组大鼠足爪肿胀度无统计学差异(P>0.05)。给药第6d时,与模型组相比,神蜂精高剂量组足爪肿胀度降低(P<0.05),阳性组大鼠足爪肿胀度显著降低(P<0.01),其余组则无统计学差异(P>0.05);给药第12d、18d、24d时,神蜂精高、中、低剂量组和阳性组均可明显抑制AA大鼠足爪肿胀,与模型组比较,有极显著性差异(P<0.01)。这说明神蜂精对AA大鼠有抗炎作用。见表1。
表1 神蜂精对AA大鼠足爪肿胀度的影响(±s )
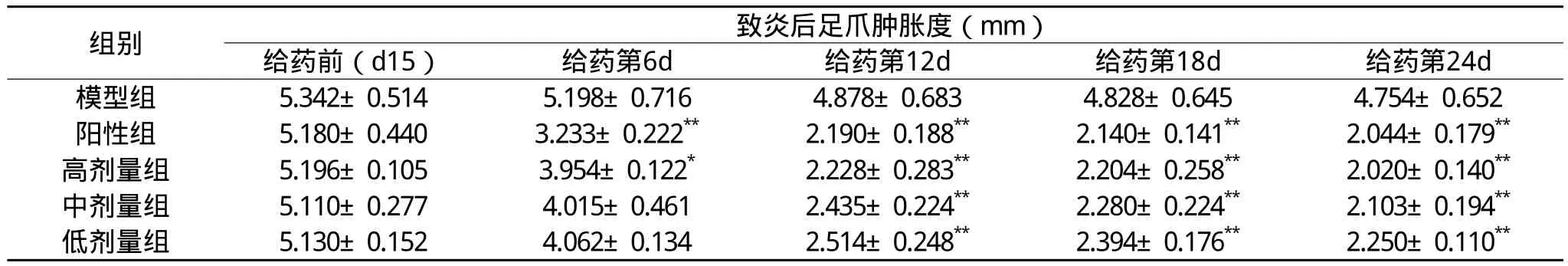
表1 神蜂精对AA大鼠足爪肿胀度的影响(±s )
注:与模型组相比,*P<0.05,**P<0.01。
组别致炎后足爪肿胀度(mm)给药前(d15) 给药第6d 给药第12d 给药第18d 给药第24d模型组 5.342±0.514 5.198±0.716 4.878±0.683 4.828±0.645 4.754±0.652阳性组 5.180±0.440 3.233±0.222** 2.190±0.188** 2.140±0.141** 2.044±0.179** 高剂量组 5.196±0.105 3.954±0.122* 2.228±0.283** 2.204±0.258** 2.020±0.140** 中剂量组 5.110±0.277 4.015±0.461 2.435±0.224** 2.280±0.224** 2.103±0.194** 低剂量组 5.130±0.152 4.062±0.134 2.514±0.248** 2.394±0.176** 2.250±0.110**
3.3 神蜂精对AA大鼠胸腺指数和脾脏指数的影响
神蜂精对AA大鼠胸腺指数和脾脏指数的影响实验和统计结果显示:与正常组比较,模型组胸腺指数显著减小(P<0.01),脾脏指数显著增加(P<0.01)。与模型组比较,神蜂精治疗各组和阳性药物组胸腺指数显著提高(P<0.05),脾脏指数显著降低(P<0.05)。神蜂精高、中、低剂量组与阳性对照组各组之间无显著性差异(P>0.05)。说明神蜂精和阳性对照组均能改善胸腺萎缩和脾脏增大,对胸腺、脾脏免疫器官有保护作用,可以提高机体免疫力。神蜂精组在改善胸腺萎缩方面有优于阳性药物组的趋势。见图1。
3.4 神蜂精对AA大鼠血清中TNF-α,IL-1β含量的影响
神蜂精对AA大鼠血清中TNF-α、IL-1β含量影响的实验和统计结果显示:与正常组比较,模型组血清中TNF-α、IL-1β含量极显著升高(P<0.01)。与模型组比较,神蜂精治疗组血清中TNF-α、IL-1β含量极显著降低(P<0.01)。而神蜂精各组与阳性组相比无显著性差异(P>0.05)。说明神蜂精和阳性药物治疗均能抑制AA大鼠致炎性细胞因子TNF-α、IL-1β的增加,从而缓解其炎症反应。见表2。

图1 神蜂精对AA大鼠胸腺指数和脾脏指数的影响
3.5 神蜂精对AA大鼠血清中IL-4、IL-10含量的影响
神蜂精对AA大鼠血清中IL-4、IL-10含量影响的实验和统计结果显示:与正常组相比,模型组血清中IL-4、IL-10含量极显著降低(P<0.01)。与模型组比较,神蜂精高剂量组血清中IL-4、IL-10含量极显著增加(P<0.01),其余组血清中IL-4、IL-10含量与模型组相比无显著性差异(P>0.05)。说明神蜂精能促进AA大鼠抗炎性细胞因子IL-4、IL-10的增加,而且高剂量组效果较好。见表3。
表2 神蜂精对AA大鼠血清中TNF-α、IL-1β含量的影响(±s )
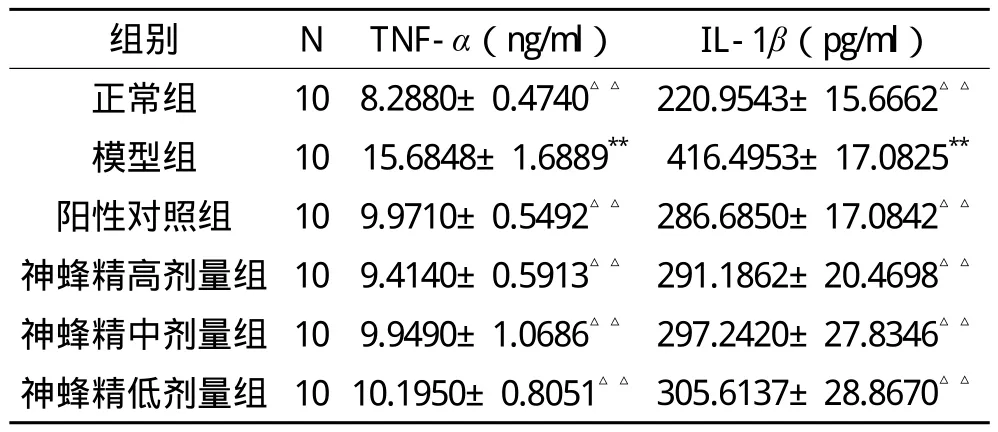
表2 神蜂精对AA大鼠血清中TNF-α、IL-1β含量的影响(±s )
注:与正常组相比,*P<0.05,**P<0.01;与模型组相比,△P<0.05,△△P<0.01。
组别 N TNF-α(ng/ml) IL-1β(pg/ml)正常组 10 8.2880±0.4740△△ 220.9543±15.6662△△ 模型组 10 15.6848±1.6889** 416.4953±17.0825** 阳性对照组 10 9.9710±0.5492△△ 286.6850±17.0842△△ 神蜂精高剂量组 10 9.4140±0.5913△△ 291.1862±20.4698△△ 神蜂精中剂量组 10 9.9490±1.0686△△ 297.2420±27.8346△△ 神蜂精低剂量组 10 10.1950±0.8051△△ 305.6137±28.8670△△
表3 神蜂精对AA大鼠血清中IL-4,IL-10含量的影响(±s )

表3 神蜂精对AA大鼠血清中IL-4,IL-10含量的影响(±s )
注:与正常组相比,*P<0.05,**P<0.01;与模型组相比,△P<0.05,△△P<0.01。
组别 N IL-4(pg/mL) IL-10(pg/mL)正常组 10 67.4833±6.6830△△ 51.2654±2.2045△△ 模型组 10 48.2447±3.7790** 42.0322±2.5574** 阳性对照组 10 59.1074±3.6100 45.5640±3.1865神蜂精高剂量组 10 61.2716±3.4952△△ 50.6528±2.1338△△ 神蜂精中剂量组 10 59.2352±1.8295 47.5770±2.5642神蜂精低剂量组 10 58.4930±0.8629 44.2553±4.7036
4 讨论
类风湿性关节炎的动物模型较多,但经典的大鼠模型是佐剂性关节炎大鼠模型[9]。该模型的组织病理学和免疫学改变与人RA相似,而且模型的制备操作简便易行,造模周期较短,重复性好,可同时获得大量模型动物,因此作为RA的基础研究十分适宜[10]。因此本文选用了佐剂性关节炎模型。
大鼠足爪肿胀度是反映AA大鼠炎症程度的主要指标[11,12],可以评价神蜂精对AA大鼠是否具有抗炎作用。在本研究造模期间,AA大鼠的足爪肿胀出现了两次高峰,与文献[13,14]所报道的AA大鼠经历的几个阶段性变化基本相似,即CFA注射24 h后,注射足的足爪急性肿胀,第3d急性肿胀达到最大值,之后急性炎症缓解,第12~14 d足爪炎症出现第二次高峰期。本研究结果还表明,模型组大鼠足爪肿胀度明显高于正常对照组,表明AA大鼠模型复制成功。AA大鼠的足爪肿胀度结果显示,给药初期,高剂量神蜂精和阳性药物的治疗效果更为明显。但是随着给药周期变长,神蜂精各组和阳性组消肿效果无显著差异性。根据以上研究结果表明神蜂精具有抗炎作用。
类风湿性关节炎是一种自身免疫性疾病。胸腺和脾脏作为机体的免疫器官,可能参与到类风湿性关节炎的发病过程[15]。其中胸腺为机体重要的中枢免疫器官,是T细胞分化的重要场所。脾脏具有造血、贮血和过滤作用,也是T细胞和B细胞发生免疫反应的重要场所。因此,胸腺、脾脏指数能在一定程度上反映免疫调节作用。有文献显示,在AA大鼠模型建立时,胸腺、脾脏指数会发生一定变化[16,17]。本文研究结果显示AA大鼠胸腺萎缩,脾脏增大。神蜂精治疗后AA大鼠胸腺和脾脏病变减轻。这表明神蜂精可能对胸腺和脾脏免疫器官起到保护作用,提高机体抗炎免疫能力。但是具体机制仍有待于进一步研究。
细胞因子作为免疫调节介质在类风湿性关节炎发生过程中起着重要作用。在RA发病过程中,细胞因子平衡失调。RA中的滑膜细胞、淋巴细胞、巨噬细胞处于高度活化状态,可合成TNF-α,IL-1β等多种致炎性细胞因子[18]。同时机体也产生IL-4,IL-10等抗炎性因子,相应地起到促使炎症修复的作用[18]。TNF-α是单核或巨噬细胞产生的细胞因子,能够趋化吸引炎症细胞进入滑膜和关节腔内,导致骨和软骨的破坏等,是关节炎发病的重要炎症介质。IL-1β是炎症、组织损伤及免疫反应的主要介质之一,可刺激T细胞活化,刺激胶原酶合成,使破骨细胞产生增加,导致骨质疏松,软骨降解。本研究显示AA大鼠体内TNF-α和IL-1β含量增加,神蜂精治疗后TNF-α和IL-1β含量会降低,关节炎症缓解。IL-4和IL-10作为抗炎症性物质,对炎症因子(如IL-1β、TNF-α)的释放有抑制作用。本研究显示神蜂精治疗后AA大鼠体内IL-4和IL-10含量会增加。
综上所述,本研究结果显示神蜂精对AA大鼠具有治疗作用,其可能机制是:保护胸腺和脾脏免疫器官,提高机体抗炎免疫能力;抑制致炎性细胞因子TNF-α和IL-1β的生成,促进抗炎性细胞因子IL-4和IL-10的产生。
[1]David M L,et al.Rheumatoid Arthritis[J].The Lancet,2001,358:903-911.
[2]聂英坤,张凤山,孙凤琴.类风湿性关节炎的治疗现状与进展[J].临床荟萃,2004,19(2):119-120.
[3]缪晓青,潘炳芳,吴珍红,等.神蜂精药效学实验(一):神蜂精的消炎镇痛作用[J].福建农业大学学报[J],1995,24(4):466-469.
[4]缪晓青,林立旺,吴珍红,等.神蜂精药效学实验(三):杀菌消毒抗炎作用与药物稳定性[J].中国养蜂,2003,54(2):6-7.
[5]张彦,宋欣伟,吴玲燕,等.类风关1号对佐剂关节炎大鼠滑膜VEGF和COX-2表达的影响[J].天津中医药,2009,26(3):230-233.
[6]苏畅,张成义,韩慧慧.佐剂性关节炎的佐剂剂量条件探索[J].北华大学学报(自然科学版),2001,4(2):306-307.
[7]孙科峰,刘勇,梁再赋,等.乌木胶囊对大鼠佐剂性关节炎足肿胀及炎性介质NO和PEG2的影响[J].辽宁中医药大学学报.2007,9(1):152-153.
[8]莫书蓉,孟宪丽.舒筋活络胶囊对佐剂关节炎大鼠的作用及部分机制研究[J].中药药理与临床,2008,24(2).
[9]孙莉莉,周郦楠.类风湿性关节炎动物模型的研究进展[J].中国实用医药,2011,24(63):244-245.
[10]胡吴斌,胡玲,唐照亮,等.类风湿关节炎实验动物模型研究与评述[J].中国中西医结合杂志,2011,31(9):1290-1293.
[11]宋珊珊,张玲玲,魏伟.实验性关节炎动物模型建立及病理机制研究进展[J].中国药理学通报,2011,7(12):1648-1652.
[12]陈柏松,徐玉东,钟舒琦,等.大鼠佐剂性关节炎模型的建立与评价[J].哈尔滨医科大学学报,2005,39(6):490.
[13]R.Cascao,et al.Effective treatment of rat adjuvant-induced arthritis by celastrol[J].Autoimmunity Reviews,2012.
[14]Yan Chang,Yu jing Wu,et al.Therapeutic effects of TACI-Ig on rats with adjuvant-induced arthritis via attenuating in flammatory responses[J].Rheumatology,2011,50:862-870.
[15]吴曙光,张洪良,魏伟.抗炎免疫药理学进展[M].上海:第二军医大学出版社,2000:215-222.
[16]Gamal Ramadan,et al.Anti-in fl ammatory and anti-oxidant properties ofCurcuma longa(Turmeric)versusZingiberoffi cinale(Ginger)rhizomes in rat adjuvant-induced arthritis[J].Inflammation,2011,34(4):291-310.
[17]罗磊,胡玲,何璐,等.艾灸对类风湿性关节炎大鼠关节滑膜细胞超微结构的影响[J].针刺研究,2011,36(2):105-109.
[18]李霞,孙健,范成明.细胞因子与类风湿关节炎[J].大连大学学报,2000,21(4):102.

