IL-17等炎性因子在风湿免疫相关性血细胞减少骨髓细胞中的分泌状态及其临床意义①
孙黎飞 孙志宏 吴强强 张晓席 杜延会 王桂臣
(解放军第148医院肿瘤中心,淄博255300)
随着对风湿免疫性疾病的认识和研究不断提高,风湿免疫相关性血细胞减少(Rheumatism immune-related hematocytopenia,RIRH)的发病率也逐年增高。我们以往的研究发现,部分RIRH患者伴有血清HLA-B27升高,且端粒酶活性增强,较之血清HLAB27阴性者造血细胞损伤更加严重[1,2],在血清 IgG升高的患者骨髓中伴有不同造血细胞岛出现[3]。本文进一步观察了该类患者血清中炎性因子的含量和骨髓中免疫细胞表达炎性因子的状态,探讨其与RIRH骨髓造血细胞损伤的关联和临床诊疗的意义。
1 资料与方法
1.1 临床资料 66例RIRH为2009年~2012年我院诊治患者,男性20例,女性46例,年龄范围36~72岁;全血细胞减少32例,两系减少34例。外周血WBC(0.7~3.2)×109L-1,HB(35~102)g/L,PLT(30~238)×109L-1;其中伴有干燥综合征者19例,类风湿性关节炎30例,风湿性心脏病17例。27例WBC<2.0×109L-1,伴肺部或尿路感染者血清IgG和血沉(ESR)显著增高。21例间断服用糖皮质激素,28例伴血清HLA-B27增高(影像学排除强直性脊柱炎)。血清对照组30人选自我院查体中心健康标本,年龄20~50岁,男性15人,女性15人。
1.2 主要试剂和器材 血清 IL-5、IL-10、IL-12、IL-17和IFN-γ酶免(ELISA)检测试剂盒购自美国RD公司,羊抗人HLA-DR单克隆抗体购自美国Beyotime公司,羊抗人IgG抗体、驴抗羊IgG荧光二抗(Cy3)、小鼠抗人FcγⅡR、羊抗小鼠IgG荧光二抗(FITC)、小鼠抗人甘露糖受体(Mannose receper,MR,PE)、ICAM-1(PE)、IL-12(AF488)、IL-17A(FITC)和IL-17RA(PE)单克隆免疫荧光(Immunofluorescence,IF)抗体均购自美国SANTA公司。
1.3 检测血清细胞因子含量 留取患者空腹静脉血清,-80℃保存,1周内ELISA方法检测其治疗前后血清 IL-5、IL-10、IL-12、IL-17 和 IFN-γ 含量,每孔标本设3孔,波长450nm读取3孔OD均值,标准曲线换算样品浓度。
1.4 分析骨髓免疫细胞活化状态和免疫分子表达留取患者治疗前和治疗4周后骨髓涂片,联苯胺法过氧化物酶(Peroxydase,POX)染色,观察免疫细胞POX活性;免疫化学(IC)法检测免疫细胞HLADR抗原表达,IF法检测骨髓细胞抗人IgG抗体、FcγⅡR、MR、ICAM-1、IL-12、IL-17A 和 IL-17RA 等免疫分子表达,缺铁性贫血骨髓片为疾病对照。
1.5 药物治疗原则
1.5.1 免疫抑制剂和对症支持 ①根据患者病情予以糖皮质激素治疗,诱导淋巴细胞凋亡,抑制免疫细胞活化;至血象恢复后,逐渐递减;血清HLA-B27和血清IgG升高者,及时联合环孢素A(CsA)口服,抑制T辅助细胞活化。②伴有感染灶,发热、WBC显著下降者,根据药敏选择抗生素和(或)联合抗病毒药物治疗。③原发病和对症支持治疗。
1.5.2 复方丹参干预改善骨髓血管炎性病变 32例血小板计数>50×109L-1,无出血倾向者在上述治疗方案同时联合复方丹参(四川和升制药)30 ml/qd静滴,促进患者体内和骨髓造血微环境炎性因子的清除,随机抽取未加复方丹参治疗组30例RIRH作为治疗对照组,两组年龄范围、性别比例和病情基本相似。每周复查两组患者血清IL-5和IL-17含量及外周血象,4周后随访两组骨髓象变化。
1.6 统计学处理 采用SPSS13.0统计软件进行统计分析,组间比较采用t检验,率的比较采用χ2检验,P<0.05具有统计学意义。
2 结果
2.1 RIRH患者血清中多种炎性因子升高 患者入院时血清 IL-5、IL-10、IL-12、IL-17 和 IFN-γ 分别为(126.04±7.66)ng/L、(316.23±25.163)ng/L、(328.43±27.01)ng/L、(48.17±4.22)ng/L和(40.28±3.69)ng/L,较之对照组显著升高,P值均<0.05。经药物治疗4周至血象恢复时,上述细胞因子分别下降至(58.21±5.14)ng/L、(188.13±12.51)ng/L、(96.01±6.76)ng/L、(26.01±4.23)ng/L和(9.13±2.55)ng/L,接近对照组(详见表1),P>0.05。66例患者中IL-5和IL-17升高率为100%(66/66),IL-12 升高率为 97.0%(64/66),而IL-10和 IFN-γ升高率分别为66.67%(44/66)和69.69%(46/66),较前者差异显著,P<0.05。
2.2 RIRH患者骨髓免疫细胞活化特点
2.2.1 组织嗜碱细胞(肥大细胞,Mast cell,MC)增多与IL-10升高密切相关 患者骨髓中MC数量增多,分类约为(3.2±0.08)%,显著高于疾病对照组(0.6±0.05)%,P<0.05;活化的MC通过粘附、捕获和释放嗜碱性颗粒攻击病变血细胞(图1 A~D),且与血清IL-10升高水平密切相关r=0.885。
2.2.2 嗜酸性粒细胞(Eosinophile granulocyte,EOS)增生活跃 患者骨髓中EOS分类约为(7.4±3.1)%,高于对照组(2.4±1.6)%,P<0.05。活化的EOS特异性颗粒POX活性增强,粘附、捕获和吞噬着病变的中性粒细胞(图1E)、血小板(图1F箭头)和红细胞(图1G箭头),被攻击的病变中性粒细胞POX活性显著减弱(图1H箭头)。
2.2.3 巨噬细胞(Mφ)形态奇异 部分患者由于间断应用糖皮质激素,其骨髓中POX阳性形态怪异的Mφ(图2A~C)多见,伴有感染者骨髓中可见到巨大活化状态的Mφ募集各种炎性细胞现象(图2D)。
2.2.4 伴有感染者免疫细胞高表达HLA-DR 活化状态的 DC(图2E)、Mφ(图2F)和 MC(图 2G)HLA-DR呈强阳性表达。伴感染者骨髓造血细胞岛中高表达HLA-DR的巨大Mφ捕获病变血细胞现象多见(图2H)。间断应用糖皮质激素治疗者,骨髓中约1/2的DC、Mφ不表达HLA-DR。
2.2.5 RIRH患者骨髓中免疫细胞捕获表达抗人IgG病变血细胞现象多见 部分病变的血细胞膜抗人IgG IF呈带状阳性,EOS(图2A)和MC(图2B)特异性颗粒结合大量抗人IgG IF,活化的DC(图2C)和Mφ粘附捕获病变血细胞现象多见;血清IgG显著升高者骨髓中,造血细胞岛中Mφ与病变血细胞连接处大量抗人IgG IF沉积(图2D),对照组骨髓造血细胞膜抗人IgG IF阴性。
2.2.6 RIRH患者骨髓中活化的免疫细胞高表达FcγⅡR 缺铁性贫血和间断应用糖皮质激素患者骨髓中Mφ低表达FcγⅡR(图3F),伴有感染血清IgG升高的RIRH患者骨髓中,活化的Mφ表达FcγⅡR的数量显著增多(图3G),与病变的造血细胞结合形成巨大的Mφ型造血细胞岛多见(图3H),提示感染加重造血损伤。活化的DC不表达FcγⅡR,而EOS则强阳性表达(图3E)。
2.2.7 RIRH患者骨髓中活化的免疫细胞高表达MR 缺铁性贫血和间断应用糖皮质激素患者骨髓中DC和Mφ呈颗粒状弱表达MR(图3J),伴有感染的RIRH患者骨髓中DC(图3I)、EOS(未显示)和Mφ(图3K)表达 MR的数量显著增多,在 IgG和ESR升高的全血细胞减少RIRH患者骨髓中,由高表达MR的Mφ与病变血细胞组成的造血细胞岛多见(图3L),提示造血损伤加重。

表1 细胞因子检测结果(ng/L)Tab.1 Serumal level of cytokines(ng/L)
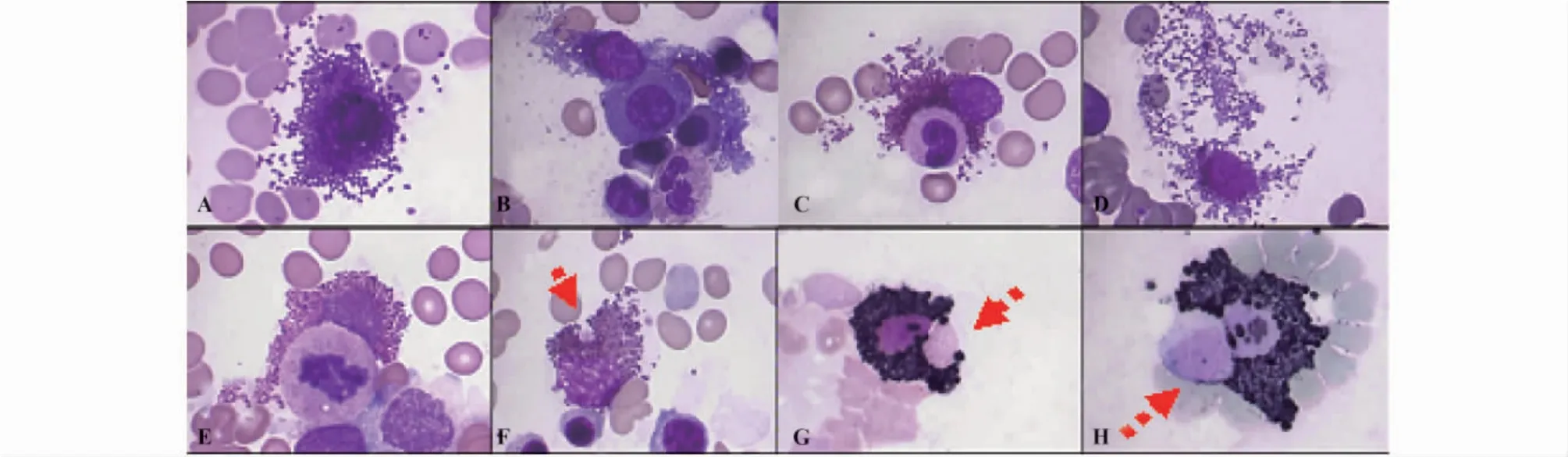
图1 RIRH患者骨髓中活化的组织嗜碱细胞和嗜酸性粒细胞(×1 000)Fig.1 Activated tissue basophil and eosinophil in bonemarrow of RIRH patients( ×1 000)
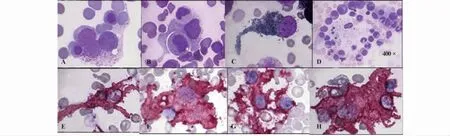
图2 RIRH患者骨髓中奇异的Mφ和免疫细胞HLA-DR表达情况(×1 000)Fig.2 Weird expression of HLA-DR on Mφ and other immunocyte in marrow of RIRH patients( ×1 000)

图3 RIRH患者骨髓中免疫细胞表达IgG、FcγⅡR和MR(×1 000)Fig.3 IgG,FcγⅡR and MR were observed to be expressed by immunocyte in marrow of RIRH patients( ×1 000)
2.2.8 感染促进粘附分子ICAM-1表达 伴有感染的RIRH患者骨髓中活化的DC(图4A)、EOS(图4B)和Mφ(图4C)高表达粘附分子ICAM-1,缺铁性贫血与间断应用糖皮质激素的RIRH患者,上述免疫细胞呈颗粒状弱表达ICAM-1(图4D),提示感染可上调粘附分子表达,促进免疫细胞参与对造血细胞的炎性反应过程。
2.2.9 RIRH患者骨髓免疫细胞高表达IL-12和IL-17A及其受体 骨髓中DC(图4E)、EOS(图4F)和Mφ(图4G)胞浆中呈分泌状表达IL-12,缺铁性贫血患者骨髓中DC和EOS不/弱表达,Mφ呈灶性弱表达(图4H)。缺铁性贫血和血清IgG升高骨髓呈体液免疫活化优势状态的RIRH患者骨髓中,DC不表达IL-17A,而在血清HLA-B27升高的RIRH患者骨髓中,活化的DC(图4I)、EOS(图4J)和Mφ(图4K)均高表达IL-17A,缺铁性贫血患者骨髓中仅少量造血细胞表达IL-17RA,伴有感染的RIRH患者骨髓细胞中广泛表达IL-17RA(图4L),提示感染使IL-17A与IL-17RA结合的细胞数量增多,能放大由其介导的炎性反应。
2.3 药物治疗效果
2.3.1 经糖皮质激素联合抗感染等药物治疗1周后,患者血清IgG和ESR逐渐下降,血象逐渐恢复直至正常。伴有HLA-B27升高全血细胞减少的RIRH患者血象恢复迟缓,经联合CsA治疗4周后,患者血象开始恢复;复查骨髓可见EOS的POX活性减弱,Mφ核凋亡现象多见,2/3的 DC和 Mφ HLA-DR转阴。
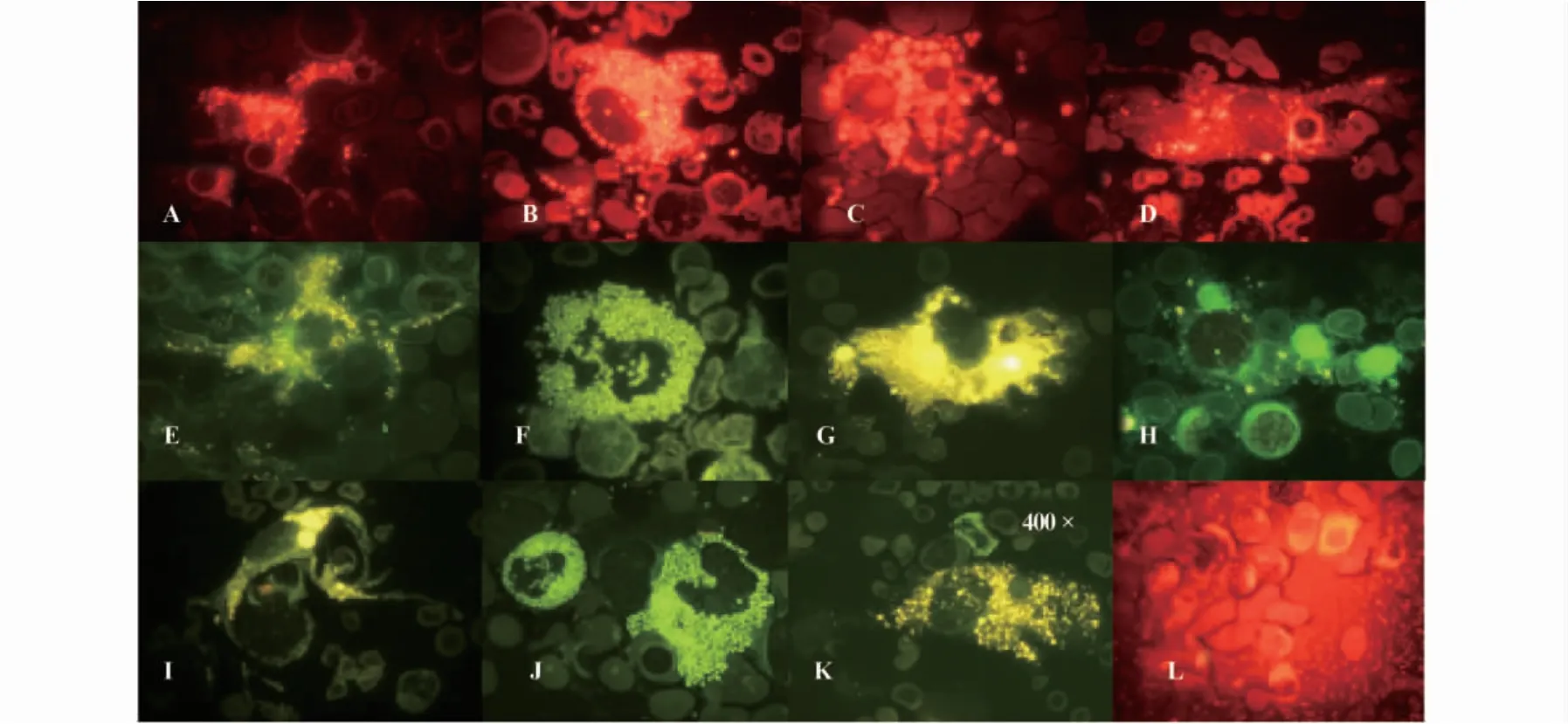
图4 免疫细胞表达ICAM-1、IL-12、IL-17A和IL-17RA(×1 000)Fig.4 ICAM-1,IL-12,IL-17A and IL-17RA were expressed by immunocyte in marrow of RIRH patients(×1 000)
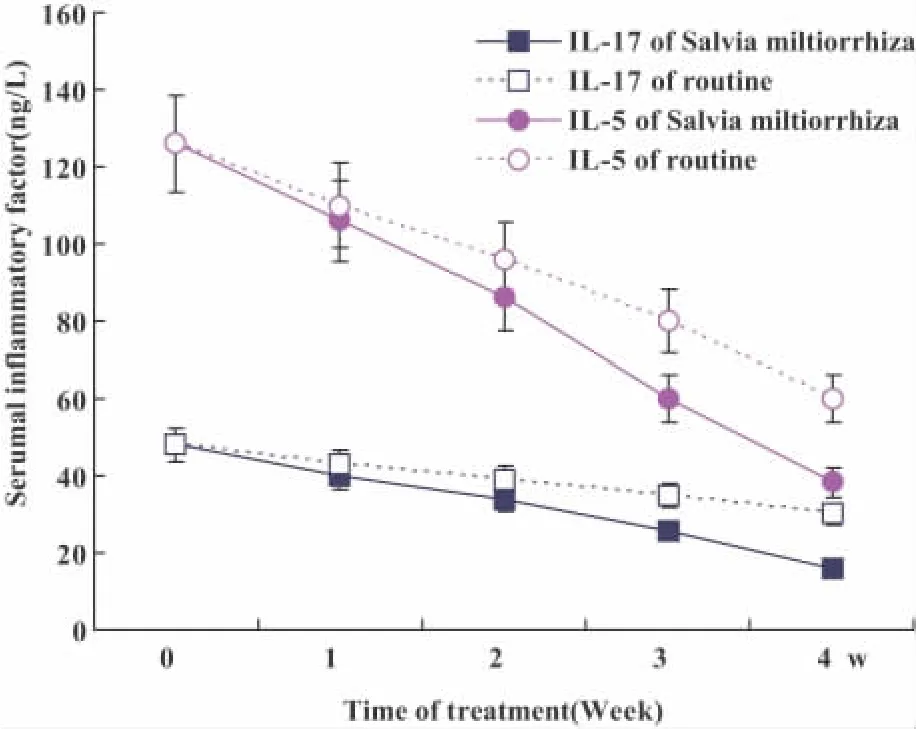
图5 联合复方丹参治疗对患者血清炎性因子清除的动态观察Fig.5 The analysis of compound Salvia miltiorrhiza to remove serumal inflammatory factors
2.3.2 复方丹参联合免疫抑制剂治疗能促进患者血清炎性因子清除 32例RIRH联合复方丹参治疗2周以后,血清IL-5和IL-17含量较之未联合复方丹参组显著降低(图5),血象恢复时间较之未联合复方丹参组提前1周,骨髓中表达IL-17A和IL-17RA的免疫细胞及造血细胞比例,较之对照组显著减少。两组间差异显著,P<0.05。
3 讨论
风湿免疫系统疾病是各种致病因素诱发机体免疫系统对自身成分发生免疫应答而导致的自身免疫性疾病状态。患者体内存在针对自身成分产生的自身抗体和/或自身反应性T淋巴细胞,能介导对自身细胞或组织成分获得性免疫应答。由于疾病慢性迁延和反复发作,以及自身抗体的分子模拟和抗原表位扩展,最终累及造血系统,致使患者体内部分血细胞膜抗原结构改变,引发了针对病变血细胞(靶细胞)的风湿免疫相关性血细胞减少(RIRH)超敏反应病理过程和疾病状态,感染免疫活化能加重对造血细胞的免疫损伤作用[4]。
我们的研究发现,该类患者除伴有自身免疫性疾病外,临床主要表现为外周血两系或三系(全血细胞)减少,骨髓增生活跃,组织嗜碱细胞、嗜酸性粒细胞、树突状细胞和巨噬细胞等多种免疫细胞活化。部分患者由于间断服用糖皮质激素,骨髓中浆细胞和巨噬细胞形态异常,功能受抑。而伴WBC减少的患者骨髓中,活化的嗜酸性粒细胞攻击POX活性减弱或消失的病变中性粒细胞现象增多,是RIRH患者重要的骨髓特征,同时也提示嗜酸性粒细胞在RIRH造血细胞损伤病理过程中,起到至关重要的作用。
我们的研究结果显示,RIRH患者由于长期处于免疫紊乱状态,其血清中 IL-5、IL-10、IL-12、IL-17和IFN-γ等多种与自身免疫相关联的炎性因子升高,其中促进嗜酸性粒细胞增殖的IL-5和作为炎性介质的IL-17的升高率为100%,而活化细胞免疫的炎性因子IL-12升高率为97.0%,表明这些介导自身免疫性炎性因子与RIRH造血细胞炎性损伤的病理过程密切关联[5,6]。
我们的研究结果还显示,由于患者体内存在针对自身病变造血细胞膜的IgG抗体,其骨髓中部分病变血细胞膜抗人IgG IF阳性表达,诱导自身抗体产生,由于原发病导致患者体内免疫紊乱状态,多种免疫细胞活化,以不同方式攻击病变血细胞,是RIRH骨髓造血细胞病理性损伤重要的特征。部分患者由于WBC减少和间断应用糖皮质激素,极易并发感染加重病情。患者骨髓中巨噬细胞可上调表达FcγⅡR和 MR,介导 ADCC效应;上调 ICAM-1表达,促进免疫细胞对病变血细胞的粘附、捕获和吞噬,是患者造血细胞破坏的重要方式[7-9]。
我们的研究发现,RIRH患者骨髓中,活化的免疫细胞高表达IL-12和IL-17A,提示其可能具有分泌这些炎性介质的功能;能通过介导骨髓造血微环境的血管炎性病变,影响造血细胞的生长发育,损伤和破坏病变造血细胞,亦为该类患者骨髓造血细胞破坏的另一重要因素。
药物治疗结果及IL-5和IL-17追踪分析指标表明,在抗感染、应用糖皮质激素和CsA等药物,抑制免疫细胞对造血细胞破坏作用同时,对血小板>50×109L-1无出血倾向患者,谨慎联合复方丹参等活血化瘀药物治疗,有利于炎性因子的代谢和清除,改善骨髓造血微环境,促进疾病恢复。
1 孙黎飞,韩 冰,吴强强 et al.人类白细胞抗原B27在免疫相关性血细胞减少患者诊疗中的意义[J].中华内科杂志,2012;51(7):557-559.
2 孙黎飞,韩 冰,吴强强et al.免疫相关性血细胞减少患者骨髓造血细胞端粒酶活性检测的临床意义[J].中华医学杂志,2012;92(36):2530-2533.
3 孙黎飞,韩 冰,李 钢et al.骨髓造血细胞岛在免疫相关性血细胞减少患者中的异质性研究[J].中国免疫学杂志,2012;28(5):300-304.
4 何 维主编.医学免疫学[M].北京:人民卫生出版社,2006:318-321.
5 Deng I,Younge B R,Olshen R A et al.Th17 and Th1 T-cell responses in gaint cell arterritis[J].Circulation,2010;121:906-915.
6 Ekinici N S.IL-17A has an important role in the acute attacks of Behcet`s disease[J].Rheumatology,2011;50:293-298.
7 Crespo H,Jauregui P,Glaria I et al.Mannose receptor may be involved in small ruminant lentivirus pathogenesis[J].Vet Res,2012;43(1):43.
8 Giraldi-Guimares A,de Freitas H T,Coelho Bde P et al.Bone marrow mononuclear cells and mannose receptor expression in focal cortical ischemia[J].Brain Res,2012;1452:173-184.
9 Liu Z,Ma Y,Moyer M P et al.Involvement of the mannose receptor and p38 mitogen-activated protein kinase signaling pathway of the microdomain of the integral membrane protein after enteropathogenic Escherichia coli infection [J].Infect Immun,2012;80(4):1343-1350.